基于Fenton反應產生的羥自由基檢測方法比較
趙淑銳,楊 源,鄭美青,薛 冰
(首都醫科大學 中心實驗室,北京 100069)
自由基是含有未成對電子的原子基團,具有非常活潑的化學性質,易失去或得到電子而發生氧化還原反應。這類物質不但可以直接參與生物體的一些生理和病理過程,而且在體內的多種疾病發生發展過程中扮演著重要角色[1-2]。
芬頓(Fenton)反應是一種非常成熟的產生羥自由基的方法,由于其高效、廉價、選擇性好等特點被廣泛應用于研究。芬頓反應所需試劑包含 Fe2+和H2O2,其中Fe2+作為催化劑存在。其反應機制是H2O2和Fe2+反應生成強氧化能力的羥自由基和Fe3+,Fe3+又被H2O2還原回Fe2+,形成循環反應,直至H2O2耗盡,反應終止[3]。由于羥自由基存在壽命短、濃度低等問題,在檢測方面存在一定的難度。目前研究中大多采用幾種間接方式,如電子自旋共振法(ESR)、熒光法、分光光度法等。
本文采用芬頓反應體系中加入羥自由基清除劑—抗氧化劑維生素C 的方法,以觀察羥基自由基效應是否減弱或消除[4],考察電子自旋共振法(ESR)、熒光法、分光光度法3 種檢測方法中維生素C 對芬頓反應產生羥自由基的清除作用。為體內、體外氧化反應中羥基自由基的測量提出了一個思路和參考方法。
1 儀器與試劑
1.1 儀器
電子順磁共振波譜儀(ESR)JEOL JES-FA300,RF-5000 熒光分光光度計(Shimadzu 公司,日本),UV-2450 紫外-可見分光光度計(Shimadzu 公司,日本)、分析天平(220 g/0.1 mg)、玻璃毛細管(0.9~ 1.1 mm)、封口膠、順磁管、25 mL 容量瓶。
1.2 試劑
DMPO(5,5-Dimethyl-1-pyrroline N-Oxide,5,5-二甲基-1-吡咯啉-N-氧化物)、維生素 C 購自美國Sigma-Aldrich 公司;水楊酸(分析純)、苯甲酸(分析純)、30%市售H2O2、FeCl3(分析純)、FeSO4·7H2O(分析純)均購自北京化學試劑公司。
2 實驗方法
2.1 熒光分光光度法測定羥自由基
熒光分光光度法利用Fenton 體系產生·OH,與熒光很弱的苯甲酸反應,生成具有強熒光的二羥基苯甲酸[5],加入清除劑清除·OH,使體系熒光強度降低,通過測定體系熒光強度的變化間接測定體系·OH 變化。
2.1.1 配制溶液
配制15 mmol/L 的磷酸鹽緩沖溶液(pH 7.4),準確稱取61.0 mg 苯甲酸溶于20 mL 超純水中,得到25 mmol/L 的苯甲酸水溶液,準確稱取 5.6 mg FeSO4·7H2O 溶于10 mL 超純水中,得到2 mmol/L 的FeSO4水溶液,市售濃度30% H2O2稀釋20 倍得1.5%的H2O2溶液,準確稱取維生素C 35.2 mg,加入1 mL超純水得到濃度為200 mmol/L 的維生素水溶液,然后用超純水稀釋至10、30、50、70、90、110 mmol/L。
2.1.2 測定不同濃度維生素C 清除·OH 的能力
取7 支5 mL EP 管,每支加入pH7.4 磷酸鹽緩沖溶液2.0 mL,25 mmol/L 苯甲酸水溶液0.5 mL,2 mmol/L 的FeSO4水溶液0.4 mL。其中一支EP 管作空白加超純水0.1 mL,其余6 支分別加入10、30、50、70、90、110 mmol/L 的維生素C 水溶液0.1 mL;最后再分別加入1.5%H2O2水溶液0.1 mL。混勻,室溫下反應45 min[6],于λex300 nm、λem408 nm 波長處測定各管的熒光強度F,并計算不同樣品對·OH 的清除率[7]。清除率I(%)的計算公式:I=(F0-Fx)/F0×100。式中:F0為空白對照樣品熒光強度測量值;Fx為加入待測樣品的熒光強度測量值。根據濃度與清除率的變化,計算出維生素C 清除羥自由基的IC50值。
2.2 紫外可見光分光光度法測定羥自由基
利用·OH 能選擇性攻擊水楊酸(SA)產生二羥基苯甲酸,由于酚羥基與Fe3+顯色反應生成紫紅色配合物,用紫外可見光分光光度計測定530 nm 處吸光值可反映體系中·OH 濃度,加入·OH 清除劑會使水楊酸-Fe2+-H2O2溶液吸光度降低[8]。
2.2.1 配制溶液
準確稱取13.9 mg FeSO4·7H2O 溶于10 mL 超純水中,得到5 mmol/L 的FeSO4水溶液,準確稱取8.1 mg FeCl3溶于10 mL 超純水中,得5 mmol/L 的FeCl3水溶液,市售濃度30% H2O2稀釋300 倍得0.1%的H2O2溶液,準確稱取13.8 mg 水楊酸,溶于10 mL 乙醇溶液中得5 mmol/L 的水楊酸乙醇溶液,將節2.1.1 中所得200 mmol/L 的維生素C 水溶液稀釋40 倍,得到濃度為5 mmol/L 的維生素C 水溶液。
2.2.2 水楊酸與不同試劑的光譜掃描
取6 只25 mL 容量瓶,每只容量瓶中加入3 mL 5 mmol/L 的水楊酸乙醇溶液,6 只容量瓶分別加入FeSO4水溶液、FeCl3水溶液、0.1%H2O2溶液、5 mmol/L的維生素C 水溶液,1 mL 的5 mmol/L 的FeSO4水溶液和0.1%的H2O2溶液、超純水各1 mL,最后加超純水定容到25 mL 并搖勻,20 min 后對上述6 種溶液進行光譜掃描[9],保存數據。
2.2.3 測定不同濃度維生素C 清除·OH 的能力
取8 只25 mL 容量瓶,每只加入3 mL 的5 mmol/L的水楊酸乙醇溶液和1 mL 5 mmol/L 的FeSO4水溶液;其中1 只作為未損傷組加超純水定容至25 mL,1 只作為損傷組加1 mL 0.1%的H2O2溶液后加水定容至25 mL,其余6 只分別加入1、2、3、4、5、6 mL 的5 mmol/L 的維生素C 水溶液,然后每只加入1 mL 0.1%的H2O2溶液后定容到25 mL,搖勻。室溫反應20 min,測定530 nm 波長處的吸光度A,根據所得數據計算不同組樣品對·OH 的清除率[9-10]。清除率I(%)的計算公式:I=(Ae-Ax)/(Ae-A0)×100%。式中:A0為未損傷組吸光度的測量值,Ae為損傷組的吸光度測 量值,Ax為加入待測樣品的吸光度測量值;根據濃度與清除率的變化,計算出維生素C 清除羥自由基的IC50值。
2.3 電子順磁共振波譜法測定羥自由基
1945 年發展起來的電子順磁共振技術,為自由基的檢測開辟了新的途徑。其原理是利用自旋捕捉劑與不穩定的自由基發生反應,產生另外一種穩定的,可以用電子自旋共振波譜法檢測的新自由基(自旋加合物)。DMPO(5,5-Dimethyl-1-pyrroline N-Oxide,5-二甲基-1-吡咯啉-N-氧化物)作為自旋捕捉劑捕捉·OH,生成穩定形態的DMPO-OH,可進行ESR 分析,其特征圖譜為1∶2∶2∶1[11]。其反應式為:Fe2++H2O2→ Fe3++OH-+·OH,DMPO+·OH → DMPO-OH。
2.3.1 配制溶液
準確稱取13.9 mg 的FeSO4·7H2O 溶于5 mL 超純水中,得到10 mmol/L 的FeSO4溶液;將市售濃度30% H2O2稀釋30 倍,得濃度1%的H2O2溶液;準確稱取250 mg 的DMPO,加入22 mL 水溶解得到濃度為100 mmol/L 的DMPO 水溶液。將節2.1.1 中得到200 mmol/L 的維生素 C 水溶液稀釋 4 倍得到50 mmol/L 的維生素C 水溶液。用超純水稀釋至9.6、8.0、6.4、4.8、3.2、1.6 mmol/L。
2.3.2 測定不同濃度維生素C 清除·OH 的能力
測定對照樣品以扣除試劑本身對自由基的影響,將10 mmol/L 的FeSO4·7H2O 溶液、超純水、100 mmol/L的DMPO 水溶液,1%的H2O2溶液各取5 μL 按順序加入EP 管中,渦旋混勻后利用虹吸原理吸入石英毛細管中,放入樣品保護測試管,記錄反應時間保持測試液在反應1.5 min 時進行測定。測樣品時用樣品溶液代替超純水,其余操作同上。每個濃度平行測定3次,測量后取平均值。測試參數為Center filed:336mT,Sweep width:7.5×1,Sweep time:30.0s,Mod width:0.35 ×1,Amplitude:2.00 ×100,Power:1 mW;自由基清除率I(%)的計算公式:I=(h0-hx)/h0×100%;式中:h0為對照樣品中ESR 譜信號強度測量值;hx為樣品中ESR 譜信號強度測量值[12]。I值越大,表明樣品清除自由基能力越強。根據濃度與清除率的變化,計算出維生素C 清除羥自由基的IC50值[12]。
3 結果及討論
3.1 熒光分光光度法測定維生素C 清除羥自由基的結果
熒光分光光度法測定的實驗結果表明(見表1),維生素C 與空白對照相比表現出明顯的清除·OH 的活性。不同濃度維生素C 清除羥自由基曲線如圖1 所示,隨著維生素C 濃度的增加,其清除能力也逐漸增加。在3.55 mmol/L 濃度時,測到的信號熒光強度接近基線,顯示了較強的清除能力,計算熒光分光光度法測定維生素 C 清除羥自由基半數清除率 IC50為0.965 7 mmol/L。
苯甲酸-Fenton 體系熒光分光光度法法利用Fenton 體系產生·OH,與熒光很弱的苯甲酸反應,生成具有強熒光的二羥基苯甲酸。該方法測量簡單、方便、準確,但是影響熒光強度的因素較多,包括環境溫度、酸度、溶劑、光照等。另外羥自由基壽命很短,在溶液中大約只能存在微秒級,且濃度很低,因此在室溫下需要有足夠反應時間,才能不斷產生羥自由基與苯甲酸反應。該方法有文獻報道45 min 后熒光強度達到最大并且最穩定[13]。由于溶液中熒光物質的熒光效率和熒光強度會隨著溫度的升高而降低,因此要注意實驗過程中環境溫度的影響。
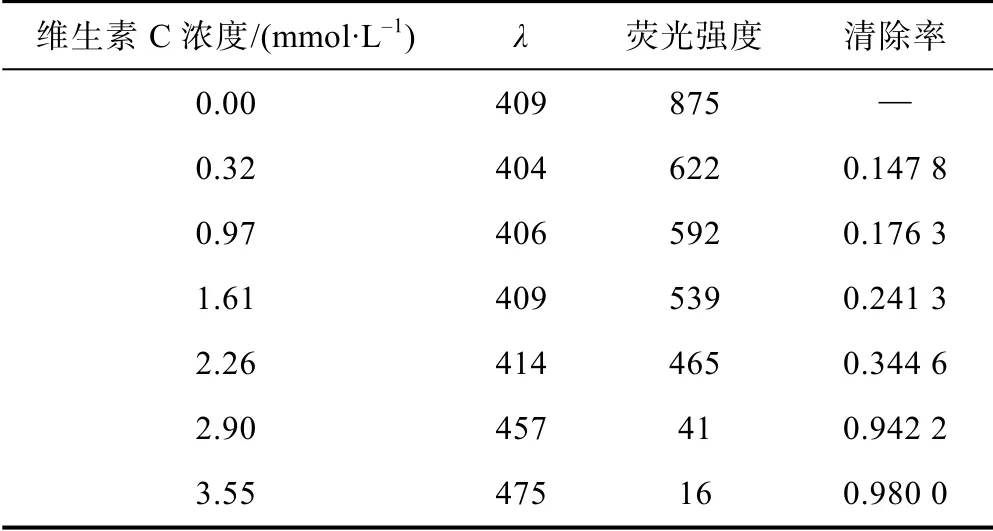
表1 熒光法測定不同濃度維生素C 清除·OH 的熒光強度及清除率
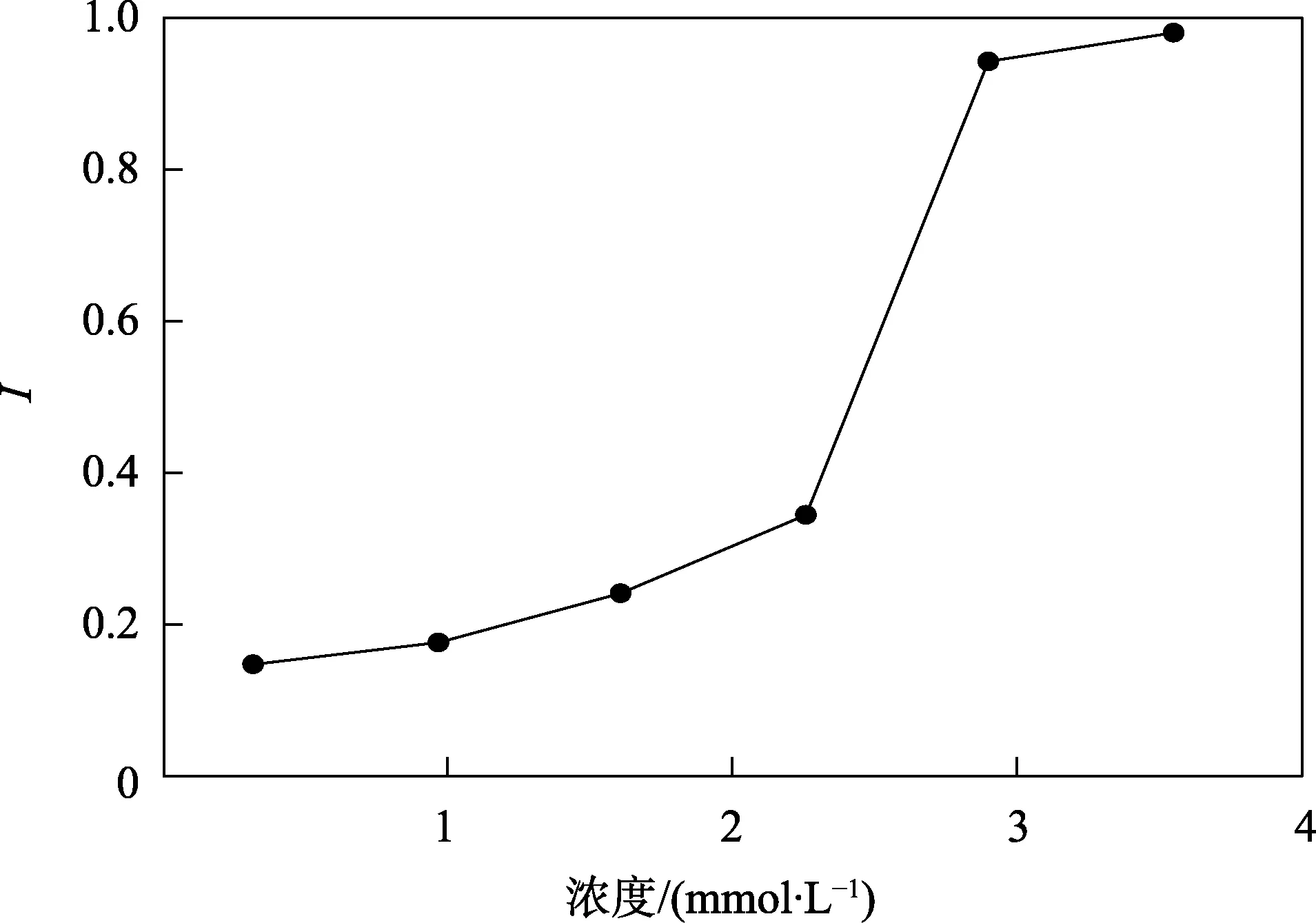
圖1 熒光分光光度法測定不同濃度 維生素C 清除·OH 曲線
3.2 紫外可見光分光光度法測定維生素C 清除羥自由基的結果
對水楊酸、水楊酸-Fe2+、水楊酸-Fe3+、水楊酸-H2O2、水楊酸-維生素C、水楊酸-Fe2+-H2O2溶液進行紫外可見光光譜掃描,發現其中水楊酸、水楊酸-Fe2+、水楊酸-H2O2、水楊酸-維生素C 的紫外可見光吸收光譜基本相同,但從圖2 可以看出,水楊酸-Fe2+、水楊酸-Fe3+、水楊酸-Fe2+-H2O2的紫外吸收光譜存在一定差異,各組差異吸光度值見表2。水楊酸-Fe3+、水楊酸-Fe2+-H2O2溶液為紫紅色,最大吸收波長為530 nm,二者吸收曲線相同;水楊酸-Fe2+在530 nm 波長處沒有最大吸收,但加入H2O2后在530 nm 處則會產生明顯吸收;水楊酸、水楊酸-H2O2、水楊酸-維生素C 在530 nm 波長處均未發現吸收。
紫外分光光度法實驗結果表明:維生素C 表現出明顯的清除·OH 的活性(見表3)。隨著維生素C 濃度的增加,清除能力也逐漸增加。計算水楊酸-紫外分光光度法測定維生素C 清除羥自由基半數清除率IC50為0.810 8 mmol/L。
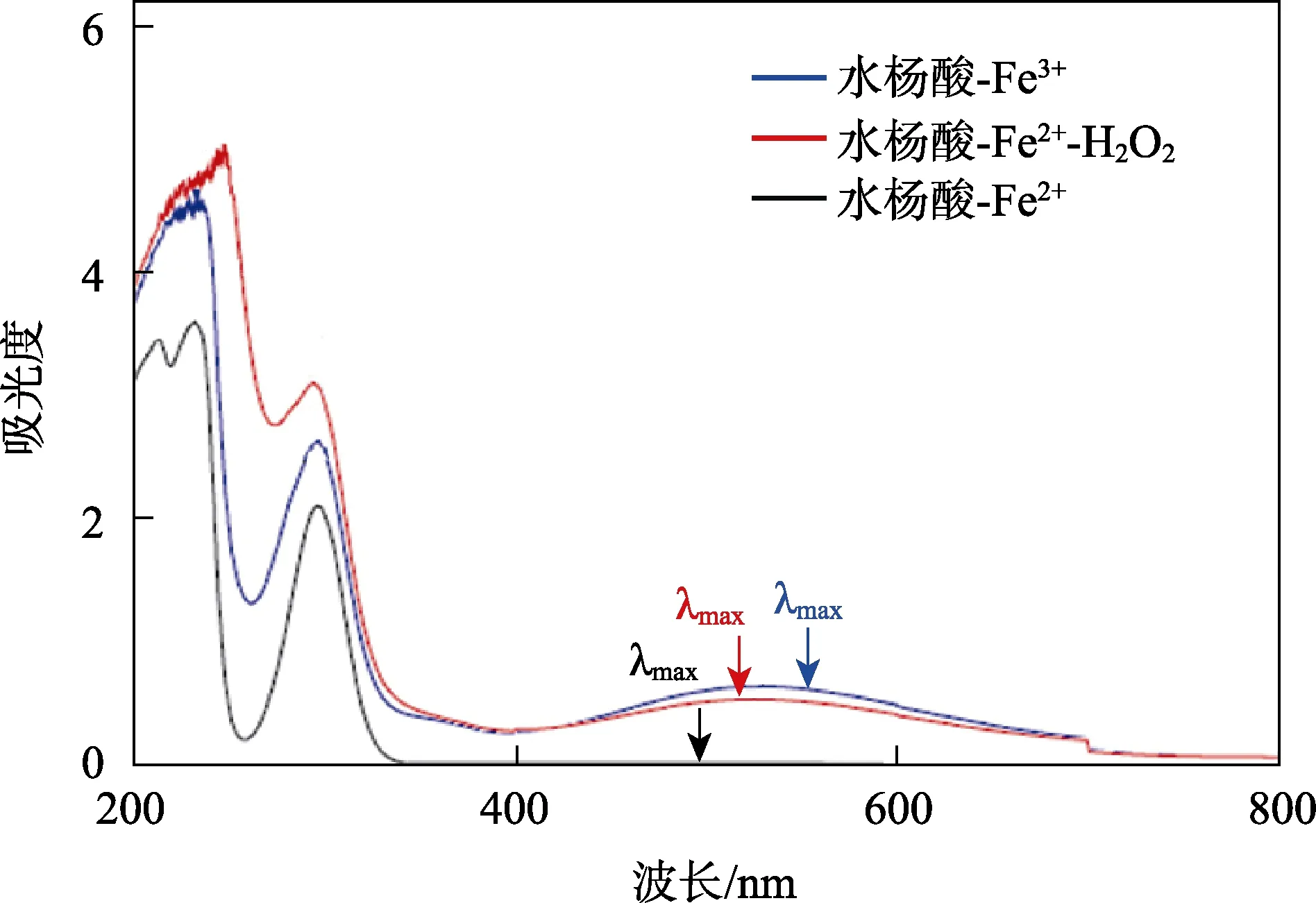
圖2 紫外可見光分光光度計掃描的吸收曲線
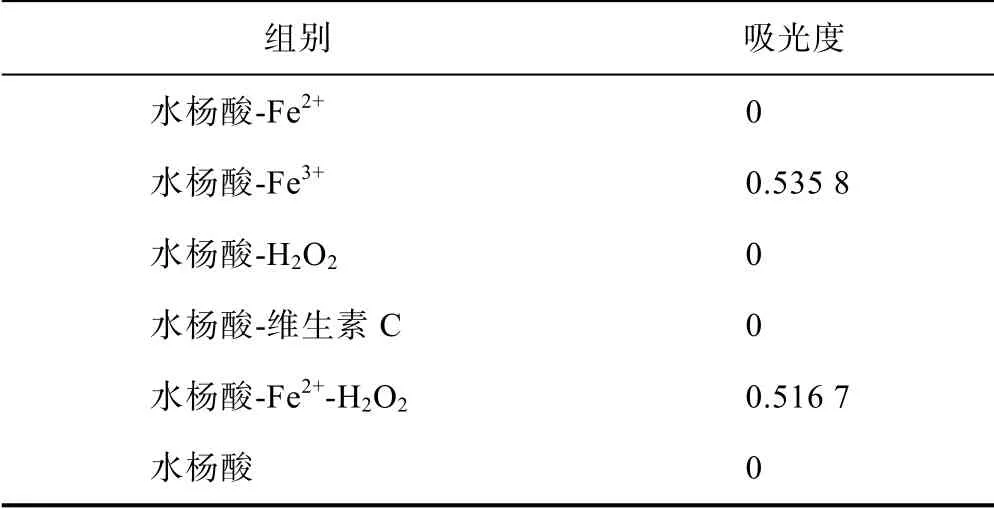
表2 紫外可見光分光光度法測定各組 樣品在530 nm 處的吸光度
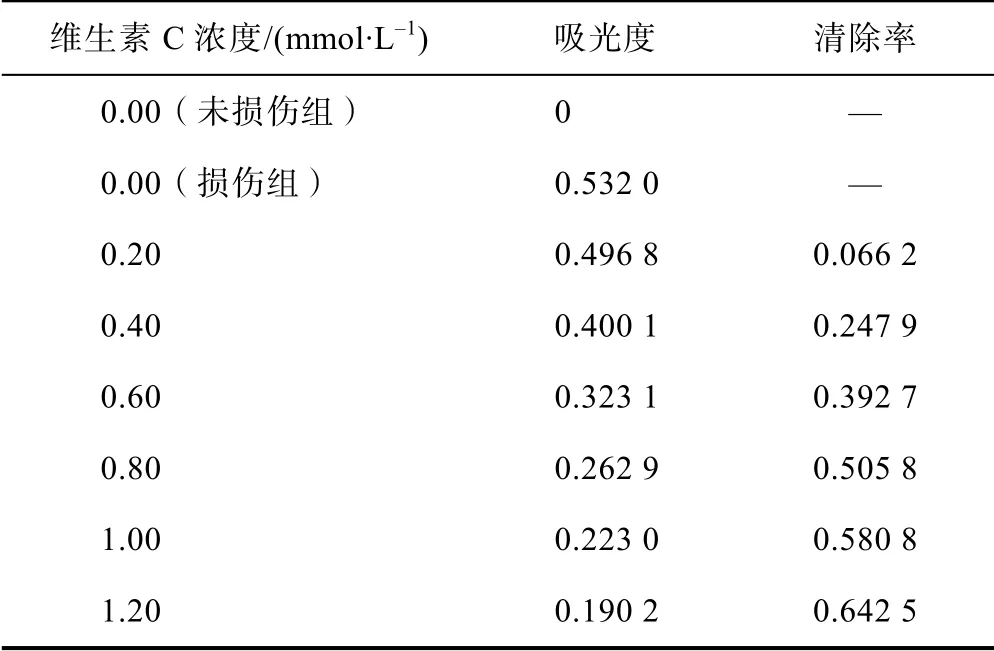
表3 紫外可見光分光光度法測定不同組別 在530 nm 處的吸光度值及清除率
由實驗結果可以看出,水楊酸-紫外可見光分光光度法測定羥自由基具有測量簡單、便捷、準確等優點。但是,因為反應過程相對比較復雜,水楊酸與羥自由基反應可生成2,3-二羥基苯甲酸或2,5-二羥基苯甲酸,有很多的中間產物與支線產物。此外羥自由基的壽命很短,特別是濃度很低的時候,因此需要提供足夠的反應時間,使不斷產生的羥自由基與水楊酸反應,直到產生足夠實驗檢測的二羥基苯甲酸。因此水楊酸-紫外分光光度法測定羥自由基所需要的時間相對較長。此外,由于此方法測量的基本原理是基于酚羥基與Fe3+顯色反應生產的紫紅色物質,一旦測試實驗中存在還原性很強的物質,就會導致Fe3+被還原,從而影響實驗結果的可靠性[14]。
3.3 電子順磁共振波譜法測定維生素C 清除羥自由基的結果
電子順磁共振波譜法實驗結果(見表4)表明:與空白對照相比,維生素C 表現出明顯的清除·OH 的活性,不同濃度維生素C 清除·OH 信號見圖3。可以明顯地看出隨著維生素C 濃度的增加,羥自由基加合物的信號也明顯減弱,表明其清除能力也逐漸增加。依據清除率計算電子順磁共振波譜法測定維生素C 清除羥自由基半數清除率IC50為0.738 1 mmol/L。
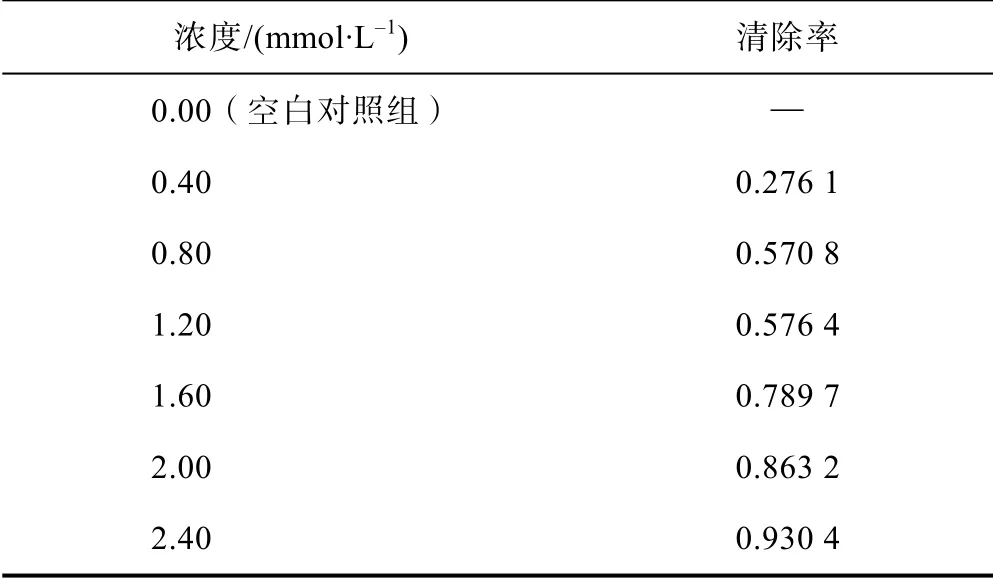
表4 順磁法測定維生素C 清除·OH 自由結果
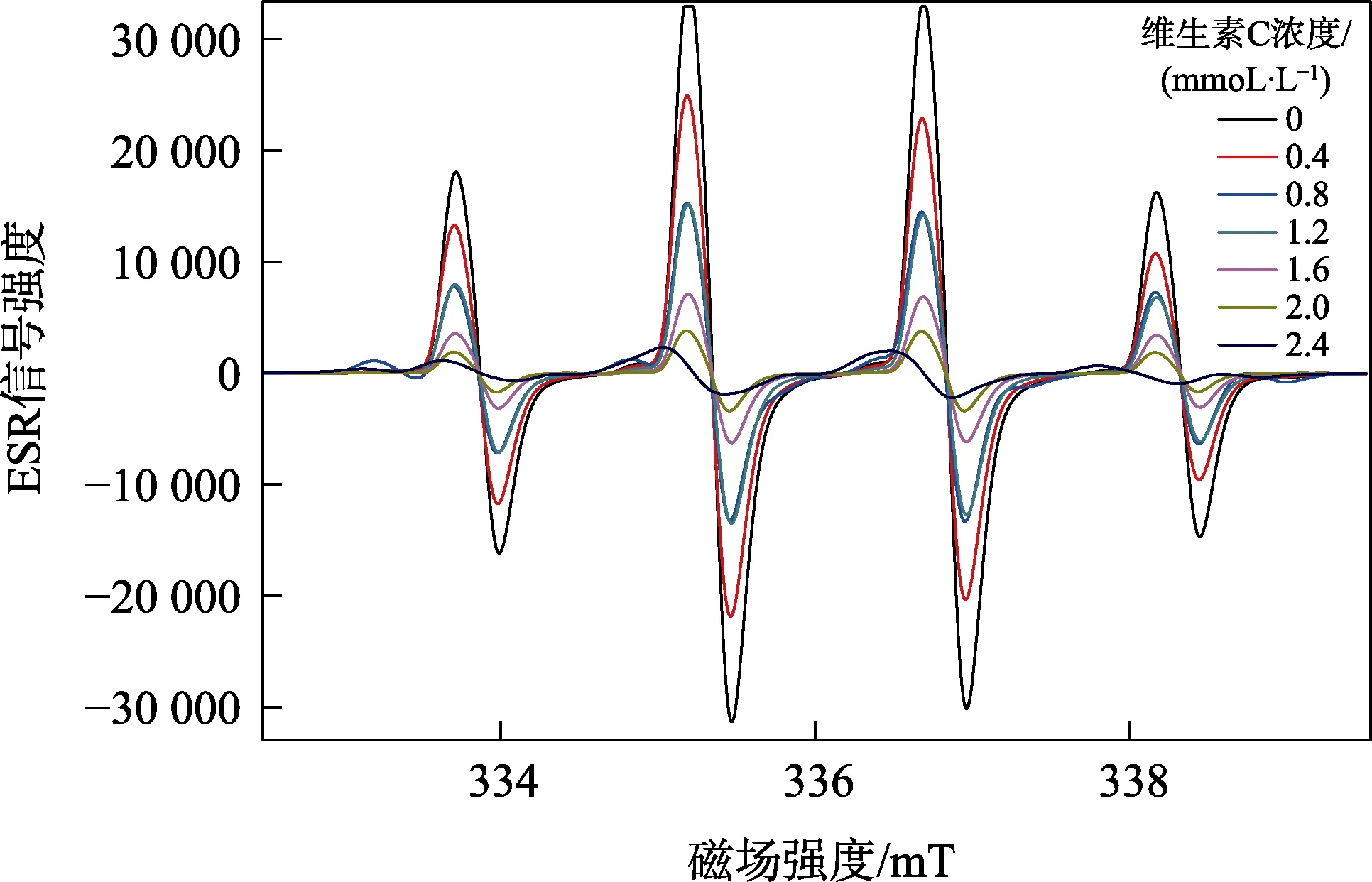
圖3 不同濃度維生素C 清除羥自由基的ESR 圖譜
由電子順磁共振波譜法實驗結果可以看出,運用自由基捕集劑(DMPO-ESR)技術測定羥基自由基的簡單快速有效,DMPO 作自由基捕獲劑與羥基自由基產生的自旋加合物的ESR 譜表現出1∶2∶2∶1 的特征譜線,可以提供自由基結構的詳細信息。該方法既可以用來定量檢測也可以用作定性檢測。但是它的儀器成本較高,還有一個因素就是大多自旋加合物都不能穩定存在,有的可能只能穩定存在幾分鐘或幾十分鐘[15],因此在實驗過程中應盡快進行測試,并精準控制測試的時間,以保證實驗的平行性。目前的研究領域主要在醫療、病理和藥理實驗等研究方面[16]。
4 結語
通過采用3 種不同的檢測方法檢測Fenton 反應產生的羥自由基,發現3 種測定方法均能夠準確地檢測羥自由基存在。其中熒光法、紫外可見光分光光度法測定羥自由基其中涉及多步反應屬于間接法檢測羥自由基,方法簡便、易操作,不涉及大型貴重儀器,適用于定量檢測中低濃度的羥自由基的研究。由于這2種方法均涉及反應時間問題,所以所需要的檢測時間相對較長。自旋捕捉-電子自旋共振技術能夠直接捕捉住目標羥基自由基,簡單易行。電子自旋共振法與熒光法、紫外分光光度法方法相比,具有靈敏度高、反應快速等優點,而且該方法可以提供自由基結構的詳細信息,也可以用作定性檢測。另外該方法對樣品的狀態基本沒有要求(固態、液態、氣態均可)。儀器比較昂貴,普遍性不高是該方法的主要缺點。相信隨著自由基研究領域以及科技的不斷發展,會有越來越多的先進且便捷廉價的檢測羥自由基的方法來完善這一檢測技術。

