LV-ERK1-RNAi轉染人非小細胞肺癌細胞的ERK1/2、DNA甲基轉移酶1表達觀察
張恒,孫宇,劉俊,陳尚威,周華富
1廣西醫科大學第一附屬醫院,南寧 530021;2廣西醫科大學第二附屬醫院
非小細胞肺癌(NSCLC)是多基因表達調控失衡共同作用得結果,由癌基因激活和抑癌基因失活引起分子方面的變異來啟動[1],而抑癌基因異常甲基化是其發展的重要因素。DNA甲基轉移酶(DNMTs)參與腫瘤發生發展,正是通過調節腫瘤細胞內甲基化實現的[2],其中DNMT1是催化基因甲基化的關鍵酶。我們的前期實驗顯示,NSCLC組織細胞抑癌基因啟動子區甲基化水平與DNMT1表達呈正相關性[3]。RNAi技術因其快速、高效、易于操作等優點,在基因功能分析及基因治療等眾多領域廣泛應用。絲裂原活化蛋白細胞外信號調節激酶MAPK/ERK通路調節多種生物學行為,其在真核生物中廣泛保守,并且在許多細胞程序如細胞增殖,細胞分化,細胞運動和細胞死亡中起重要作用,是迄今發現的一種較重要的生長信號調節蛋白。近年研究顯示,ERK1/2通路依據細胞類型以及不同的細胞環境中激活的基因決定,促進或抑制細胞增殖[4]。研究[5]表明,ERK激酶(MEK)/ERK信號通路的甲基化參與了癌癥的發生發展。進一步研究表明,ERK激活缺陷可導致DNMT1下調[6],此外包括E2F1和SP1在內的多種轉錄因子通過激活的MEK/ERK途徑介導DNMT1的轉錄激活,鑒定了激活的MEK/ERK信號通路可作為DNMT1在癌癥中調控和異常過表達的驅動力[7]。2019年2~5月,我們選取NCI-H1299細胞,以細胞外信號調節激酶1基因RNA干擾慢病毒載體(LV-ERK1-RNAi)轉染,并觀察細胞外信號調節激酶1(ERK1)、ERK2、DNA甲基轉移酶1(DNMT1)mRNA及ERK1、磷酸化ERK1(p-ERK1)、DNMT1蛋白表達情況。
1 材料與方法
1.1 細胞、病毒及主要試劑 人NSCLC細胞(NCI-H1299)。LV-ERK1-RNAi(55281-1)、對照病毒(CON077)(上海吉凱公司)。1640培養基(吉凱基因公司);胎牛血清(Ausbian公司);DMEM(Corning公司);胰酶(上海生工);Puromycin(Clontech公司);D-Hanks(吉凱基因公司);TRIzol(上海普飛);M-MLV(Promega公司);SYBR Master Mixture(TaKaRa公司);引物(上海吉凱基因公司);兔源性一抗ERK1及鼠源性一抗p-ERK1、DNMT1(Abcam公司),GAPDH、二抗(Santa Cruz公司)。
1.2 細胞培養、分組、LV-ERK1-RNAi轉染及轉染效率觀察 從液氮罐中取出細胞凍存管,迅速放入37 ℃水浴中,并不時搖動使其盡快解凍;完全解凍后,以1 300 r/min速度離心3 min,75%酒精擦拭凍存管消毒后,移至生物安全柜;吸去凍存液上清,加入1 mL新鮮的完全培養基重懸細胞,將其培養于含10%胎牛血清的1640+10%FBS完全培養基中,放置在37 ℃、5%CO2培養箱中。24 h后更換1次培養液繼續培養,保持細胞良好的生長狀態。將NCI-H1299細胞隨機分為3組,KD組和NC組按照慢病毒轉染細胞操作說明分別轉染LV-ERK1-RNAi、陰性對照病毒,CON組不作處理。參照預實驗確定的MOI=10,加入最適病毒量轉染16 h更換培養基繼續培養,轉染72 h后采用熒光顯微鏡觀察細胞轉染效率,轉染效率=(熒光視野下細胞數/普通光視野下細胞數)×100%。空白對照組細胞未見綠色熒光蛋白表達,陰性對照病毒組、LV-ERK1-RNAi組均見綠色熒光蛋白表達,且轉染72h后平均轉染效率達80%以上。
1.3 各組NCI-H1299細胞ERK1/2、DNMT1 mRNA檢測 轉染后72 h采用real time PCR法檢測。以TRIzol試劑提取RNA,Nanodrop 2000/2000C分光光度計分析測定所抽提RNA 的濃度及質量。逆轉錄試劑盒將RNA逆轉錄成cDNA。SYBR Master Mixture試劑盒和 real time PCR儀器進行分析。擴增條件:95 ℃變性30 s,95 ℃變性5 s,60 ℃退火和延伸30 s,共40個循環。CAPDH:5′-TGACTTCAACAGCGACACCCA-3′,5′-CACCCTGTTGCTGTAGCCAAA-3′;ERK1:5′-ATGTCATCGGCATCCGAGAC-3′,5′-GGATCTGGTAGAGGAAGTAGCA-3′;ERK2:5′-TTACGACCCGAGTGACGA-3′,5′-CTGTATCCTGGCTGGAATCT-3′;DNMT1:5′-GGACAGG-GGACCCACGAAAG-3′,5′-CACACCTCACAGACGCCACAT-3′。采用相對定量分析F=2-ΔΔCt分析基因相對表達差異,ΔCt=目的基因Ct值-內參基因Ct值;-ΔΔCt=NC組ΔCt平均值-各樣品ΔCt值;2-ΔΔCt反映各樣品相對NC組樣品目的基因的相對表達水平。
1.4 各組NCI-H1299細胞ERK1、p-ERK1、DNMT1蛋白檢測 轉染后72 h采用Western blotting法。接收細胞樣品,PBS洗滌兩次,加入裂解液;冰上裂解10~15 min后超聲破碎細胞,4 ℃、12 000 g,離心15 min;取上清,BCA法測定蛋白濃度,調整每個樣品蛋白濃度為2 μg/μL;制膠(濃度10%)、上樣(20 μg)、電泳,電泳結束后,使用轉移電泳裝置,將蛋白轉移到PVDF膜上;室溫封閉1 h,孵育一抗GAPDH(1∶4 000)、ERK1(1∶1 000)、p-ERK1(1∶1 000)、DNMT1(1∶500),4 ℃過夜,TBST洗膜4次,8 min/次;二抗室溫下孵育PVDF膜1.5 h,洗膜4次,8 min/次;ECL法結合X光片顯影。Image-J軟件對蛋白條帶進行灰度值分析,目的蛋白與內參GAPDH條帶灰度值比較計算ERK1、p-ERK1、DNMT1的相對表達量,實驗重復6次,取平均值。
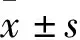
2 結果
2.1 各組細胞ERK1/2、DNMT1 mRNA相對表達量比較 細胞ERK1/2、DNMT1 mRNA相對表達量比較見表1。
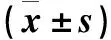
表1 各組細胞ERK1/2、DNMT1 mRNA相對表達量比較
注:與其余兩組比較,*P<0.05。
2.2 各組細胞ERK1、P-ERK1、DNMT1蛋白相對表達量比較 細胞ERK1、P-ERK1、DNMT1蛋白相對表達量比較見表2。
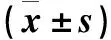
表2 各組細胞ERK1、P-ERK1、DNMT1蛋白相對表達量比較
注:與其余兩組比較,*P<0.05。
3 討論
肺癌是目前腫瘤相關死亡的首要原因,其中NSCLC占全部肺癌的85%左右,是常見的病理學類型。盡管以手術切除結合生物靶向、放化療的綜合治療使早期肺癌(Ⅰ期)的5年生存率達80%,然而有效的早期診斷手段缺乏使大多數患者在就診時已屬晚期(Ⅲb期和Ⅳ期),5年生存率不足10%[4]。原癌基因低甲基化會引起癌基因激活,促進腫瘤生長及轉移,抑癌基因高甲基化可導致抑癌基因正常轉錄、翻譯及表達受阻,不能發揮正常的抑瘤作用,最終細胞出現異常增殖,直至腫瘤發生。DNMTs催化完成癌細胞相關基因異常甲基化,是調控表觀遺傳學DNA甲基化的重要分子,DNMT1包含具有調節功能的較大N-末端結構域和催化功能的較小C-末端結構域[8],主要起維持甲基化酶作用,對抑制人癌細胞中抑癌基因的活性有重要作用,其表達升高被發現是腫瘤細胞早期分子改變的一個特征[9,10]
RNAi可特異性降解細胞內同源序列的mRNA,阻斷特定基因表達,被認為是一種雙鏈RNA誘發的基因沉默現象[11,12]。慢病毒介導的RNAi能夠在哺乳動物的細胞內穩定表達siRNA,且具有長期抑制基因表達,不易引起宿主免疫反應等特性[13]。因此,慢病毒介導RNAi已成為當前基因治療載體研究的熱點[14]。本研究通過利用慢病毒載體轉染細胞,我們獲得了穩定表達LV-ERK1-RNAi和陰性病毒細胞;成功構建了人NSCLCNCI-H1299細胞的ERK1基因沉默細胞。經由RT-PCR檢測證明該ERK1 RNAi慢病毒載體在NCI-H1299細胞中具有顯著的ERK1基因沉默效率。
作為MAPK信號通路的主要成員,ERK在肺癌組織中高水平表達[15]。一旦在細胞質中被激活,ERK1/2易位到細胞核中并與核底物相互作用以誘導特定的基因表達程序。近來研究顯示,該途徑的失調與腫瘤表觀遺傳的許多方面有關[16]。活性ERK磷酸化許多細胞質和核靶標,包括激酶、磷酸酶、轉錄因子和細胞骨架蛋白。持續的ERK信號傳導不僅促進這些基因的磷酸化和穩定化,并可以抑制抑制增殖的基因表達[17]。通常認為ERK1和ERK2基于它們的高序列同源性(85%)發揮相同的作用[18]。然而,有報道確定ERK1與ERK2具有同種型特異性功能,導致其信號傳導存在差異性,ERK2而非ERK1是細胞死亡的原因[18,19]。Fremin等[20]發現,在NIH-3T3細胞中,幾乎完全去除ERK1不影響細胞增殖,而同樣手段減少ERK2水平則顯著降低細胞增殖。在增殖的肝細胞中,僅去除ERK2減緩細胞增殖,然而在HeLa細胞[21]和卵巢癌細胞中[22],去除ERK1或ERK2減緩了細胞增殖。實驗中我們用干擾RNA單一沉默ERK1,經由RT-PCR檢測ERK2 mRNA水平,與對照NC組比較,KD組表達輕度升高,無統計學意義,不排除由于ERK1的敲低導致剩余ERK2的過度激活[23]。
總之,LV-ERK1-RNAi轉染后NCI-H1299細胞 ERK1、DNMT1 mRNA及ERK1、p-ERK1、DNMT1蛋白表達降低,ERK2表達正常,表明LV-ERK1-RNAi特異敲低ERK1而調控DNMT1的表達。

