HPLC法測定孕穗期水稻劍葉中多種內源激素的含量
尚蓉霞余欣石鴻宇吳漢武立權*李娟
(1安徽農業大學農學院,合肥230036;2安徽農業大學生命科學學院,合肥230036;3安徽省淠史杭灌區灌溉試驗總站,安徽六安 237158;4安徽農業大學生物技術中心,合肥 230036;第一作者:18235445708@163.cm;*通訊作者:Wlq-001@163.com;lj_welcome_ok@126.com)
植物內源激素是指由植物自身合成的一類生物活性物質。它們只以微小計量(含量一般為組織鮮質量的10-9~10-7數量級)即可對植物的生長發育、細胞分化、開花結果、抗逆性以及器官衰老過程進行調控[1-2]。在正常環境條件下,植物在各種激素相對平衡的調節下進行正常的生長發育和新陳代謝;但當遭遇逆境時,激素間的平衡遭到破壞,就會使植物的生長發育紊亂、新陳代謝失調[3]。
由于植物內源激素含量極低,性質不穩定、易分解,且前處理過程不能完全消除植物組織中復雜的基質干擾,因此獲得一種靈敏度高、專一性強、操作簡便、耗時短的檢測方法一直是國內外諸多學者研究的熱點[4]。傳統的檢測方法有生物檢測法、免疫檢測法和基于光譜或色譜的理化分析法。生物鑒定法最早用于檢測植物激素,它利用當激素作用于植物組織與器官時會產生特異性反應這一原理實現對植物激素的測定。生物鑒定法雖然方法簡便,但對樣品純度要求較高,需要復雜的樣品前處理作為支撐,同時由于其專一性、重復性較差,這類方法的應用逐漸減少[5]。免疫檢測法中以酶聯免疫吸附測定法(ELISA)最為常用,ELISA法需購買不同的試劑盒,這就使得被測組分和同一激素不同組分的定量分析被限制,且各組分之間存在交叉反應,降低了其靈敏度和選擇性,從而影響測定結果的準確性[6]。最早的光譜法是用比色法測定IAA,但是靈敏度和專一性較低,目前基本不再使用該方法。后來開發了紅外吸收光譜法、紫外吸收光譜法及熒光法等,雖然檢測的靈敏度得以提升,但其專一性較差,因而往往應用于對激素分子的結構鑒定及定性分析,定量分析較少采用該類方法[7]。現代分析植物激素最常見的色譜技術主要包括液質聯用(LC-MS)、氣相色譜法(GC)和高效液相色譜法(HPLC)。LC-MC費用頗高;GC法靈敏度高,但不同類激素要求不同的前處理和衍生化方法,難以同時測定多個激素,進而增加了材料的用量[8];HPLC是一種高效分離純化技術,具有靈敏度、分辨率都高,專一性強和重現性好等優點,被廣泛用于植物激素測定(除乙烯外)[9-11]。
水稻是我國的主要糧食作物。在水稻生產過程中,其產量和品質常常會遭受高(低)溫、干旱、鹽漬等非生物逆境的影響[12-13]。了解水稻內源激素在應對不同逆境脅迫中的調節規律,可為其抗逆栽培提供重要的生產實踐價值。但測定水稻中5種內源激素方法的研究很少。因此,筆者建立HPLC法來檢測水稻中的5種內源激素。
1 實驗方法
1.1 儀器與試劑
Waters600高效液相色譜系統(美國Waters公司);超純水制備系統(美國Millipore公司);JW-3021HR高速冷凍離心機(嘉文);ZHWY-200B恒溫培養振蕩器;Centrifuge 5417R超速冷凍離心機(eppendorf);MGC-300H人工氣候箱。ProElut SPE C18200 mg/3 mL。C185 um×4.6×250 nm。
玉米素(Z)(純度>98%,aladdin)、3-吲哚乙酸(IAA)、水楊酸(SA)(純度>99%,aladdin)、赤霉素(GA)和反式脫落酸(ABA)(純度分別≥96%和>98%,MACKLIN)、甲醇和乙酸(色譜純,美國TEDIA公司)、石油醚(分析純),其他試劑均為分析純,實驗用水均為超純水(18.2 MΩ·cm)。所有試劑在使用前均用 0.22 μm 有機膜過濾。
1.2 標準溶液配制
精確稱取Z、GA、IAA、ABA和SA標準品分別為0.2 mg、2 mg、0.2 mg、0.1 mg 和 0.4 mg 于 2 mL 的容量瓶,用甲醇溶解并定容至刻度,配制濃度分別為0.1 mg/mL Z、1 mg/mL GA、0.1 mg/mL IAA、0.05 mg/mL ABA和0.2 mg/mL SA的標準儲備溶液。用甲醇將儲備液依次稀釋2倍,連續進行4次,配成5份濃度依次相差2倍的系列標準溶液,以實際注入標準物的量為橫坐標,相應的峰面積為縱坐標作圖。
1.3 樣品前處理
試驗于2017年5月26日在安徽農業大學生物科技樓人工氣候室進行,以秈稻品種Nagina 22(Oryza sativaaus)為試驗材料。選種、消毒、浸種和催芽,選取發芽均勻一致的籽粒種于帶網格的塑料盆(高30 cm,內徑25 cm)中,每盆3株,一共72盆,置于人工氣候室培養;盆內盛有國際水稻Hoagland營養液(霍格蘭配方)[14],每3 d更換1次營養液;氣候室生長條件為晝/夜溫度為30℃/25℃,晝/夜光周期為12 h/12 h,相對濕度為75%,光照強度為3 000 Lx。本試驗各處理除溫度和模擬干旱外,其余環境設置均相同。試驗設正常生長(CK)、單一干旱(DT)、單一高溫(HT)及干旱–高溫同時(DH)4個處理。以葉齡余數法[15]診斷幼穗發育進程,此時大多數稻穗進入花粉母細胞減數分裂期[16-17]。其中,(1)正常對照:Hoagland營養液中不添加10% PEG-6000,晝夜溫度為 30℃/25℃;(2)單一干旱處理:在已有文獻[18]和前期預備試驗基礎上,明確了10% PEG-6000可使水稻達到中度干旱脅迫程度,故本研究確定采用10% PEG-6000 Hoagland澆灌模擬中度干旱脅迫,每處理重復3次,每重復6盆,培養3 d;(3)單一高溫處理:除人工氣候室晝夜溫度變為38℃/25℃外,其它條件不變[19],高溫連續處理3 d,每處理重復3次,每重復6盆;(4)干旱-高溫同時處理:用10% PEG-6000 Hoagland澆灌,且設高溫38℃/25℃處理3 d,每處理重復3次,每重復6盆。脅迫結束后,取水稻劍葉用超純水洗凈、擦干。準確稱取水稻劍葉樣品1g放入研缽,用液氮研磨,再轉移到5 mL的離心管中,加入3 mL 80%的冷甲醇,置于4℃冰箱浸提過夜。加1 g的 PVPP,以 10℃震蕩 20 min,之后以 12 000 rpm、4℃離心10 min,取上清于新離心管。向殘雜中加入1 mL 80%的冷甲醇,重復上一步,取上清合并,并過SPE C18柱(先分別用甲醇和70%的甲醇各5 mL活化)去雜純化,再用0.22 μm的微孔有機濾膜過濾,然后收集濾液,-20℃保存備用。用過的SPE C18柱可以采用純甲醇和乙醚洗去親酯色素,以便重復利用。
1.4 色譜條件
色譜柱:C18反相色譜柱(5 μm×4.6×250 nm);流動相A為甲醇,C為0.5%乙酸的水溶液;流速為0.9 mL/min;進樣量為20 μL;紫外檢測波長設置為272 nm、236 nm和254 nm以及全掃波段;柱溫為30℃。洗脫梯度見表1。
2 結果與分析
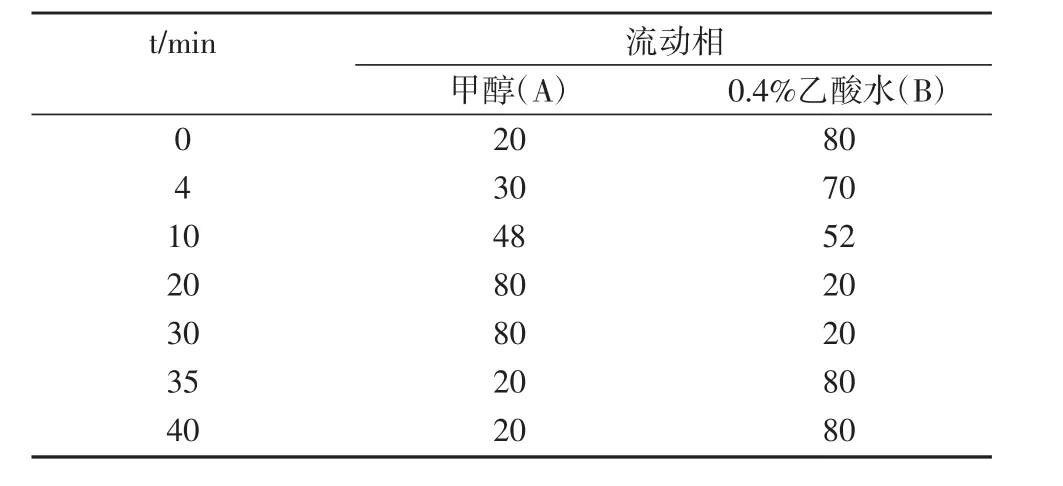
表1 流動相的洗脫梯度比例 (%)
2.1 色譜條件的優化2.1.1 流動相的選擇
分別采用甲醇-水和甲醇-乙酸水作為流動相進行分析測定。結果表明,以甲醇-水為流動相時,色譜峰分離效果不是很好;以甲醇-乙酸水為流動相時5種標品能得到很好的分離,且色譜峰的峰形尖銳、理想。因此,選擇甲醇-乙酸水為流動相。配制了體積分數分別為0.1%、0.2%、0.3%、0.4%和 0.5%的乙酸水溶液。色譜峰分離結果表明,當乙酸水溶液為0.5%時,5種激素可獲得較好的分離效果和色譜峰形。
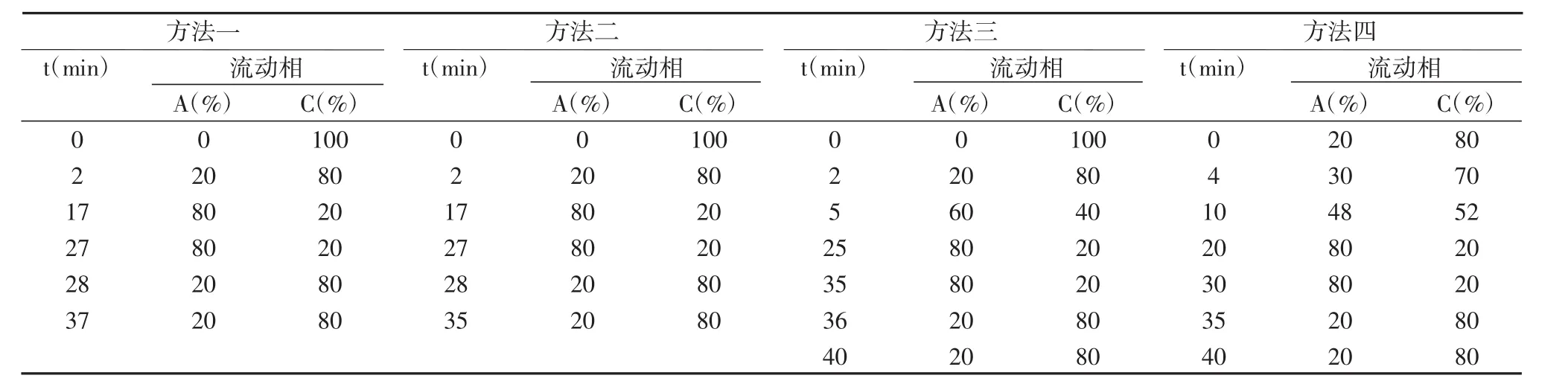
表2 植物內源激素洗脫條件
2.1.2 流動相pH值、配比的選擇
用乙酸分別調節流動相 pH 值為 2.5、3.0、3.5。結果發現,流動相的pH值變化直接影響化合物的分離效果,當流動相pH值為3.0時,各化合物獲得最佳分離效果。因此選擇pH值為3.0的乙酸水溶液。
本實驗考察了流動相甲醇與水的比例對5種標準品激素的洗脫速度和分離度的影響。流動相洗脫時間與比例如表2所示,與方法一、二和三相比,方法四使得5種標準品的分離效果較好。因此,我們選擇方法四。
2.1.3 吸收波長的選擇
我們設置5個波長,分別是236 nm、240 nm、246 nm、254 nm和272 nm,發現水楊酸在236 nm時波形尖銳、理想;玉米素、生長素和脫落酸在波長為272 nm時,峰型效果好;但由于赤霉素含量很低,因此,我們選擇赤霉素的最大吸收波長,為254 nm。而波長為240 nm和246 nm不能滿足峰型尖銳。因此,我們將本試驗的檢測波長設為為236 nm、254 nm和272 nm。5種激素的標準品的色譜圖如圖1所示。
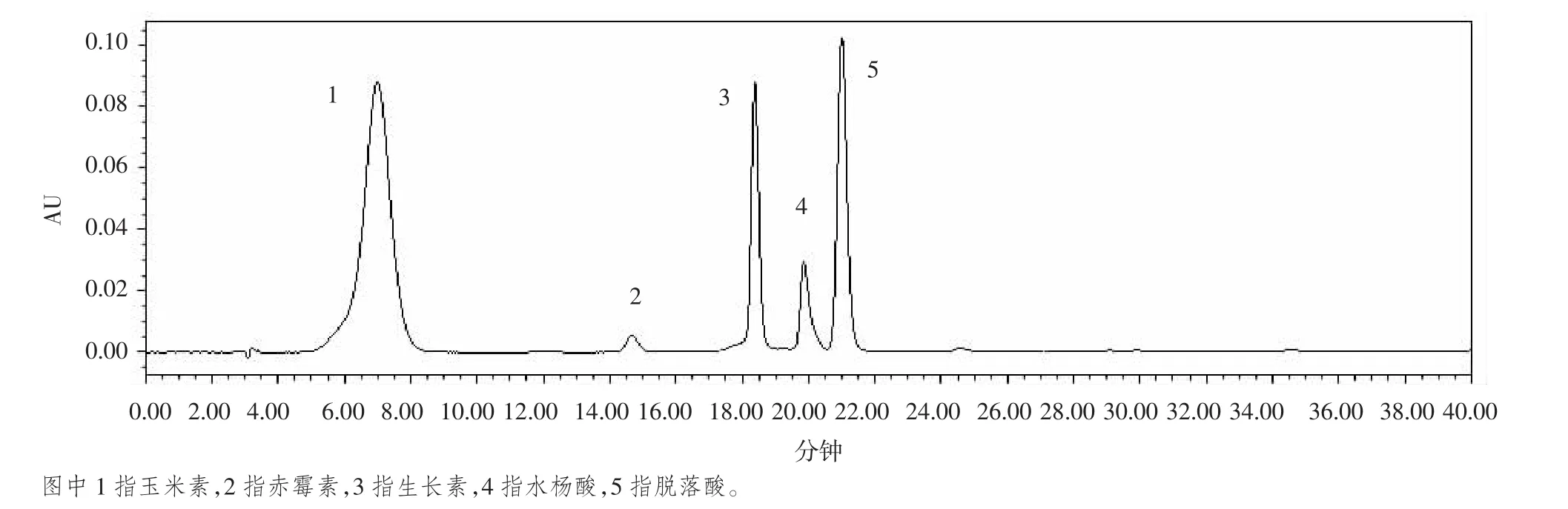
圖1 五種植物內源激素標準品的色譜圖
2.2 標準曲線及其線性范圍
標準品質量濃度范圍在3.125~1 000 mg/kg之間,設置5個梯度,在上述色譜條件下進行檢測,以質量濃度(x)與峰面積(y)進行線性回歸,得出各激素標準品的標準曲線(見表 2),相關系數 R2>0.9996,以 3 倍信噪比(S/N=3)求得5種激素的檢出限,并以線性范圍的下限濃度作為本試驗實測樣品的定量限。結果表明,5種激素標準品在3.125~1 000 mg/kg范圍內線性良好,可滿足定量分析的要求。混合標準品出峰如圖1。
2.3 回收率和精密度試驗
為減少實驗過程的人為污染,確保實驗的準確性,需要對水稻劍葉樣品進行加標回收率的測定。稱取已知含量的樣品3份,精密加入Z、GA、IAA、SA和ABA標準儲備溶液高濃度、中濃度和低濃度3個濃度1 mL,按實驗方法進行操作測定,每個樣做3次平行實驗,根據加入標準品的質量濃度與檢出質量濃度計算回收率和相對標準偏差(RSD),結果見表4。5種激素的回收率在 45.73%~116.70%之間,RSD 范圍為 0.75%~26.72%,回收效果較好,精密度較高。
2.4 水稻劍葉樣品的測定
按1.3樣品提取、純化方法處理樣品,利用建立的方法對高溫、干旱及高溫干旱同時脅迫處理的水稻劍葉內源激素的含量進行測定。結果(表5)顯示,與CK相比,HT、DT和DH處理的水稻劍葉Z、GA和IAA含量都下降,而SA和ABA含量明顯上升。脅迫處理下,Z的含量比 CK 分別低 8.63%、35.08%和 39.27%;GA 的含量比 CK 分別低 40.85%、34.76%和 76.22%;IAA 的含量比 CK 分別低 38.62%、21.26%和 43.78%;SA 的含量比 CK 分別高 16.54%、25.78%和 18.28%;ABA 的含量比 CK 分別高 30.00%、48.75%和 171.25%。DH 處理下,Z、IAA、GA和SA含量基本上低于DT和HT處理,而ABA含量明顯高于DT和HT處理。
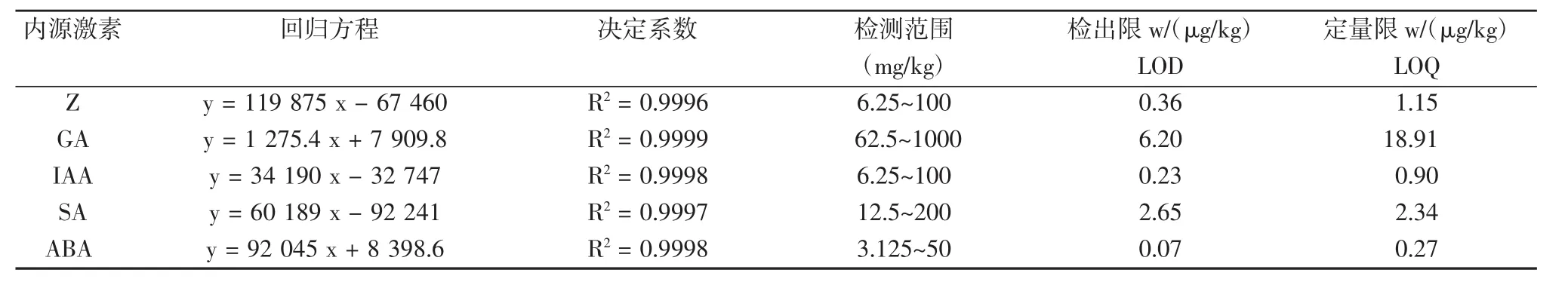
表3 回歸方程、相關系數、檢測范圍、檢出限和定量限
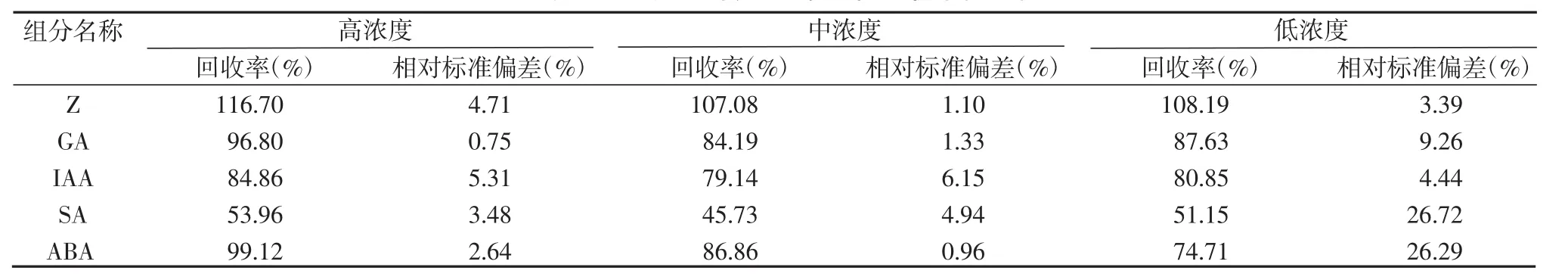
表4 五種植物內源激素加標回收率(n=3)

表5 不同脅迫處理下孕穗期水稻劍葉各內源激素的含量 (μg/g)
3 討論
本文通過高效液相色譜法快速、有效地檢測不同脅迫處理孕穗期水稻劍葉內源激素的含量。峰形尖銳、分離效果理想,加標回收率達 45.73%~116.70%,方法能滿足內源激素定量測定的要求,為進一步檢測水稻生長過程中內源激素的變化與水稻生長、衰老等相關性研究提供了關鍵技術。運用此方法測定高溫、干旱以及高溫干旱同時脅迫孕穗期水稻劍葉內源激素的含量,結果表明,Z、IAA和GA的含量脅迫處理要比正常生長的低,且復合脅迫處理比單獨脅迫的還要低,說明復合脅迫增強了對小穗的傷害。

