miR-146a過表達羊駝黑色素細胞內轉錄組圖譜分析
杜斌,劉學賢,郭湘,薛驥軒,范瑞文
(山西農業大學動物科技學院,山西太谷030801)
哺乳動物毛發的顏色以及纖維直徑和長度,是纖維生產動物經濟價值最重要的影響因素。毛色基因也有助于對農場動物毛色的鑒定[1]。毛發的纖維直徑、長度和顏色由遺傳學和環境決定[2-4]。毛發和皮膚的顏色依賴于上皮基底部黑素細胞產生的黑色素[5]。哺乳動物黑素細胞能產生2種不同類型的黑色素,即真黑素(黑/棕色)和褐黑素(黃/紅棕色),真黑素與褐黑色素的質量和比例決定了毛發和皮膚的最終顏色[6]。在嚙齒類動物中,毛發和皮膚的顏色涉及到很多基因的共同作用。色素沉著是生物體一個非常復雜的生物學過程,目前人們仍舊還在探索miRNA對哺乳動物毛色調控的具體機制。有研究發現,miRNA可以調控黑色素合成過程中的主效基因并影響黑色素的生成。例如,酪氨酸酶相關蛋白1(Tyrosinase related protein 1,TYRP1)是直接影響黑色素合成的催化酶之一,也是miR-146a的靶基因之一,miR-146a通過抑制TYRP1的表達,從而直接影響酪氨酸向黑色素的轉化,造成黑色素合成的產量顯著減少[7]。小眼畸形轉錄因子(Microphthalmia-associated transcription factor,MITF)是黑色素合成關鍵酶酪氨酸酶(Tyrosinase,TYR)、酪氨酸酶相關 蛋白2(Tyrosinase related protein 2,TYRP2)和TYRP1的直接上游基因,在皮膚顏色和黑素瘤中起著重要作用[8],MITF也是黑色素經典路徑MAPK路徑的下游重要調控因子。激活的MAPK可調控一些下游轉錄因子,如cAMP反應元件結合蛋白(cAMPresponsive-elementbindingprotein,CREB),當CREB接收到信號時會調節MITF的轉錄過程[9-10],除了MAPK這個路徑,還有其他影響色素生成的重要途徑如c-kit信號和WNT/β-catenin通路。其中,WNT/βcatenin信號通路在胚胎發育中起重要的作用[11]。有研究表明,WNT/β-catenin信號通路也可影響黑色素瘤的生成[12]。WNT/β-catenin信號通路分泌WNT蛋白質并與其受體Frizzled(FZD)結合組成復合物并相互作用,從而觸發一系列生化反應[13-15]。
為了更好地了解miR-146a在毛發和皮膚顏色中可能的作用,本研究使用高通量測序,挖掘了miR-146a對的羊駝黑色素細胞的調控,旨在揭示許多由miR-146a調控的mRNA轉錄物,并提供對其潛在功能的深入了解。這些數據將有助于更好地了解黑色素沉著這一復雜的分子機制是怎樣形成的。
1 材料和方法
1.1 試驗材料
供試材料為4代羊駝黑色素細胞(山西農業大學羊駝生物工程實驗室提供)。Trizol試劑(Invitrogen,USA)和黑色素培養基(sciencell,美國)。
1.2 方法
1.2.1 轉錄組測序培養羊駝7代黑色素細胞(山西農業大學羊駝生物工程實驗室保存的羊駝黑色素細胞),確保細胞狀態良好無污染。待細胞成功轉染后,使用1×的PBS清洗2~3次后,加入Trizol裂解液并立即置于液氮中。使用Trizol試劑根據制造商的說明書提取樣品中的總RNA。通過凝膠電泳評估RNA的完整性,并通過OD260/OD280與RIN值的比值檢查RNA的純度。選擇RIN值大于7.5并且OD260/OD280值大于1.7的RNA樣品進行深度測序。
1.2.2 cDNA測序文庫的構建及Illumina-Solexa高通量測序從羊駝黑色素細胞總RNA中分離pohy(A)mRNA,將分離的mRNA片段化,隨后使用隨機的第1鏈cDNA合成聚體引物。使用緩沖液、dNTP、RNaseH和DNA聚合酶I合成第2鏈cDNA。使用QiaQuick PCR提取試劑盒純化短cDNA片段。碎片末端被修復,A尾隨后連接測序適配器。在瓊脂糖凝膠電泳后選擇合適的大小片段,并用作PCR擴增的模板。使用Illumina HiSeqTM2000進行文庫的測序。
1.2.3 轉錄組數據分析在裝配之前,通過移除適配器和低質量的讀數來清潔原始讀取。序列裝配使用短讀裝配程序Trinity(http://www.genomics.cn)進行。用一些數據庫(NR、Swiss-Prot、KEGG和COG)進行了Blastx比對,如果不同數據庫的結果彼此沖突,當確定序列方向時,遵循NR>Swiss-Prot>KEGG>COG的優先順序;如果序列與上述數據庫不一致時,則使用ESTScan軟件確定其序列方向。所有序列使用WEGO(http://wego.genomics.org.cn/cgibin/wego/index.pl)進行GO功能分類。
1.2.4 鑒別差異表達基因和途徑分析基于前面描述的方法,嚴格算法用于鑒別試驗組和對照組之間差異表達的基因。使用FDR(假發現率)值0.001和>2的RPKM比值分析,將差異表達基因(DEG)映射到GO數據庫的每個詞條上(http://www.geneontology.org/),計算每個詞條的基因數,并獲得每個GO術語的基因和基因數列表,并在KEGG途徑數據庫(http://www.genome.jp/kegg/path.html)的幫助下,進一步研究了DEG。
2 結果與分析
2.1 原始數據組裝分析
過濾原始數據后,獲得了miR-146a試驗組21 216 335次清潔讀數、53.15% GC百分比和NC對照組27 926 442次清潔讀數、52.82% GC百分比;這些清潔讀數組裝共得到161 666條序列,組裝完整性比較高。分別從試驗組和對照組中產生16 672 337、22 047 775條序列,并且確定序列的平均長度為641.73 nt,其中1 kb以上的序列共有20 019條(圖1)。
2.2 序列的功能分類
檢測羊駝黑色素細胞中序列對蛋白質和核苷酸數據庫的Blast分析(e值<0.000 01)揭示了25 867個已知基因,其中4 848個通過COG分類分析注釋。根據它們推定的功能,將這些基因分成25個類別,12 667個基因也通過GO分類分析加以注釋(圖2),根據其推定的功能(圖3)分為3類(生物過程、細胞成分、分子功能),并列舉出羊駝黑色素細胞中最富集的GO條目(圖4)。
2.3 不同基因在miR-146a組和NC組中的差異表達及所涉及的KEGG路徑
使用先前描述的算法[16-17],鑒定了試驗組和對照組之間差異基因的表達,共有292個已知基因差異表達,其中101個上調,191個下調。對于GO分析,將差異表達基因分別歸入細胞組分、分子功能和生物過程類別。大部分的差異表達基因分為2個GO類別,包括MAPK家族和c-kit、WNT/β-catenin信號通路的基因和4個未知基因(表1)。
為了驗證轉錄組測序結果,隨機選擇了5個基因進行實時PCR,以確定其在試驗組和對照組中的相對表達。實時PCR結果顯示,選擇的5個基因表達量顯著,與轉錄組測序數據一致(圖5)。
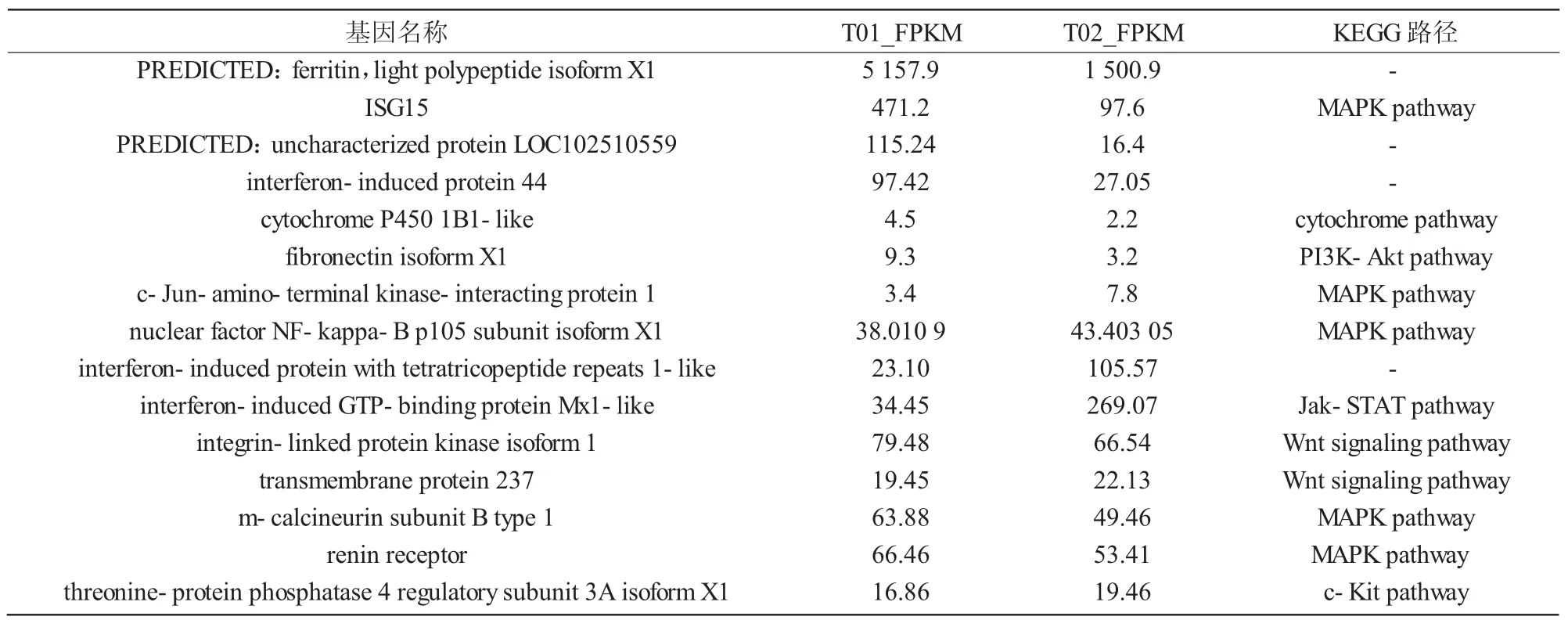
表1 在miR-146a組和NC組中的差異表達基因及所涉及的KEGG路徑
3 結論與討論
哺乳動物的毛發顏色是由黑色素細胞產生的黑色素決定的,黑色素細胞中合成2種初級黑色素(真黑素和褐黑素),這些黑色素的質量以及產生的真黑色素和褐黑色素的比例,決定了頭發和皮膚的最終顏色[18-19]。已有研究報道,傳統的Sanger測序法可以從綿羊和羊駝皮中產生表達序列[20-21]。
為了進一步研究miR-146可能在羊駝黑色素細胞中發揮的重要作用,本研究利用Illumina技術從過表達miR-146的羊駝黑色素細胞中產生了數個轉錄組序列。從這些數據讀取中發現,已知有161 666個序列在羊駝黑色素細胞中表達。這便為之后研究黑色素細胞的調控基因提供了基礎。從表達基因的GO和KEGG通路分析發現,大多數與細胞功能相關。其中,與黑色素形成有關的MAPK信號通路,可以通過調控下游不同轉錄因子,從而調控黑色素的合成[22]。有報道發現,被激活的MAPK可以帶著信號去選擇性地激活下游基因[23-24]。黑素細胞發育過程中,影響黑素瘤形成的基因可能對黑色素細胞增殖和遷移有著重要的調控[25]。WNT/βcatenin通路常常被一些癌癥因子激活,然而,其調控下游基因的方式是不同的[14]。這些差異可能是與黑色素細胞和上皮細胞的生物學以及β-catenin活化的多樣性有關。黑色素瘤中WNT/β-catenin信號通路的激活可能與WNT信號級聯成分或參與其調控的蛋白質的基因表達改變有關[26]。不依賴βcatenin的WNT信號傳導途徑是通過將WNT與FZD結合而啟動的,然后激活各種下游效應子[14]。本研究對差異表達基因的GO通路分析也發現,許多基因要么是細胞的一部分,要么參與了細胞功能。本研究特別關注與色素沉著和黑色素生成相關的途徑。黑色素生成是一個復雜的生化級聯反應,盡管黑素細胞的數量通常保持不變,但較深的皮膚色素沉著很可能會影響毛色,這便與更多黑素體的存在有關[27]。影響黑色素生成的因素很多,還有待進一步探索。
本研究結果揭示了miR-146a在羊駝黑色素細胞中的生理功能,這將有助于了解miRNA在動物毛發和皮膚顏色發育中的影響。

