白細胞介素-6抑制劑對銀屑病模型大鼠背部皮膚組織的影響及作用機制
魏榮 吳斌 呂靜
(三峽大學附屬仁和醫院皮膚科,湖北 宜昌 443001)
銀屑病是由T淋巴細胞介導的、免疫反應異常所引起的慢性炎癥性皮膚病,其主要臨床癥狀表現為鱗屑性紅斑〔1〕。目前臨床上銀屑病的流行病學調查顯示,受多種基因的連鎖影響,銀屑病發生后較易引起代謝綜合征、心血管疾病、糖尿病、高血壓等多系統疾病,且認為上述并發癥的嚴重程度與銀屑病的嚴重程度有關〔2〕。有研究表明〔3〕,銀屑病患者機體T淋巴細胞、免疫反應異常與白細胞介素(IL)-6的異常表達有關,IL-6在銀屑病患者血清中為高表達,IL-6可對中性粒細胞、T淋巴細胞、嗜酸性粒細胞等具有較強的趨化作用,最終導致血管周圍發生炎性細胞浸潤。由于銀屑病較為頑固難治、較易復發,臨床上常規治療此病的效果并不理想,目前已經成為世界范圍內重大疑難病之一,嚴重影響著患者的正常生活〔4〕。本研究旨在觀察IL-6抑制劑對銀屑病模型大鼠背部皮膚組織的影響及作用機制。
1 材料與方法
1.1材料 研究動物:選擇SD健康大鼠30只(SPF級),由基爾頓生物科技(上海)有限公司提供。鼠齡3~6個月,平均(3.8±1.5)個月;體重200~250 g,平均(220±7.9)g;飼養溫度為22~25℃,室內濕度35%~40%,飼養室定時進行紫外線照射消毒。統一給予標準飼料,允許它們自由活動,飼養時間為1 w。本研究所做實驗均獲得醫院倫理委員會批準。
主要試劑:IL-6抑制劑(北京白奧萊博科技有限公司,貨號M07110);Trizol(美國Invitrogen公司);RNA提取試劑盒、反轉錄cDNA合成試劑盒、PCR擴增試劑盒(均購于天根生化科技(北京)有限公司,貨號:DP422、KR103、KT109)。
1.2分組及建模 將30只大鼠隨機分為空白對照組、銀屑病組和IL-6抑制劑組各10只,參照高揚等〔5〕研究實驗中銀屑病模型建立方法建立銀屑病大鼠模型,將所有大鼠背部中央2 cm×4 cm的毛發區處的毛發全部剃除,之后按照0.05 g/cm2的標準將藥膏均勻涂抹至剃除的毛發區,空白對照組大鼠剃除的毛發區均勻涂抹凡士林乳膏,銀屑病、IL-6抑制劑組大鼠剃除的毛發區均勻涂抹咪喹莫特乳膏,每日1次,共涂抹14 d。若在建模過程中大鼠背部中央毛發區再次長出毛發,重復進行脫毛處理。
1.3給藥 建模成功后,IL-6抑制劑組大鼠腹腔注射5 mg/kg IL-6抑制劑,空白對照組、銀屑病組腹腔注射等劑量的生理鹽水,4 w注射1次,共注射3次,在對大鼠最后一次給藥后2 d觀察大鼠變化。
1.4背部皮膚組織樣本采集 給藥結束后,采用斷頭法處死3組大鼠,取大鼠背部皮膚組織分為兩份,其中1份在10%的甲醛溶液中進行固定,制備石蠟切片,測定大鼠背部皮損表皮厚度、Baker病理評分、炎性細胞計數及蘇木素-伊紅(HE)染色觀察病理組織學病變情況。另一份液氮冷凍保存,作后續指標檢測。
1.5HE染色及背部皮損表皮厚度檢測 將所制備的大鼠背部皮損組織在10%甲醛溶液中進行固定,脫水透明,浸蠟包埋,脫蠟、HE染色,之后脫水、透明,待封片晾干后再顯微鏡下觀察大鼠背部皮損組織病理學表現。采用IPP6.0軟件測量表皮厚度。
1.6Baker病理評分、炎性細胞計數 ①Baker病理評分標準。角質層:2分:出現小膿瘍;1分:角化不完全;0.5分:過度角化計。表層:1分:表層中見有顆粒細胞層消失;1分:棘層肥厚。真皮層:5分:毛細血管擴張;出現單一多核細胞浸潤,根據嚴重程度分為重度、中度、輕度,分別計為2分、1分、0.5分。②炎性細胞計數。Baker病理評分完成后,使用光學顯微鏡對大鼠背部皮膚組織進行攝片,采用Imagepro-plus6.0圖像分析系統對所選視野中的炎性細胞進行計數。
1.7背部皮膚組織中IL-17、IL-22、IL-23表達水平檢測 取液氮冷凍保存的大鼠背部皮膚組織,使用酶聯免疫吸附試驗檢測,將采集到的標本,取包被液〔pH9.5 0.05 mol/L磷酸鹽緩沖液(CB)〕適當稀釋的抗IL-17、IL-22、IL-23 0.1 ml,添加至聚苯乙烯反應板孔中,加蓋后溫度4℃ 24 h,次日使用洗滌劑洗滌3次后,甩干。在各孔中加入稀釋液(pH7.4 0.02 mol/L Tris-HCl緩沖液)稀釋的待測標本0.1 ml,同時加入陽性和陰性的對照標本,在43℃置60 min,將液體移除洗滌3次后,甩干。在各孔中加入IL-17、IL-22、IL-23的酶標抗體0.1 ml,43℃置60 min。液體移去后洗滌3次,甩干。在各個空中加入底物液(0.1 mol/L Na2HPO4(Na2HPO4·12H2O 35.8 g/L)5.14 ml,0.05 mol/L枸櫞酸(10.5 g/L)4.86 ml混勻,加入鄰苯二胺(OPD)4 mg,置棕色小瓶中,臨用時加30% H2O24.0 μl,混勻0.1 ml,黑暗環境下放置20 min,在各孔中加入2 mol/L H2SO40.05 ml,終止反應。在酶標儀上讀取A405吸收值。分析IL-17、IL-22、IL-23水平。
1.8背部皮膚組織中IL-6受體/Janus激酶/信號轉導和轉錄激活因子(IL-6R/JAK/STAT3)通路因子mRNA表達量檢測 取液氮冷凍保存的大鼠背部皮膚組織,加入1 ml Trizol研磨為粉末狀,按照制備試劑盒說明書提取大鼠背部皮膚組織中總RNA,之后對RNA純度、含量進行檢測,使用Takara逆轉錄試劑盒行逆轉錄處理后獲得cDNA,之后使用Primer5.0軟件對引物序列進行設計,使用RT-PCR方法檢測大鼠背部皮膚組織中IL-6R/JAK/STAT3通路因子mRNA表達量,采用2-△△Ct方法計算出需要檢測的IL-6R、JAK1、STAT3、CD80、CCL5 mRNA表達量。IL-6R引物序列:上游:5′-CATGTGCGTCGCCAGTAGT-3′,下游:5′-AGCTCAAACCGTAGTCTGTAGA-3′;JAK1引物序列:上游:5′-AGTGCCCTGAGCTACTTGGA-3′,下游:5′-AGGTCAGCCAGCTCCT-3′;STAT3引物序列:上游:5′-ATCACGCCTTCTACAGACTGC-3′,下游:5′-CATCCTGGAGATTCTCTACCACT-3′;CD80引物序列:上游:5′-AAACTCGCATCTACTGGCAAA-3′,下游:5′-GGTTCTTGTACTCGGGCCATA-3′;CCL5引物序列:上游:5′-GCAAGGAGACCACCAACAG-3′,下游:5′-CCCTCACTTCCAACCCAAATC-3′;β-actin引物序列:上游:5′-TGACGTGGACATCCGCAAAG-3′,下游:5′-CTGGAAGGTGGACAGCGAGG-3′。
1.9統計學處理 采用SPSS19.0軟件進行方差分析、t檢驗。
2 結 果
2.13組大鼠一般情況觀察 空白對照組大鼠背部備皮區皮膚始終為淡紅色的光滑皮膚,無鱗屑、紅斑、糜爛癥狀出現。銀屑病組大鼠背部皮區皮膚在建模后的第2天開始出現厚層銀白色鱗屑和浸潤性紅斑癥狀,少量的大鼠出現出血點,且隨著時間的推移,鱗屑、紅斑癥狀逐漸加重。IL-6抑制劑組大鼠背部皮區皮膚鱗屑、紅斑癥狀逐漸減輕、消退,逐漸恢復至正常。見圖1。

圖1 3組大鼠背部皮膚變化
2.23組大鼠病理組織學觀察 空白對照組大鼠角質層較薄,顆粒層為2~4層,棘層大為2~3層。銀屑病組大鼠顆粒層較為肥厚、顆粒層減少、存在少量的中性白細胞聚集、皮突下延呈杵狀、真皮乳頭上延,存在組織細胞、淋巴細胞浸潤,真皮淺層毛細血管擴張、充血。IL-6抑制劑組大鼠表皮變薄,角化過度、角化不全基本消失,顆粒層增多,組織細胞、淋巴細胞浸潤、真皮淺層毛細血管擴張、充血等癥狀表現顯著減輕,基本恢復正常。見圖2。

圖2 3組大鼠病理組織學HE染色觀察圖(×100)
2.33組大鼠Baker評分、炎癥細胞浸潤數、表皮厚度比較 銀屑病組、IL-6抑制劑組大鼠Baker評分、炎癥細胞浸潤數、表皮厚度均明顯高于空白對照組(P<0.05);IL-6抑制劑組大鼠Baker評分、炎癥細胞浸潤數、表皮厚度均明顯低于銀屑病組(P<0.05)。見表1。
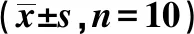
表1 3組大鼠Baker評分、炎癥細胞浸潤數、表皮厚度比較
與空白對照組比較:1)P<0.05;與銀屑病組比較:2)P<0.05,下表同
2.43組大鼠背部皮膚組織中IL-17、IL-22、IL-23表達水平比較 銀屑病組、IL-6抑制劑組大鼠背部皮膚組織中IL-17、IL-22、IL-23表達水平均明顯高于空白對照組(P<0.05);IL-6抑制劑組大鼠背部皮膚組織中IL-17、IL-22、IL-23表達水平均明顯低于銀屑病組(P<0.05)。見表2。

表2 3組大鼠背部皮膚組織中IL-17、IL-22、IL-23表達水平比較
2.53組大鼠背部皮膚組織中IL-6R/JAK/STAT3通路因子mRNA水平比較 銀屑病組、IL-6抑制劑組大鼠背部皮膚組織中IL-6R、JAK1、STAT3、CD80、CCL5 mRNA表達量均明顯高于空白對照組(P<0.05);IL-6抑制劑組大鼠背部皮膚組織中IL-6R、JAK1、STAT3、CD80、CCL5mRNA表達量均明顯低于銀屑病組(P<0.05)。見表3。
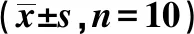
表3 3組大鼠背部皮膚組織中IL-6R/JAK/STAT3通路因子mRNA表達量比較
3 討 論
銀屑病的病理機制尚不完全明確,但就目前研究來看銀屑病與病灶內異常浸潤的T淋巴細胞及其所產生的炎癥因子有關,當T淋巴細胞表面受體與炎癥因子結合后會引起受體活化,之后沿著其特定的信號轉導通路經過細胞質移動至細胞核中,對目的基因的轉錄產生啟動作用,最終發揮其相應的生物學功能〔6,7〕。活化的信號轉導通路在銀屑病炎癥、免疫應答過程中有著關鍵的調節作用〔8〕。目前有研究認為MAPK、NF-κB、Notch、IL-6R/JAK/STATs、Wnt等信號轉導通路參與銀屑病的發生和發展〔8,9〕。而IL-6在銀屑病發生后出現高表達,其生物學功能主要是通過與IL-6R相結合后形成異源二聚體,之后再在gp130上結合,形成具有高親和力的復合物IL-6/IL-6R/gp130,最終作用于IL-6R/JAK/STAT信號轉導通路,啟動或者加重銀屑病〔10〕。
IL-6發揮作用途徑是與IL-6R相結合后對JAK/STAT信號轉導通路進行激活,對其特定基因的表達產生影響,因此認為IL-6是否會產生其特性的生物學效應與IL-6R表達水平的高低有關〔11〕。IL-6R/JAK/STAT3屬于一種由細胞膜轉移至細胞核的信號轉導通路,當JAK/STAT通路被激活后其通路因子STAT3會對細胞的增殖產生影響〔12〕。STAT3的活化主要是通過STAT3分子酪氨酸殘基發生磷酸化后所實現的,當發生磷酸化的STAT3形成二聚體后會進入至細胞核中了,之后通過其信號識別作用與其下游靶基因的啟動子進行特異性的結合,最終對相關基因的表達進行調節〔13〕。IL-6R/JAK/STAT3的下游靶基因包括CD80、CCL5。其中CD80屬于一種活化T淋巴細胞所必需的共刺激因子,當兩者協同作用刺激信號較強時,會對自身反應性的T淋巴細胞產生激活作用,進而引起自身免疫反應、機體損傷等,導致繼發性的角質細胞產生過度增生作用〔14〕。有研究表明〔15〕,T淋巴細胞在遷移至銀屑病皮損處前已經被激活,而銀屑病患者淋巴細胞中CD80為高表達,與患者疾病的發生呈正相關。
CCL5為IL-6R/JAK/STAT3的另一種下游靶基因,屬于CC類亞族趨化因子家族中的主要成員,在人體組織中廣泛存在,可調節正常活化的T細胞的表達和分泌蛋白;CCL5一方面可對淋巴細胞遷移、歸巢產生介導作用,另一方面可引發白細胞的遷移,具有較強的誘導能力,誘導白細胞向炎癥部位浸潤〔16〕。CCL5不僅對多種細胞產生趨化作用,還可對淋巴細胞產生激活作用,調節細胞生長、分化和參與炎癥反應〔17〕。在銀屑病發生后角質形成細胞來源的CCL5高于正常皮膚,CCL5表達增強,其原因可能與銀屑病病灶皮損處聚集大量的活化T細胞有關〔18〕。本研究結果提示,IL-6抑制劑可能是通過作用于IL-6R/JAK/STAT3信號通路,調控其通路因子,進而影響銀屑病病灶內異常浸潤的T淋巴細胞及其所產生的炎癥因子,最終起到改善皮損病癥的目的,但目前臨床上對于IL-6抑制劑與銀屑病之間的作用關系并無研究,因此本研究結果還需后續研究實驗進一步證實。
而IL-6R/JAK/STAT3信號通路的激活可誘導T-bet的表達、促進Th1細胞因子的釋放,但同時會抑制Th17細胞因子的分泌,研究認為IL-6R/JAK/STAT3信號通路的激活與Th1、Th17細胞共同參與銀屑病的發生〔19〕。而目前研究認為〔20〕,由Th17細胞所分泌的IL-17、IL-22、IL-23因子水平會誘導角質增生和病灶處炎癥反應。本文結果說明,IL-6抑制劑可能是通過作用于IL-6R/JAK/STAT3信號通路,抑制Th17細胞炎癥因子的分泌,最終抑制角質增生和病灶處炎癥反應。
綜上,IL-6抑制劑可有效抑制銀屑病大鼠背部皮膚組織角質增殖、炎癥反應,其作用機制可能與調控IL-6R/JAK/STAT3通路轉導因子有關。

