eGFR>90 ml/(min·1.73 m2)中老年2型糖尿病患者血清鳶尾素水平及其與尿酸、尿微量白蛋白/肌酐的關系
陳嬌月 劉敏 山秀杰 劉曉燕 高宇 金鳳表 韓桂艷
(承德醫學院附屬醫院 1內分泌科,河北 承德 067000;2檢驗科)
2型糖尿病(T2DM)是全球快速增長的一個健康問題,糖尿病腎病(DN)是T2DM常見的微血管并發癥,是導致慢性腎衰竭的重要原因。臨床和流行病學研究證實尿酸(UA)參與多種代謝紊亂,并在胰島素抵抗、脂代謝紊亂、高血壓及代謝綜合征的發生及發展中起到至關重要的作用〔1,2〕。鳶尾素(Irisin)是一種新發現的肌因子,其生理作用主要是促進白色脂肪的“棕色化效應”,參與并維持體內糖脂代謝的平衡〔3〕,在糖調節受損和新發T2DM 患者中發現Irisin濃度與脂質和UA代謝顯著相關〔4〕。在腎功能不全的T2DM患者循環中Irisin水平下降,且與估算腎小球濾過率(eGFR)正相關〔5〕。本研究探討eGFR>90 ml/(min·1.73 m2)的T2DM患者血清Irisin、UA水平及其與早期腎病發生的關系。
1 資料與方法
1.1臨床資料 選取2016年11月至2017年11月于承德醫學院附屬醫院內分泌科診治的122例eGFR>90 ml/(min·1.73 m2)的T2DM患者,平均年齡62.9歲,按照尿微量白蛋白/肌酐(ACR)分為:正常蛋白尿組 40 例(ACR<30 μg/mg,DM組),男23例、女17例;微量蛋白尿組44例(ACR 30~299 μg/mg,EDN組),男23例、女21例;臨床蛋白尿組38例(ACR>299 μg/mg,CDN組),男20例、女18例。另選同期體檢正常的健康人40例作為對照組(NC組),男女各20例。所有受檢者無糖尿病急性代謝并發癥,無急性心腦血管疾病、感染、手術等應激狀態,無肝腎功能不全、心力衰竭、腫瘤、原發性腎臟病及其他繼發性腎臟疾病(如狼瘡相關性腎炎、乙肝相關性腎炎、紫癜相關性腎炎等),且近3個月未服用腎毒性、激素類、血管緊張素轉化酶抑制劑、血管緊張素Ⅱ受體拮抗劑、調脂及降UA類藥物。所有入選對象已簽署知情同意書。
1.2觀察指標與方法
1.2.1一般資料 測定所有受檢者的身高、體重、腰圍、血壓,計算體重指數(BMI)。
1.2.2生化指標 受檢者均禁食水>8 h,于次日清晨抽取肘靜脈血5 ml,日立全自動生化儀酶法檢測總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、血尿素氮(BUN)、血肌酐(Scr)、空腹血糖(FPG),采用離子交換高能液體色譜法測定糖化血紅蛋白(HbA1c)(日立TOSOH 公司的 HLC-723G7 全自動糖化血紅蛋白儀),采用電化學發光法測定空腹C肽(F-CP)、用酶聯免疫吸附試驗(ELISA)測定血清Irisin濃度(ELISA試劑盒購自武漢優爾生貿易有限公司,批內變異系數及批間變異系數均小于10%),并留取晨起第一次尿液采用免疫比濁法測定ACR(使用貝克曼 AU5800 全自動生化分析儀)。采用HOMA改良公式計算胰島素抵抗指數,根據CKD-EPI公式計算eGFR。
1.3統計學方法 應用SPSS19.0統計軟件進行χ2檢驗、單因素方差分析,兩兩比較采用SNK檢驗。采用Spearman相關分析及多元線性回歸分析影響血清Irisin的相關因素。
2 結 果
2.1各組一般資料比較 各組性別構成比較差異無統計學意義(χ2=0.481,P>0.05),4組年齡、身高、體重、BMI、收縮壓(SBP)、舒張壓(DBP)、FPG、TC、LDL-C、HDL-C、BUN、Scr、HbA1c、F-CP、eGFR組間兩兩比較,差異未見統計學意義(P>0.05)。各組間Irisin水平隨ACR升高依次降低(F=50.627,P<0.01);腰圍隨ACR升高依次升高(F=36.788,P<0.05);UA水平隨ACR升高依次升高(F=14.156,P<0.05);HOMA-C肽水平隨ACR升高依次升高(F=38.846,P<0.01)。見表1。
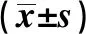
表1 各組一般資料比較
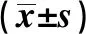
續表1 各組一般資料比較
2.2相關性分析 Irisin與各指標的相關性分析顯示,eGFR>90 ml/(min·1.73 m2)的T2DM患者Irisin水平與腰圍、FPG、HbA1c、TG、HOMA-C肽、ACR、UA均呈負相關(P<0.01或P<0.05),與其他指標無明顯相關性,見表2。

表2 Irisin與各指標的相關性
2.3Irisin影響因素的多元線性回歸分析 UA、ACR為影響Irisin的獨立相關因素(β=-0.599,P<0.01;β=-0.379,P<0.05),見表3。

表3 Irisin影響因素的多元線性回歸分析(R2:0.782,F:23.887)
3 討 論
DN是T2DM常見的微血管并發癥,其特征是早期僅尿中白蛋白排泄輕度增加,出現微量白蛋白尿,因腎臟代償功能強大,無明顯癥狀,隨著病情逐步進展至大量蛋白尿和Scr水平升高,出現臨床癥狀,但腎損害已不可逆,最終發生腎衰竭,需透析或腎移植治療,增加治療花費及死亡率。因此在早期干預極為重要。
骨骼肌作為調節糖脂代謝穩態的重要內分泌器官,通過分泌、釋放一些細胞因子及肽類物質,在機體發揮內分泌、旁分泌和自分泌作用〔6〕。Irisin可由骨骼肌釋放,尤其在運動之后,是連接肌肉及脂肪的重要信使,它在運動誘導下由肌肉組織表達分泌,主要作用于外周脂肪等組織,具有改善糖脂代謝的功能〔3〕。研究證實,在T2DM患者中,循環的Irisin濃度明顯降低〔7〕,伴有肥胖及胰島素抵抗者,骨骼肌 FNDC5 基因水平亦明顯降低〔8〕。本研究顯示Irisin的水平與FPG、HbA1c、HOMA-C肽負相關,這與Hu等〔9〕研究結果一致。無糖尿病的慢性腎臟病患者血漿Irisin水平顯著降低,其降低程度與BUN和Scr水平呈顯著負相關〔10〕。血清Irisin水平隨eGFR下降而降低,提示Irisin不通過腎臟清除,其參與慢性腎臟病發生與發展的具體機制不詳〔11〕。本研究結果顯示在eGFR>90 ml/(min·1.73 m2)的DN患者Irisin水平與BUN和Scr水平無關,而與ACR負相關,隨尿蛋白增加,血清Irisin下降明顯。Liu等〔5〕的研究顯示在eGFR下降的DN患者中Irisin的水平與BMI正相關,本研究顯示在eGFR>90 ml/(min·1.73 m2)的DN患者Irisin水平與BMI無關,而與腰圍、TG負相關,提示糖尿病患者長期的糖代謝紊亂、胰島素抵抗引起脂肪/肌肉比例增加及脂代謝異常可能通過降低Irisin水平參與早期DN的發生。
UA由嘌呤代謝產生,主要由肝臟、脂肪組織和肌肉組織生成,其水平受生成量和腎臟與腸道的再吸收影響。臨床和流行病學研究均已證實UA在胰島素抵抗、脂代謝紊亂、高血壓及代謝綜合征的發生與發展中起到至關重要的作用〔2,12〕。動物實驗研究發現即使沒有形成UA鹽結晶,單純UA水平升高也能導致腎損害〔13〕。與 C57 小鼠相比,ob/ob 小鼠的骨骼肌擁有更高的黃嘌呤氧化還原酶活性,而大鼠高脂飲食也可以誘導骨骼肌黃嘌呤氧化還原酶活性的增加〔14,15〕,提示UA與肌肉因子之間存在聯系。人暴露于高海拔環境所引起的氧化應激會增加血清尿酸鹽水平〔16〕,本研究顯示隨UA增加,血清Irisin下降,與相關糖尿病的隊列研究結果,正常范圍內較高的UA水平也導致DN的風險增加一致〔17,18〕。
本研究結果顯示血清Irisin可能通過血UA升高增加尿微量白蛋白參與早期DN的發生。UA可以激活 NADPH 氧化酶,刺激活性氧簇(ROS)產生增加,降低一氧化氮(NO)的生物利用度〔15〕。而氧化應激,可以激活血管緊張素Ⅱ誘導的心肌纖維化前的TGFβ1-Smad2/3信號傳遞〔19〕,也能誘導自噬發生。Irisin通過激活磷酸腺苷活化蛋白激酶/UM-51樣激酶(ANPK-ULK)1信號通路,誘導保護性自噬和自噬通量〔20〕,抑制血管緊張素Ⅱ誘導的成纖維反應。因此,積極降低血UA、提高Irisin水平,可能通過抗氧化、抗纖維化及誘導保護性自噬等作用,延緩DN的發生、發展,其臨床作用還有待大規模的研究進一步證實。

