燈盞花素通過調節Bcl-2和Bax表達拮抗高糖誘導的RPE細胞損傷
劉海峰,趙永厚,高 源
0引言
糖尿病的發生是在遺傳的基礎上,糖尿病患者體內長期高血糖狀態導致多元醇代謝通路異常,蛋白激酶C激活,糖基化血紅蛋白和多元醇代謝產物因機體代謝障礙而逐漸堆積,氧化應激增強、細胞因子失衡等多因素共同參與、互相作用,破壞了視網膜生理屏障并啟動了氧化應激損傷[1-2]。燈盞花素(scutellarin)主要活性成分是燈盞乙素,具有抑制炎癥反應、減輕組織水腫、改善微循環、抗氧化、擴張血管的作用[3]。本研究通過構建高糖條件下視網膜色素上皮(retinal pigment epithelial,RPE)細胞氧化損傷模型,探討燈盞花素對RPE細胞的保護作用和機制。
1材料和方法
1.1材料燈盞花素(美國Sigma公司,純度>99%),人RPE細胞(美國ATCC公司),DMEM/F12(1∶1)培養基(武漢博士德生物工程有限公司),CCK-8試劑盒(北京索萊寶科技有限公司), H2DCFDA熒光探針(江蘇凱基生物公司),Hoechst 33258染色試劑盒(北京百奧萊博公司),Bcl-2和Bax抗體(上海碧云天生物技術有限公司)。
1.2方法
1.2.1 RPE細胞的培養選取加入青-鏈霉素和10%胎牛血清的DMEM/F12作為培養基,37℃、飽和濕度、5% CO2培養箱中進行RPE細胞培養(本實驗中的RPE細胞為傳代第6代)。
1.2.2 RPE細胞分組依據燈盞花素濃度不同,分為四組:對照組RPE細胞以正常培養液(葡萄糖濃度為5.5mmol/L)孵育36h;高糖組RPE細胞培養液內葡萄糖濃度為30mmol/L,細胞孵育時間為12h[4];燈盞花素低濃度組先以1μmol/L燈盞花素孵育細胞24h,PBS沖洗細胞3次,以換液方式在葡萄糖濃度為30mmol/L的培養液繼續孵育12h;燈盞花素高濃度組先以10μmol/L燈盞花素孵育細胞24h,PBS沖洗細胞3次,以換液方式在葡萄糖濃度為30mmol/L的培養液繼續孵育12h。
1.2.3細胞劃痕實驗觀察RPE細胞的遷移性以1×105/mL的密度將RPE細胞接種到6孔板,按上述方法處理細胞并分組,待細胞貼壁融合后24h,用2μL加樣槍頭比著直尺在培養板中間垂直劃痕,PBS沖洗劃下的細胞,加入無血清的DMEM/F12繼續培養,在48h時間點進行取樣、拍照記錄。實驗重復3次。
1.2.4 CCK-8法測定細胞增殖RPE細胞培養于96孔板內,每孔200μL,細胞密度為1×105個/mL,按實驗分組處理,棄去原有培養液,將已配制含10% CCK-8的培養基以換液的形式加入,接種后的96孔板37℃培養箱中繼續培養4h,用480nm吸光度進行檢測。
1.2.5流式細胞技術檢測RPE細胞內活性氧表達用不含EDTA的胰酶消化RPE細胞后制備細胞懸液,1 000r/min離心5min并收集細胞,預冷的PBS洗滌細胞3次,收集細胞并用100μL緩沖液重懸細胞,加入5μL Annexin-V和10μL PI,輕輕混勻,避光反應10min后再次加入100μL緩沖液,1h內用流式細胞儀檢測細胞凋亡率。
1.2.6細胞凋亡的形態學觀察細胞經相應處理后用PBS洗滌細胞2次,4%多聚甲醛固定細胞10min后PBS充分沖洗固定液,加入2μL Hoechst 33258染色液,避光反應10min后PBS充分沖洗,倒置熒光顯微鏡下觀察并拍照。
1.2.7 Western Blot檢測Bcl-2和Bax蛋白表達水平收集細胞并提取總蛋白,10 000r/min離心10min后取上清,行10% SDS-聚丙烯酰胺凝膠電泳,轉膜后5%脫脂奶粉4℃封閉2h,加羊抗兔多克隆一抗(稀釋濃度1∶1 000 )過夜,室溫下孵育鼠抗羊二抗(稀釋濃度1∶2 000)1h,ECL化學發光法自顯影并采集圖像,觀察Bcl-2和Bax的Western Blot條帶變化。
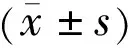
2結果
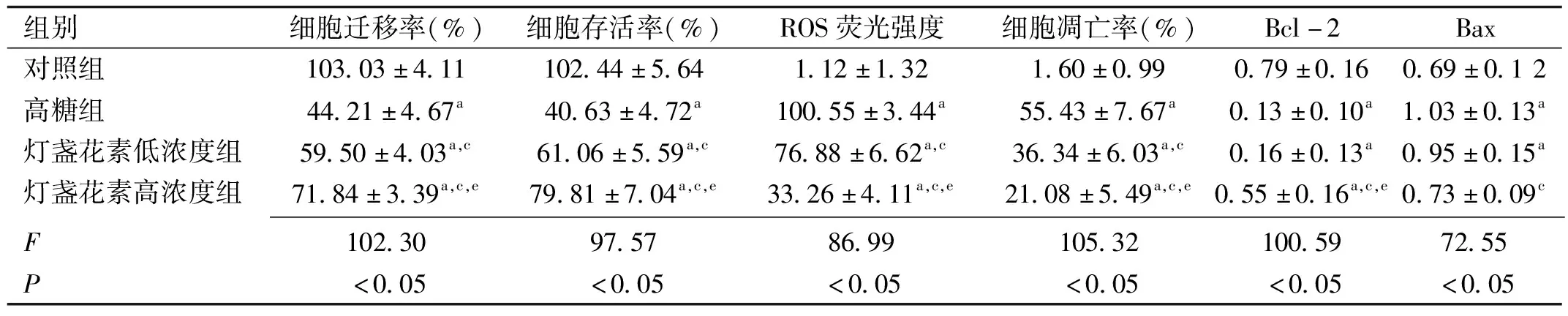
2.1細胞劃痕實驗檢測高糖下RPE細胞的遷移性四組RPE細胞遷移率比較,差異有統計學意義(P<0.05,表1)。拍照記錄可見,對照組RPE細胞形態規則,48h后劃痕仍清晰可見;高糖組培養的RPE細胞劃痕在48h時基本消失,且細胞狀態不佳,死亡和變形細胞增加,高糖組RPE細胞遷移率與對照組比較,差異有統計學意義(P<0.05);燈盞花素低濃度組和燈盞花素高濃度組RPE細胞形態較高糖組改善(圖1),細胞遷移率較高糖組增加,與高糖組比較差異均有統計學意義(P<0.05),其中燈盞花素高濃度組RPE細胞遷移率與燈盞花素低濃度組RPE細胞遷移率比較,差異有統計學意義(P<0.05)。
2.2燈盞花素對RPE細胞活力的影響四組RPE細胞存活率比較,差異有統計學意義(P<0.05,表1)。對照組RPE細胞存活率與高糖組比較,差異有統計學意義(P<0.05)。1、10μmol/L燈盞花素孵育RPE細胞后,細胞存活率分別提高到61.06%±5.59%和79.81%±7.04%,與高糖組比較差異有統計學意義(P<0.05);燈盞花素高濃度組RPE細胞存活率與燈盞花素低濃度組比較,差異有統計學意義(P<0.05)。
2.3 RPE細胞內ROS的變化以細胞數為縱坐標,相對熒光強度為橫坐標,可測定活細胞ROS的相對表達量。檢測結果顯示,四組RPE細胞內ROS變化比較,差異有統計學意義(P<0.05,表1)。對照組ROS主峰位于基線左側,細胞內ROS表達較低;高糖組ROS主峰向基線右側移位,細胞內ROS表達增加;1、10μmol/L燈盞花素干預后,RPE細胞內ROS主峰逐漸向基線左側移位,細胞內ROS表達逐漸降低(圖2);燈盞花素高濃度組RPE細胞內ROS相對表達量與燈盞花素低濃度組比較,差異有統計學意義(P<0.05)。
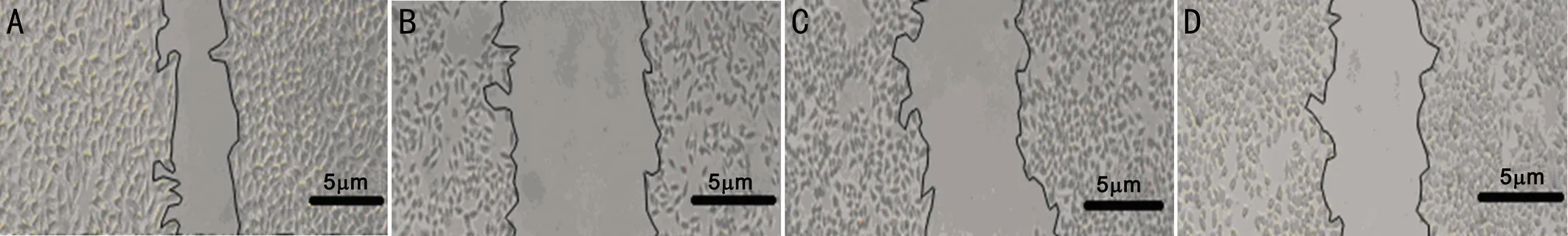
圖1RPE細胞劃痕實驗(×200)A:對照組;B:高糖組;C:燈盞花素低濃度組;D:燈盞花素高濃度組。
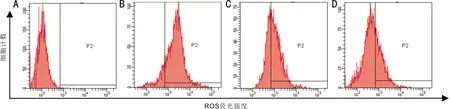
圖2流式細胞技術檢測RPE細胞內ROS改變A:對照組;B:高糖組;C:燈盞花素低濃度組;D:燈盞花素高濃度組。
圖3燈盞花素對高糖誘導RPE細胞凋亡的影響(箭頭示凋亡細胞)(×200)A:對照組;B:高糖組;C:燈盞花素低濃度組;D:燈盞花素高濃度組。
組別細胞遷移率(%)細胞存活率(%)ROS熒光強度細胞凋亡率(%)Bcl-2Bax對照組103.03±4.11102.44±5.641.12±1.321.60±0.990.79±0.160.69±0.12高糖組44.21±4.67a40.63±4.72a100.55±3.44a55.43±7.67a0.13±0.10a1.03±0.13a燈盞花素低濃度組59.50±4.03a,c61.06±5.59a,c76.88±6.62a,c36.34±6.03a,c0.16±0.13a0.95±0.15a燈盞花素高濃度組71.84±3.39a,c,e79.81±7.04a,c,e33.26±4.11a,c,e21.08±5.49a,c,e0.55±0.16a,c,e0.73±0.09c F102.3097.5786.99105.32100.5972.55P<0.05<0.05<0.05<0.05<0.05<0.05
注:aP<0.05vs對照組;cP<0.05vs高糖組;eP<0.05vs燈盞花素低濃度組。
2.4燈盞花素對RPE細胞凋亡的影響四組RPE細胞凋亡率比較,差異有統計學意義(P<0.05,表1)。在Hoechst 33258染色劑作用下,活細胞細胞核呈彌散均勻熒光,凋亡細胞的細胞核或細胞質呈現致密濃染的顆粒狀高熒光。熒光顯微鏡下,對照組背景熒光暗黑色,細胞核均勻染色,未見明顯凋亡細胞;高糖組部分細胞核呈致密濃染的亮藍色高熒光;1、10μmol/L燈盞花素處理后凋亡細胞數量逐漸減少(圖3),燈盞花素高濃度組細胞凋亡率與燈盞花素低濃度組比較,差異有統計學意義(P<0.05)。
2.5 Bcl-2和Bax蛋白表達水平檢測四組RPE細胞中Bcl-2和Bax蛋白表達水平比較,差異有統計學意義(P<0.05,表1,圖4)。Bcl-2蛋白在高糖組中的表達明顯降低,與對照組相比差異有統計學意義(P<0.05)。低、高濃度燈盞花素組Bcl-2蛋白表達逐漸升高,其中高濃度燈盞花素組Bcl-2蛋白表達與高糖組比較,差異有統計學意義(P<0.05);燈盞花素高濃度組Bcl-2蛋白相對表達量與燈盞花素低濃度組比較,差異有統計學意義(P<0.05)。Bax蛋白在高糖組中的表達明顯升高,與對照組相比差異有統計學意義(P<0.05);燈盞花素干預可降低Bax蛋白的表達,其中高劑量燈盞花素組Bax蛋白表達的相對表達量與高糖組相比,差異有統計學意義(P<0.05)。

圖4燈盞花素對RPE細胞內Bcl-2和Bax表達的影響。
3討論
隨著糖尿病的進展,其并發癥開始出現,如糖尿病視網膜病變、周圍神經病變、糖尿病腎病、糖尿病足潰瘍、心血管疾病等[5]。其中,糖尿病腎病和視網膜病變是慢性高血糖引起的主要微血管并發癥,其發生原因與晚期氧化應激的誘導、促炎微環境的建立以及糖基化終產物增多有關[6-7]。
有研究顯示,燈盞花素在治療糖尿病腎病和周圍神經病變方面均有療效,其作用機制與降低組織氧化應激水平、抑制炎癥反應和調節血管內皮生長因子(vascular endothelial growth factor,VEGF)的表達有關[8-9]。在眼部,有學者采用霧化燈盞花素注射液方法治療糖尿病視網膜病變,發現該方法具有延緩糖尿病視網膜病變進程、改善患者視功能和提高生活質量的作用。此外,燈盞花素注射液在治療中心性漿液性脈絡膜視網膜病變、視網膜中央靜脈阻塞方面均有臨床療效[10-11]。關于燈盞花素對RPE細胞保護作用的研究并不多見,國內學者王競男等[12]通過建立大鼠糖尿病模型,觀察燈盞花素對大鼠視網膜組織中VEGF表達的影響,結果顯示燈盞花素可以有效降低VEGF表達,從而推測燈盞花素可以延緩糖尿病視網膜病變病程。
有學者對糖尿病大鼠視網膜進行深入研究,結果顯示過氧化氫酶、谷胱甘肽過氧化物酶、谷胱甘肽還原酶和超氧化物歧化酶表達明顯下調,而超氧化物明顯增加,說明糖尿病大鼠視網膜組織氧化應激程度明顯增加[13-14]。本實驗使用30mmol/L濃度的葡萄糖建立了RPE細胞高糖氧化應激模型,結果顯示30mmol/L濃度的葡萄糖引起RPE細胞活力降低,給予1、10μmol/L燈盞花素作用后,細胞活力增加。
H2DCFDA是一種可滲透細胞的熒光探針,用于檢測細胞內的ROS生成。本實驗采用流式細胞技術觀察高糖對RPE細胞的氧化損傷程度,結果顯示高糖對RPE細胞氧化損傷有明顯刺激作用,燈盞花素有效抑制了RPE細胞內ROS含量。
Hoechst 33258染色劑能與細胞核DNA結合并呈現藍色熒光。凋亡的細胞核濃染,熒光增強,呈致密顆粒和(或)塊狀高熒光;非凋亡細胞呈暗藍色低熒光。本實驗中,高糖組中亮藍色熒光明顯增多,證實高糖可以誘發RPE細胞凋亡,燈盞花素低劑量組和燈盞花素高劑量組中凋亡細胞比例逐漸降低。
Bcl-2在氧化應激介導的細胞凋亡反應中起重要作用,是調節線粒體凋亡途徑的重要分子,具有潛在的抗凋亡作用[15]。Bax表達水平的高低直接反映細胞凋亡程度,Western blot結果顯示,高糖組細胞中Bcl-2蛋白表達明顯降低,Bax蛋白表達明顯增加,提示高糖誘導了RPE細胞凋亡,燈盞花素通過改變Bcl-2和Bax蛋白的表達發揮抗細胞凋亡作用。
綜上所述,燈盞花素能夠有效抑制高糖誘導的RPE細胞凋亡,為糖尿病視網膜病變的治療靶點研究提供了理論支持。

