口腔鱗狀細胞癌表面增強拉曼光譜的納米探針構建及應用研究
閆 冰 薛麗麗 關麗梅 張炳煌 駱獻陽▲
1.廈門大學附屬第一醫院耳鼻咽喉頭頸外科,福建廈門 361003;2.廈門大學醫學院,福建廈門 361003;3.廈門市耳鼻咽喉頭頸外科重點實驗室,福建廈門 361003;4.廈門大學附屬第一醫院口腔科,福建廈門 361003
口腔癌是頭頸部常見惡性腫瘤,發病率逐年升高,在全身惡性腫瘤發病率排名第十二名,而在發展中國家發病率排名第八名。在我國,口腔癌發病率也呈逐年升高的趨勢[1-3]。口腔癌的病理類型主要是口腔黏膜鱗狀細胞癌,雖然隨著科技進步,口腔癌的治療方法及藥物不斷更新,但其預后依然較差,5 年存活率僅為50%~60%[3]。早期診斷、早期治療依然是改善口腔癌患者預后的最有效方法,其中治療方式以外科手術切除腫瘤及頸部淋巴結為主,術中手術切緣是否有腫瘤殘留對患者的預后至關重要。
表面增強拉曼光譜技術(surface-enhanced Raman spectroscopy,SERS)基于電磁場增強和電荷轉移增強的拉曼光譜新技術,其原理是將納米級探針加入在待測樣本中進行混合,納米探針在待測樣本表面近距離接觸時可以增強局域電磁場,提高了待測樣本分子拉曼散射的概率,從而指數級地提高待測樣本拉曼信號強度[4-5]。SERS 具有快速、便捷、無創檢測等優勢,檢測靈敏度高,單個分子樣本也可被檢測,已廣泛應用于生物醫學領域的研究,如疾病檢測及診斷[6]。
研究表明,口腔黏膜癌前病變時期表皮生長因子受體(epidermal growth factor recptor, EGFR)表達即開始增強,EGFR 主要在上皮細胞表達,在癌變過程中鱗狀上皮細胞EGFR 表達水平不斷增高[7-8]。因此,本研究構建一種EGFR 抗體修飾的納米探針并將其應用于口腔鱗狀細胞癌SERS 的檢測研究中。
1 材料和方法
1.1 EGFR抗體修飾的納米探針制備
在容量瓶中配置100mL 1.0×10-4g/mL 氯金酸水溶液,加入至250mL 圓底燒瓶中。在快速攪拌下將溶液加熱至沸騰,迅速一次性加入0.95mL 1.0×10-2g/mL 的檸檬酸鈉水溶液,繼續攪拌沸騰30min 后冷卻。然后取該溶液10mL,緩慢滴加100μL 0.1mM的4-巰基苯甲酸(4-mercaptobenzoic acid, 4-MBA)溶液并不斷攪拌,充分攪拌混合30min 后靜置過夜,再以6000r/min 離心10min,去除上清液,去離子水重懸即可使用。取上述10mL Au-MBA 粒子,在攪拌下緩慢滴加550μL 0.2mM的α-巰基-ω 羧基聚乙二醇(α- mercapto -ωcarboxyl polyethylene glycol, PEG)溶液,調整PEG的濃度為20μM,充分攪拌混合30min 后靜置過夜后,6000r/min 離心10min,去除上清液,去離子水重懸即可使用。取上述溶液10mL,加入0.5mM 的1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽[1- (3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC] 和N- 羥 基 琥 珀 酰 亞 胺(Nhydroxysuccinimide, NHS)溶液各10μL,混合攪拌30min 后離心,將剩余的EDC 和NHS 去除,加入EGFR 抗體2μL,混合攪拌30min 后保存于4℃冰箱中即可使用。生成MBA、PEG 及EGFR 抗體修飾的納米級金顆粒。
1.2 探針性能檢測
應用共聚焦顯微拉曼光譜儀(Renisha 公司,英國)對不同粒子進行拉曼光譜檢測。應用VancourRaman Algorithm 軟件[9]去除光譜熒光信號及噪聲,平滑光譜。應用Oringin 8.0(Oringin 公司,美國)軟件繪制不同粒子光譜進行比較。應用S-4800 場發射掃描電子顯微鏡檢測不同粒子形態。應用Cary5000 紫外可見近紅外分光光度計(安捷倫公司,中國)檢測不同粒子的吸收光譜,反應粒子表面變化,進而提示粒子表面被不同分子修飾。本研究采用流式細胞術檢測EGFR 抗體修飾的納米探針細胞毒性。取1mL 原液,3000r 離心10min 后去上清液,加入1mL 細胞培養基,超聲震蕩溶解,再添加9mL 培養基將納米探針濃度調整為1nmol/L,作為檢測的基準濃度分別加入到SCC-4 細胞,Tca8113細胞和成纖維細胞。應用流式細胞術對上述細胞進行檢測,觀察細胞凋亡情況,無納米探針加入的細胞組作為對照組。
1.3 口腔鱗癌腫瘤組織SERS成像研究
本研究選取無免疫裸鼠皮下接種舌鱗癌細胞SCC-4、Tca8113 及纖維肉瘤細胞HT1080。每個細胞系選取8 只小鼠進行實驗,SCC-4 和Tca8113 作為實驗組,HT1080 作為對照組。待小鼠腫瘤直徑達1cm 左右時,將濃度為1.2×10-7μmol/mL (7.3×1010個/mL)的納米粒子混懸液200μL 多點注射至腫瘤內24h 后處死小鼠,將腫瘤完整剝離后,應用Leica切片機(Leica 公司,德國)將腫瘤組織進切片,切片厚度約10μm,連續進行組織切片,將其中一張組織切片貼附于定制鋁片上,進行拉曼光譜檢測,而將另外一張組織切片貼附于載玻片上并進行HE 染色。通過與HE 切片進行位置比對后,確定鋁片上拉曼光譜檢測部位,應用Nanophoton Raman-11(Nanophoto公司,日本)激光顯微共聚焦拉曼光譜儀檢測。檢測條件:激發光波長785nm,線性掃描,激發功率10mW,掃描時間10s,光柵設定為600/mm,累及2 次。應用Raman imager(Nanophoto 公司,日本)軟件繪制組織拉曼光譜圖。
2 結果
2.1 納米探針制備及性能檢測結果
本研究中經過氧化還原方法制備的Au 納米粒子,其濃度約10nmol/L,直徑約55nm,類圓形顆粒,大小心態均一,性狀穩定,可以常溫下保存5 ~7d(圖1)。納米粒子及EGFR 抗體修飾后的納米探針掃描電鏡可見,單純Au 納米粒子容易出現團聚現象,但隨著MBA、PEG 以及EGFR 抗體加入后,修飾納米粒子表面,其團聚現象得到改善。同時在納米Au 粒子表面形成一層高分子修飾膜,表明MBA、PEG 以及EGFR 抗體成功修飾Au 粒子表面(圖1)。

圖1 納米Au 粒子及MBA、PEG 及EGFR抗體修飾的納米探針的掃面電鏡
本研究中,采用EDC 和NHS 活化PEG 的羧基端使其更好地與EGFR 抗體的氨基端相結合。不同粒子的紫外可見光吸收光譜同樣提示通過不同分子修飾后粒子表面性狀改變(圖2)。對不同粒子進行拉曼光譜檢測,結果提示單純Au 粒子無拉曼活性,但經過MBA 拉曼活性分子修飾后,可見明顯的拉曼信號1073/cm 和1589/cm。而后經過PEG修飾后,拉曼信號無明顯變化,表明PEG 無明顯拉曼活性,不會影響MBA 拉曼信號。最后在粒子表面加入EGFR 抗體修飾,經過修飾后,可見其拉曼光譜中主要拉曼信號仍為1073/cm 和1589/cm,但可見1004/cm 和1543/cm,表面納米粒子表面存在蛋白質類生物分子結構,這也從光譜檢測方面驗證了EGFR 抗體已修飾在Au 粒子表面(圖2)。同時,流式細胞儀檢測結果,經過MBA、PEG 及EGFR 抗體修飾的納米探針對細胞凋亡率也無顯著影響,見圖3 及表1。流式細胞儀結果提示實驗組和對照組細胞細胞周期無明顯差異,表明納米探針對細胞無明顯毒性。
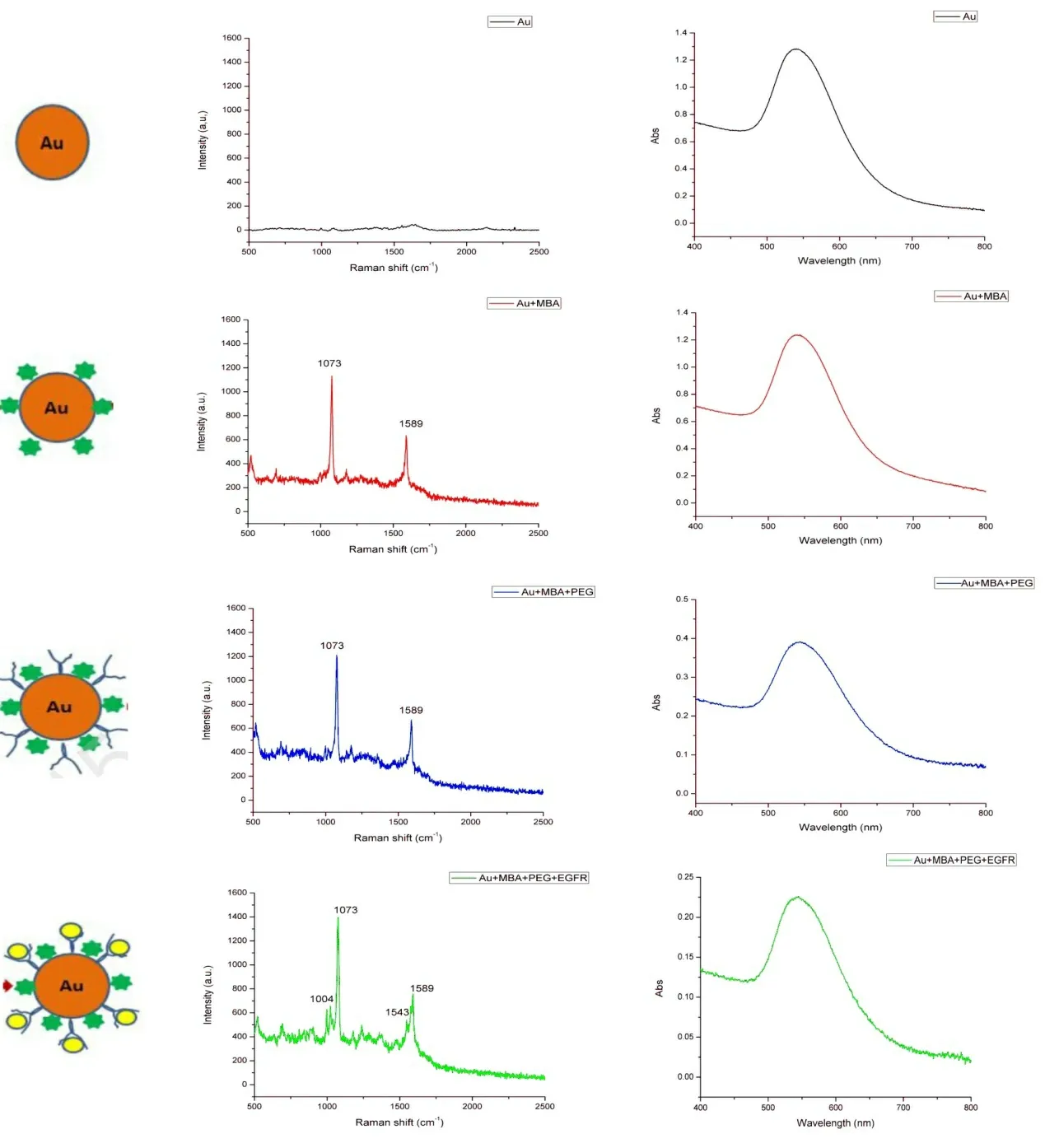
圖2 納米Au 粒子及MBA、PEG、EGFR 抗體修飾納米粒子表面不同階段的拉曼光譜及吸收光譜
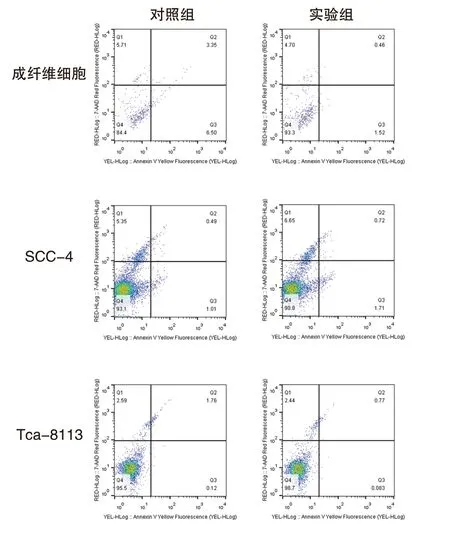
圖3 不同組細胞流式細胞檢測細胞凋亡結果

表1 三種細胞經過納米探針處理24h后的細胞凋亡比例(%)
2.2 納米探針應用于口腔鱗狀細胞癌組織的SERS成像研究
HE 切片采用多個部位連續切片進行觀察。完成封片后進行鏡檢拍照,可見石蠟切片HE 染色的部分切片組織細胞核空洞,各組間未發現明顯差異,但Tca8113、SCC-4 組織內可見局部納米粒子聚集,而HT1080 腫瘤組織內未見明顯納米粒子聚集。Tca8113、SCC-4 鱗狀細胞癌腫瘤細胞EGFR高表達,而HT1080 為人成纖維肉瘤細胞,EGFR 表達較低,因此該結果提示經過修飾后的納米粒子對EGFR 高表達的腫瘤組織具有一定的特異性,傾向聚集于腫瘤細胞EGFR 高表達的腫瘤組織,而肉瘤細胞HT1080 腫瘤組織內無明顯納米粒子聚集(圖4)。應用Nanophoton Raman-11 激光顯微共聚焦拉曼光譜儀檢測對SCC-4、Tca8113 及HT1080 腫瘤組織進行拉曼光譜檢測,以納米探針上MBA 拉曼活性信號1073/cm 作為特征譜峰,繪制腫瘤組織的拉曼光譜圖像。如圖5 所示,鱗狀細胞癌腫瘤組織內可見增強拉曼光譜信號1073/cm(圖中白色亮點),而肉瘤腫瘤組織內未見明顯增強拉曼信號。這表明合成納米粒子具有一定的選擇性,可以用于鱗狀細胞癌的表面增強拉曼光譜檢測研究。該結果提示經過MBA-PEG-EGFR 抗體修飾的納米級金顆粒可以用于EGFR 高表達的腫瘤組織篩查,為臨床上檢測EGFR 高表達的鱗狀細胞癌腫瘤組織提供了理論依據。

圖4 小鼠成瘤組織HE 切片
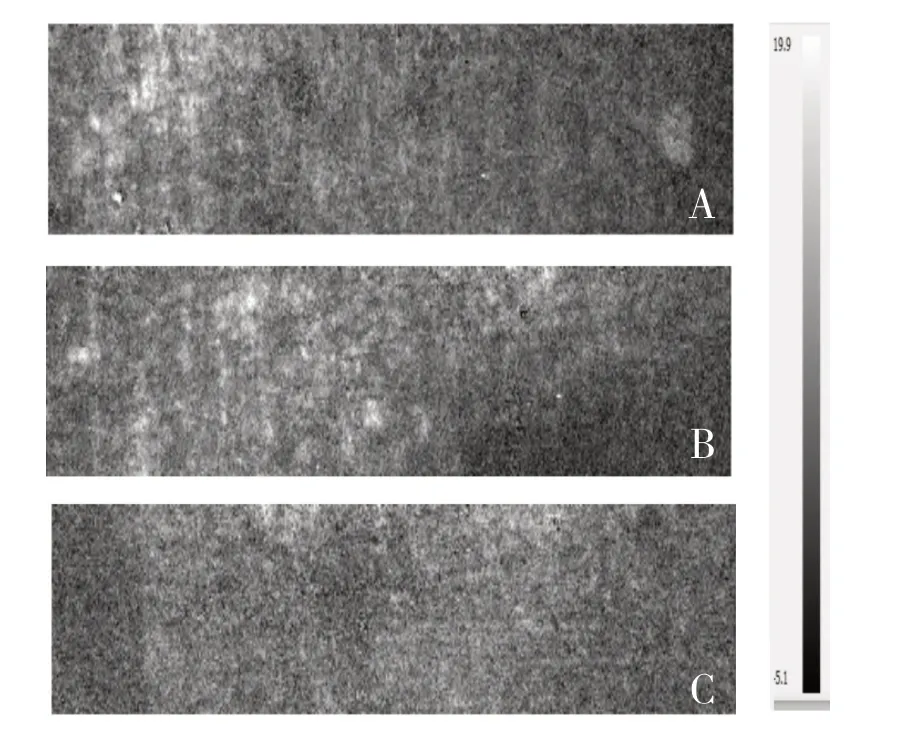
圖5 小鼠成瘤組織的拉曼光譜圖像
3 討論
隨著激光技術及儀器的發展,光譜技術在惡性腫瘤的診斷及檢測被廣泛應用,如紅外光譜檢測、組織熒光檢測、拉曼光譜檢測等技術,這些技術的應用為惡性腫瘤的診斷提供了一種實時、便捷、準確、無創的新方法[10]。在眾多的光譜診斷技術中,拉曼光譜技術成為近年來在生物醫學領域研究的熱點技術,其原理是分子振動引起入射光與散射光頻率的差異來反映樣本分子結構及組成等信息,靈敏性高,特異性強,檢測樣本無需處理、普適性好、操作便捷等優點,在生物醫學研究領域被廣泛應用[11-14]。在檢測生物樣本的研究中,拉曼光譜技術具有獨特優勢,譜峰分辨率高,可以檢測液體樣本、快速成像等,適用于臨床疾病組織樣本研究[15]。拉曼光譜對樣本條件要求較低,無需預處理,同時光譜信息豐富,可獲得樣本內細胞、組織或體液分子結構和物質組成的信息,可以檢測磷脂、DNA、多肽等物質成分組成及分子結構信息,有“分子指紋”技術之稱[15-16]。基于拉曼光譜的上述優點,拉曼光譜技術被應用于檢測口腔癌的研究,獲得良好的結果,平均診斷準確率高達90%以上[17-18]。
本研究在應用SERS 檢測技術中引入拉曼活性分子MBA、高分子PEG 及EGFR 抗體來修飾納米粒子表面。應用生物親和性高分子PEG 修飾納米級探針,其巰基可以與納米探針表層結合,為納米提供了良好的空間穩定性,同時羧基為EGFR 抗體標記提供了良好的位點[19-20]。此外,在納米粒子表面引入拉曼活性分子MBA 作為示蹤劑用于標記納米探針,從而制備出一種能準確檢測舌鱗狀細胞癌分子邊界的特異性SERE 探針。PEG 作為修飾探針表層的高分子,其長鏈結構既可以為探針提供良好的空間穩定性及生物親和性能,長鏈結構的空間位阻又可以保護作為拉曼示蹤標記的MBA。PEG上的羧基經過活化劑活化后與EGFR 抗體表面的氨基相結合,從而使納米探針具備檢測腫瘤組織中EGFR 表達的特異性探針[21]。
EGFR 是一種酪氨酸激酶型跨膜受體,通過與配體結合導致EGFR 之間二聚化,激活細胞內酪氨酸激酶功能域,啟動下游細胞信號通路,從而抑制細胞凋亡,有助于細胞增殖和促進血管新生,與惡性腫瘤細胞轉移功能有關[22-25]。有研究顯示,在無糜爛性和潰瘍性病變的口腔扁平苔蘚標本中,EGFR 表達較弱,而在糜爛性和潰瘍性病變的扁平苔蘚標本、鱗狀細胞乳頭狀瘤標本及鱗狀細胞癌標本中EGFR 的陽性率分別為20%、25%和60%,表明EGFR 在從扁平苔蘚到口腔鱗狀細胞癌的惡性轉化過程中表達不斷增加。Khan 等[24]對97 例口腔鱗癌組織標本進行研究發現EGFR 蛋白表達高達92.8%。Huang 等[25]在對194 例口腔鱗狀細胞癌腫瘤標本進行研究發現,EGFR 過表達的患者預后較差,主要體現為較短的無瘤生存期,這與腫瘤細胞淋巴結轉移相關,因此EGFR 過表達可以作為口腔鱗狀細胞癌患者的預后評估生物標志物。因此,本研究通過構建檢測口腔鱗狀細胞癌組織內EGFR 的特異性納米探針,應用SERS 技術檢測檢測出鱗狀細胞癌組織內EGFR 表達情況,繪制出腫瘤組織EGFR 表達的拉曼圖像,為臨床提供一種快速、便捷、準確、可視化的腫瘤組織EGFR 表達的檢測新方法,為臨床上應用拉曼光譜技術檢測口腔鱗狀細胞癌手術切緣EGFR 的表達情況、評估患者預后、早期診斷口腔鱗狀細胞癌等提供理論基礎和實驗技術支持,進一步促進口腔癌早期診斷、術中檢測及預后評估等技術的發展,提高口腔癌患者生活質量及預后。

