葉片衰老誘導(dǎo)FLP重組酶刪除轉(zhuǎn)基因煙草外源基因的研究
秦利軍,李啟龍,趙德剛,2
1 貴州大學(xué)農(nóng)業(yè)生物工程研究院/山地植物資源保護(hù)與種質(zhì)創(chuàng)新省部共建教育部重點(diǎn)實(shí)驗(yàn)室,貴州貴陽甲秀南路 550025;
2 貴州省農(nóng)業(yè)科學(xué)院,貴州貴陽金欣社區(qū)1號 550006
自1983年首次獲得轉(zhuǎn)基因煙草后,轉(zhuǎn)基因技術(shù)已廣泛應(yīng)用到多種農(nóng)作物中[1],但轉(zhuǎn)基因作物可能存在的環(huán)境及食品安全問題也備受關(guān)注[2]。標(biāo)記基因剔除是利用特異位點(diǎn)重組實(shí)現(xiàn)轉(zhuǎn)基因植物中選擇標(biāo)記基因的清除,從而獲得無選擇標(biāo)記基因的植物(Marker-free transgenic plants,MFTPs)[3]。目前,在眾多標(biāo)記基因清除技術(shù)中以位點(diǎn)特異性重組系統(tǒng)(Site-specific recombination)應(yīng)用最為廣泛[4]。最常用的兩種位點(diǎn)特異性重組系統(tǒng)包括噬菌體(Phage)Pl的Cre/LoxP系統(tǒng)和啤酒酵母(Saccharomyces cerevisiae)的FLP/FRT系統(tǒng)[3,5-7]。Dale等[8]首次利用Cre/LoxP系統(tǒng)轉(zhuǎn)化煙草,成功實(shí)現(xiàn)了Cre重組酶對熒光素酶基因(Luc)、選擇標(biāo)記基因(Hpt)的有效清除,清除率高達(dá)90%。之后該技術(shù)又成功應(yīng)用到煙草(Nicotiana tabacum)[9]、擬南芥(Arabidopsis thaliana)[10]、玉米(Zea mays)[11]、水稻(Oryza sativa)[12]、大豆(Glycine max)[13]、馬鈴薯(Solanum tuberosum)[14]、番茄(Lycopersicum esculentum)[15]等多種作物中。FLP/FRT系統(tǒng)也同樣能刪除報告基因Gus和篩選基因NptⅡ,創(chuàng)立安全的轉(zhuǎn)基因水稻和玉米新品系[16,17]。但這兩種系統(tǒng)在應(yīng)用上也存在一定的弊端,如可能引起基因重排和導(dǎo)致物種出現(xiàn)特異性缺陷等[18,19],使其應(yīng)用受到一定限制。2007年,Li實(shí)驗(yàn)室最先將噬菌體P1的Cre/LoxP系統(tǒng)和酵母(S.cerevisiae)的FLP/FRT系統(tǒng)融合成新的重組酶識別位點(diǎn)LF(LoxP-FRT),開創(chuàng)了“外源基因清除(Gene-Deletor)”技術(shù)。特異性啟動子驅(qū)動重組酶Cre或者FLP在適當(dāng)?shù)臅r間和空間表達(dá)后,重組酶即可識別兩個融合識別位點(diǎn)LF之間的序列(也包括重組酶自身基因序列),進(jìn)而將這些序列在特定的時間和特定的部位從植物器官的細(xì)胞基因組中全部清除(圖1)。
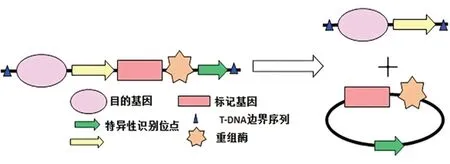
圖1 重組酶介導(dǎo)的標(biāo)記基因刪除系統(tǒng)[20]Fig.1 Selectable gene-deletor system induced by site-specific recombinase
有研究者將該技術(shù)與特異性啟動子(如,花粉或種子特異表達(dá)啟動子)相結(jié)合,成功了實(shí)現(xiàn)了轉(zhuǎn)基因植物花粉或種子中外源基因的100%清除,為該系統(tǒng)的廣泛應(yīng)用奠定基礎(chǔ)[21,22]。已有文獻(xiàn)報道,擬南芥(A.thaliana)SAG12基因可編碼半胱氨酸蛋白酶(cysteine protease),該基因表達(dá)不僅嚴(yán)格受發(fā)育調(diào)控的衰老途徑所特異性調(diào)節(jié),而且僅在衰老組織中表達(dá)。啟動子缺失和片段重組的研究表明,SAG12啟動子的一個高度保守區(qū)域負(fù)責(zé)衰老特異性調(diào)控。從不同葉齡(年輕和衰老)的擬南芥葉片中分離到可與SAG12啟動子元件結(jié)合的差異結(jié)合因子[23]。Calderini[24]利用SAG12啟動子特異性地控制的IPT基因表達(dá),從而延緩了紫花苜蓿(Medicago sativa)葉片的衰老。本研究以含有衰老特異表達(dá)基因SAG12啟動子驅(qū)動“LoxP/FRT”系統(tǒng)表達(dá)的轉(zhuǎn)基因煙草為材料,通過分析轉(zhuǎn)基因株系不同葉齡葉片、花藥及花粉中GUS的表達(dá)活性,研究轉(zhuǎn)基因煙草葉齡與GUS蛋白活性及除草劑草銨膦的抗性關(guān)系,探討“LoxP/FRT”系統(tǒng)在葉片中引起的外源基因清除效率;另外,通過轉(zhuǎn)基因煙草植株花粉中GUS染色數(shù)目的統(tǒng)計分析,計算外源基因清除系統(tǒng)在不同轉(zhuǎn)基因煙草株系花粉中的清除效率,為利用“LoxP/FRT”系統(tǒng)快速培育不含外源基因的轉(zhuǎn)基因煙草新種質(zhì)提供一定參考。
1 材料與方法
1.1 材料、試劑與儀器
1.1.1 試驗(yàn)材料
供試材料:野生型栽培煙草K326(N.tabacumL.cv.K326)、轉(zhuǎn)基因煙草株系Q1、Q2和Q3株系含有以擬南芥(A.thaliana)衰老基因SAG12啟動子PSAG12驅(qū)動重組酶FLP識別重組位點(diǎn)“別重組位點(diǎn)FRT”表達(dá)的清除系統(tǒng)和含有普通煙草(N.tabacum)泛素蛋白基因Ubi啟動子PUbi啟動的草甘膦篩選和GUS報告的融合基因Gus::Bar,其植物表達(dá)載體pGM626-SAF-Ucn(見圖2A),Q1和Q3株系均含1個外源基因拷貝,Q2株系含2個外源基因拷貝;轉(zhuǎn)基因株系Q0中所轉(zhuǎn)的表達(dá)元件除不含F(xiàn)LP基因,其它與Q1、Q2和Q3株系相同,其植物表達(dá)載體pGM626-SA-Ucn(見圖2B)。
將野生型K326、Q0、Q1、Q2和Q3株系的種子撒播于煙草育苗盤上進(jìn)行漂浮培養(yǎng)。待煙苗長至3~5葉期時,各取25株生長良好、長勢一致的轉(zhuǎn)基因及野生型煙草,分別移栽至含培養(yǎng)基質(zhì)(菜園土∶Hawita泥炭土=3∶1)的花盆(高16 cm,直徑20 cm,培養(yǎng)基質(zhì)10 kg)中繼續(xù)生長,每盆種1株苗。每盆施1~2 g復(fù)合肥(N ∶ P2O5∶ K2O=10∶ 10∶12),期間追肥1次。種植條件:相對濕度70~80%,16 h光照 /8 h 黑暗,25~28 ℃。
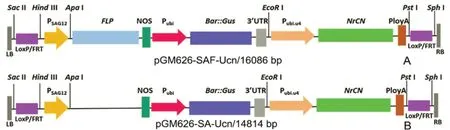
圖2 植物表達(dá)載體pGM626-SAF-UCn和pGM626-SA-Ucn圖譜Fig.2 Construction of plants expression vectors pGM626-SAF-UCn and pGM626-SA-Ucn
1.1.2 試劑
草銨膦(Phosphinothricin,PPT)購自美國Sigma公司;Plant DNA Kit購自天根(北京)生物科技有限公司;Plant RNA Kit購自美國 OMEGA Bio-Tek 有限公司;DL 2000 DNA Marker購自日本 Takara(大連)生物公司;MultiScribeTMReverse Transcriptase Kit、Power SYBR?Green PCR Master Mix購自于美國Applied Biosystems公司;可溶性糖測定試劑盒購自南京建成生物工程研究所;引物由上海旭冠生物科技有限公司合成。
1.2 方法
1.2.1 轉(zhuǎn)基因煙株的PCR鑒定
根據(jù)Plant DNA Kit試劑盒操作說明書提取萌發(fā)至3~5葉期煙株的總基因組DNA。以基因組DNA為模板,用引物FUbi.U4(5'-AGGAGCCTCTTTGTTCCC-3')和RUbi.CN(5'-TCATTCAAACAC -CACCTCG-3')對特異性片段U4-CN(含550 bp煙草PUbi.U4序列和257 bp CN基因序列)進(jìn)行擴(kuò)增。PCR擴(kuò)增條件:94℃ 3 min;94℃ 20 s,58℃ 30 s,72℃ 1 min,30個循環(huán);72℃ 5 min。
1.2.2 轉(zhuǎn)基因煙草不同組織GUS活性分析
以移栽 25 d、30 d、45 d、60 d 轉(zhuǎn)基因煙草葉片和現(xiàn)蕾期花藥為材料,分析GUS蛋白在兩者中的表達(dá)活性。分別對移栽 25 d、30 d、45 d、60 d 時的相同葉位轉(zhuǎn)基因煙草小葉塊(約1 cm2左右)進(jìn)行GUS活性分析,每個株系選3個單株取樣進(jìn)行葉塊染色實(shí)驗(yàn)另剪取現(xiàn)蕾期轉(zhuǎn)基因煙株的花藥(每個株系各取8個花藥)和收集盛花期轉(zhuǎn)基因煙株的花粉(每個株系單株套袋收集花粉),分別置于含有GUS染液的0.5 mL離心管中進(jìn)行GUS染色。將浸沒于GUS染色液的煙草葉塊、花藥及花粉分別置于真空濃縮儀(ZLS-1)中,以25 Kpa壓力抽真空15 min后放入37℃恒溫培養(yǎng)箱中孵育過夜。次日依次以95%乙醇、75%乙醇、50%乙醇和20%乙醇逐級梯度浸提葉片色素,以便觀察GUS染色結(jié)果。GUS染色液配置:100 mmol/L Tris-HCl,0.5 mmol/L NaCl,0.02 mmol/L K3Fe(CN)6,50 mmol/L CH3OH,8.65 μmmol/L X-Gluc(5-溴 -4-氯 -3-吲哚 -β-D-葡萄糖苷酸)。以野生型植株葉塊、花藥及花粉為對照。
1.2.3 轉(zhuǎn)基因煙草對草銨膦敏感性分析
轉(zhuǎn)基因煙草含有Bar::GUS融合篩選報告基因,其中Bar基因?qū)Τ輨┎蒌@膦具有抗性。分別對不同轉(zhuǎn)基因株系上、中和下部葉片(不同葉位葉片代表葉齡的差異)進(jìn)行草銨膦(4 mg/L)涂抹處理,觀察草胺膦處理 5 d、9 d、16 d后對煙株上、中和下部葉片形態(tài)變化的影響,每個株系選3株進(jìn)行處理,以野生型煙草處理為對照。
1.2.4 葉片外源基因的表達(dá)量分析
根據(jù)Plant RNA Kit操作說明書提取不同移栽天數(shù)(移栽后 10 d、25 d、40 d 和 60 d)轉(zhuǎn)基因株系葉片的總RNA,并反轉(zhuǎn)錄成cDNA。采用反轉(zhuǎn)錄PCR(Reverse transcription PCR,RT-PCR)和實(shí)時熒光定量PCR(Real-time PCR,PCR)技術(shù)對外源Bar::Gus和FLP基因的表達(dá)量進(jìn)行分析,以Actin為內(nèi)參。每個轉(zhuǎn)基因株系各取5株,為5次重復(fù),以非轉(zhuǎn)基因煙草為對照,基因引物序列見表1。

表1 外源基因表達(dá)量分析的引物序列Tab.1 Primer sequences of relative expression analysis for exogenous genes
1.2.5 外源基因刪除率的分析
轉(zhuǎn)基因煙草植株花粉進(jìn)行GUS染色后,在光學(xué)顯微鏡下分別記錄各煙株花粉細(xì)胞的染色情況,每個株系各選5個單株進(jìn)行花粉染色觀察。分別統(tǒng)計各單株的藍(lán)色和白色花粉數(shù)目,并以此計算外源基因在轉(zhuǎn)基因煙草花粉中的刪除率。計算公式:
GUS染色陽性率=染色呈藍(lán)色花粉數(shù)/總花粉數(shù)×100%
1.2.6 數(shù)據(jù)處理
采用 Microsoft Excel 2003 及 SPSS 16.0 軟件進(jìn)行數(shù)據(jù)處理,Duncan法分析其差異顯著性。
2 結(jié)果
2.1 轉(zhuǎn)基因煙草移栽及鑒定
對萌發(fā)至苗期的T2代轉(zhuǎn)基因煙草植株進(jìn)行GUS染色和PCR擴(kuò)增檢測,共獲得3個獨(dú)立轉(zhuǎn)基因株系及空載體對照煙草植株54株,其中Q1株系13株、Q2株系10株、Q3株系15株,Q0株系16株,種植的轉(zhuǎn)基因植株中部分在生長過程中死亡,移栽存活的株系GUS染色和PCR擴(kuò)增均呈陽性(圖3A,3B)。農(nóng)藝性狀測定結(jié)果表明,各轉(zhuǎn)基因煙株在旺長期、盛花期和成株期的株高、葉片數(shù)、開花期等形態(tài)指標(biāo)與野生型煙株相比均無顯著差異(圖4)。
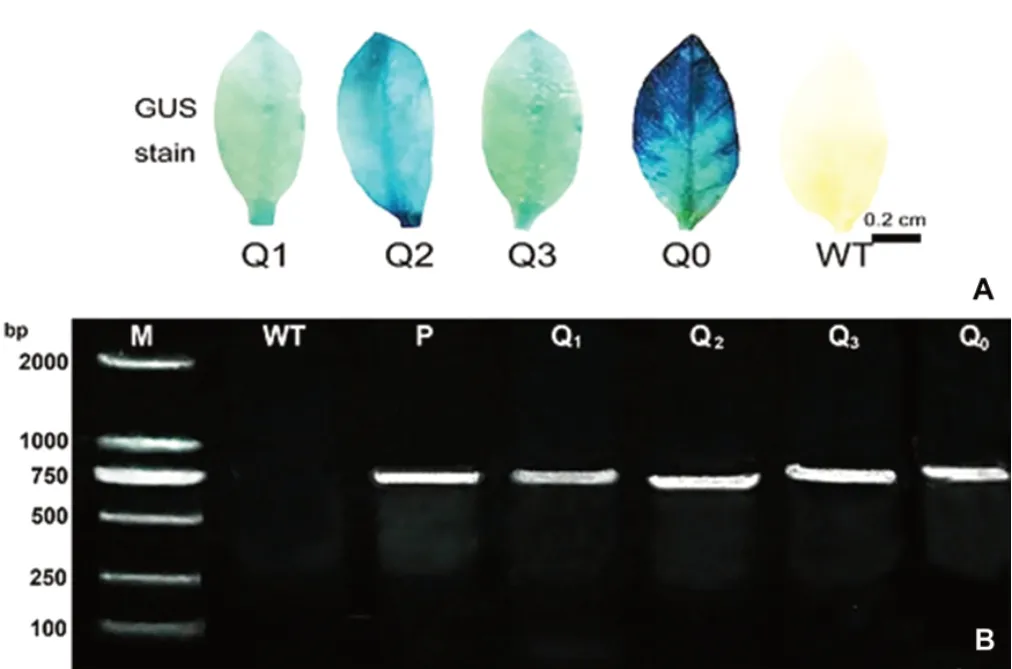
圖3 轉(zhuǎn)基因株系GUS染色及PCR鑒定Fig.3 GUS staining and PCR identification of transgenic lines

圖4 轉(zhuǎn)基因煙草與非轉(zhuǎn)基因煙草形態(tài)特征比較Fig.4 Comparison of morphological characteristics between transgenic lines and wild type lines
2.2 轉(zhuǎn)基因煙草GUS染色活性分析
轉(zhuǎn)基因植株同一生長期葉片GUS組織化學(xué)染色表明,各獨(dú)立轉(zhuǎn)基因株系中GUS表達(dá)強(qiáng)弱有一定的差異,以Q2株系活性最強(qiáng),Q3株系次之,Q1株系最弱(圖5),說明不同株系表現(xiàn)出的GUS蛋白活性差異可能是由外源報告基因GUS的拷貝數(shù)不同所引起,之前的外源基因拷貝數(shù)分析結(jié)果表明轉(zhuǎn)基因植株含有1-2個拷貝的外源基因[25]。為了進(jìn)一步分析外源基因清除效率與葉片衰老間的關(guān)系,對不同移栽天數(shù)(25 d、30 d、45 d 和 60 d)轉(zhuǎn)基因煙草葉塊進(jìn)行GUS染色,結(jié)果表明三種獨(dú)立轉(zhuǎn)化的煙草株系(Q1、Q2和Q3)葉片GUS活性均表現(xiàn)隨取材的衰老而逐漸降低(圖5)。當(dāng)煙株移栽60 d后,Q1株系低葉位葉片中幾乎檢測不到GUS蛋白活性,說明葉片的衰老引起了外源GUS蛋白表達(dá)量下降。另外,轉(zhuǎn)基因煙草花粉染色結(jié)果顯示,不同轉(zhuǎn)基因株系(Q1、Q2及Q3)花粉中也表現(xiàn)出了不同程度的外源基因清除(圖6A)。其中以Q1株系花粉中外源基因平均清除效率最高,其次是Q3,而Q2植株中外源基因清除效率最低。不同轉(zhuǎn)基因煙株其花藥GUS著色表現(xiàn)出一定程度的差異(圖6B)。

圖5 不同轉(zhuǎn)基因株系及不同葉齡葉片GUS組織化學(xué)染色觀察Fig.5 Observation of GUS stain in different transgenic plants and at different leaf stages
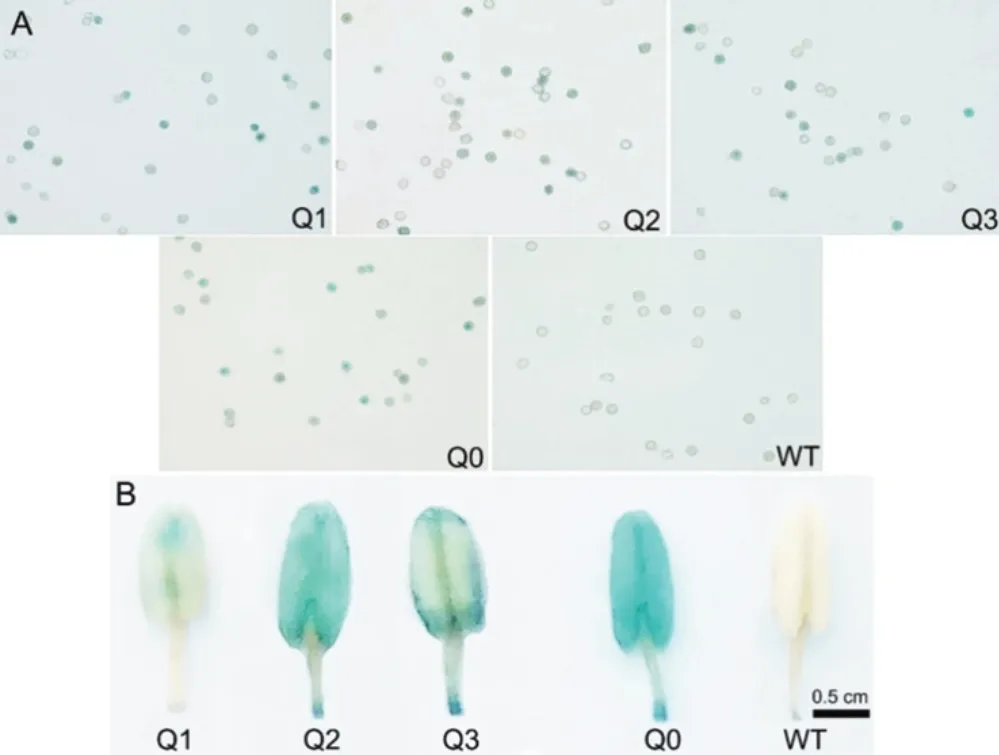
圖6 不同煙草株系花藥及花粉粒GUS組織化學(xué)染色Fig.6 GUS stain for anthers and pollen grains in different tobacco lines
2.3 轉(zhuǎn)基因煙草除草劑抗性分析
分析不同生育期煙草葉片對除草劑PPT的敏感性,結(jié)果顯示PPT處理煙草植株5 d時,轉(zhuǎn)基因和非轉(zhuǎn)基因煙草植株立即出現(xiàn)對PPT敏感的應(yīng)答差異。Q2植株對草銨膦的敏感性最低,表現(xiàn)為草銨膦處理后葉片沒有出現(xiàn)明顯的黃化現(xiàn)象,而野生型對除草劑表現(xiàn)最為敏感,處理5 d后嫩葉出現(xiàn)明顯變黃特征。當(dāng)草銨膦處理9 d時,轉(zhuǎn)基因株系Q1和Q3中部及下部葉片對PPT的敏感性逐漸增強(qiáng),其中以Q3株系敏感性增幅最為顯著,此時Q2株系中部葉片仍對PPT表現(xiàn)出較弱的敏感性(圖7)。但隨著植株的生長成熟,各獨(dú)立轉(zhuǎn)基因株系葉片均表現(xiàn)對草銨膦敏感,且部分轉(zhuǎn)基因植株下部的葉片對草銨膦表現(xiàn)出的敏感性與野生型植株相當(dāng),說明隨著轉(zhuǎn)基因植株葉片的衰老,外源篩選基因Bar也逐漸發(fā)生了清除。
2.4 轉(zhuǎn)基因煙草外源基因表達(dá)量分析
外源基因Real-time PCR分析結(jié)果表明,不同轉(zhuǎn)基因煙株外源基因(重組酶FLP基因和篩選報告Bar::GUS融合基因)表達(dá)量變化表現(xiàn)出一定差異。隨著移栽天數(shù)推移、葉片的生長發(fā)育,葉片中外源FLP基因起始表達(dá)且表達(dá)水平呈逐漸上升趨勢,移栽第40 d時FLP基因的表達(dá)水平最高,分別比移栽第60 d時增加1.21倍(Q1株系)、2.52倍(Q2株系)和1.35倍(Q3株系);另外,外源篩選報告融合基因Bar::GUS表達(dá)水平總體呈現(xiàn)隨著移栽天數(shù)的推移而下降的趨勢,但以Q1和Q3株系中Bar::GUS基因量的降幅最大,移栽第60 d時這兩個株系中的Bar::GUS基因幾乎無表達(dá),但Q2中仍能檢測Bar::GUS基因表達(dá)(圖8A),這一實(shí)驗(yàn)結(jié)果與之前發(fā)表的研究結(jié)果一致[25]。外源基因的RT-PCR分析結(jié)果也表明,移栽第10 d時轉(zhuǎn)基因株系Q1、Q2和Q3中均有較高水平的Bar::Gus表達(dá),Q2中Bar::Gus表達(dá)量最高,之后在移栽第40 d時轉(zhuǎn)基因各株系中Bar::Gus基因表達(dá)隨之下降,以Q1和Q3植株中外源基因表達(dá)量降幅最顯著;而FLP基因在移栽早期(10 d)在所有轉(zhuǎn)基因植株中都有表達(dá)但表達(dá)量不高,移栽后期(40 d)FLP基因在Q1和Q3株系中表達(dá)量極低,在Q2中表達(dá)量較高(圖8B)。

圖7 轉(zhuǎn)基因煙草不同生育期葉片對除草劑草銨膦的抗性比較Fig.7 Comparison of phosphinothricin-resistance in leaves at different growth periods between transgenic and wild type tobacco plants

圖8 轉(zhuǎn)基因煙草葉片中外源基因表達(dá)量分析Fig.8 Expression analysis of exogenous genes in transgenic tobacco plants
2.5 轉(zhuǎn)基因煙草花粉中外源基因清除效率統(tǒng)計
不同株系不同單株間花粉外源基因清除效率統(tǒng)計見表2,統(tǒng)計結(jié)果顯示外源基因清除效率介于51.3~83.6%之間,說明葉片衰老特異啟動引起的外源基因清除事件也可在配子細(xì)胞的外源基因清除中具有一定作用。

表2 轉(zhuǎn)基因煙草花粉中外源基因清除效率(GUS蛋白為標(biāo)記)Tab.2 Excision efficiency of exogenous gene in pollen of transgenic tobaccos
3 討論
轉(zhuǎn)基因育種在培育高產(chǎn)、優(yōu)質(zhì)、抗逆、廣適的作物新品過程中具有高效、穩(wěn)定、周期短、成本低等優(yōu)點(diǎn),是當(dāng)前作物育種的一種新策略[26],但轉(zhuǎn)基因作物可能存在將其外源基因以多種途徑擴(kuò)散到自然界并破壞生態(tài)平衡的潛在風(fēng)險[2,7]。2007年,美國康涅狄格大學(xué)李義教授領(lǐng)導(dǎo)的研究小組建立了“GM-genedeletor”技術(shù),利用該技術(shù)不僅實(shí)現(xiàn)當(dāng)代轉(zhuǎn)基因煙草中外源基因的100%刪除,而且還證明這種“清除系統(tǒng)”能在無性生殖后代中可得到穩(wěn)定的遺傳[21]。本研究以含PSAG12::LoxP/FRT元件的轉(zhuǎn)基因煙草為材料,分析葉片衰老特異表達(dá)基因SAG12啟動子驅(qū)動外源基因清除的效率,分析結(jié)果表明不同轉(zhuǎn)基因株系外源報告基因GUS表達(dá)有一定差異,以Q2植株GUS著色最深,Q3植株次之,Q1植株最弱,推測Q2植株中GUS的高表達(dá)可能與GUS基因拷貝數(shù)多有一定關(guān)系。但這三個株系GUS活性均具有隨葉片的衰老而降低的特點(diǎn);同樣轉(zhuǎn)基因煙草對PPT的抗性實(shí)驗(yàn)分析表明,Q2對PPT的抗性最強(qiáng),Q3株系和Q1株系較弱。煙草葉片對PPT的抗性也表現(xiàn)為隨葉片衰老,抗性由強(qiáng)至弱的變化趨勢,與GUS染色結(jié)果一致,說明Bar::GUS基因表達(dá)與葉齡呈負(fù)相關(guān),即葉片的衰老導(dǎo)致了低外源篩選報告基因的表達(dá)水平。轉(zhuǎn)基因植株中Bar::GUS的Real-time PCR和RT-PCR分析結(jié)果也驗(yàn)證了葉齡與外源篩選報告基因表達(dá)的負(fù)相關(guān)性。同時,對外源重組酶基因FLP的基因表達(dá)分析顯示,F(xiàn)LP表達(dá)量表現(xiàn)為移栽早期低、中期高、后期低的變化趨勢,說明轉(zhuǎn)基因植株隨著發(fā)育、成熟,SAG12基因啟動子驅(qū)動的FLP基因起始表達(dá)且表達(dá)水平隨葉片衰老而不斷增強(qiáng),進(jìn)而引起FLP啟動包含特異位點(diǎn)兩端間的外源基因片段刪除,故移栽后期FLP和Bar::GUS基因均發(fā)生了清除,這個結(jié)果與之前的研究一致[25]。高媛媛等[27]利用熱擊蛋白hsp18.2基因啟動子驅(qū)動熱擊誘導(dǎo)的FLP表達(dá),獲得外源基因清除的轉(zhuǎn)基因煙草;之后李巖等[28]也將該熱擊啟動刪除系統(tǒng)應(yīng)用到矮牽牛(Petunia hybrida)中,實(shí)現(xiàn)了轉(zhuǎn)基因矮牽牛中報告基因GUS的清除。以上結(jié)果表明,“GM-gene-deletor”系統(tǒng)能與目標(biāo)啟動子結(jié)合實(shí)現(xiàn)外源基因的特異時空的清除。轉(zhuǎn)基因煙株花粉GUS活性測定表明,Q1植株外源基因清除效率平均為78.32%、Q2為54.66%、Q3為75.24%,說明葉片衰老特異基因SAG12啟動子也能在煙草花粉中表達(dá),實(shí)現(xiàn)花粉細(xì)胞中外源基因的刪除,表明該系統(tǒng)不僅能有效啟動衰老葉片中外源基因的清除,同時也會引起成熟花粉中外源基因的清除,且外源基因清除效率介于51.3—83.6%之間。盡管Noh等[23]報道認(rèn)為,SAG12的表達(dá)嚴(yán)格受發(fā)育調(diào)控的衰老途徑所特異性激活,而不受應(yīng)激或激素控制的途徑所調(diào)節(jié),但SAG12啟動子的完全活性至少需要2個結(jié)構(gòu)域協(xié)同發(fā)揮作用。Grbi?等[29]在研究擬南芥(A.thalianaL.)植物的SAG2和SAG12基因表達(dá)模式時也發(fā)現(xiàn)SAG12基因同樣也會在衰老花粉中特異性表達(dá)。綜上所述,利用“GM-gene-deletor”系統(tǒng)結(jié)合不僅可以實(shí)現(xiàn)外源基因的清除,同時可以通過將“GM-gene-deletor”系統(tǒng)中啟動子序列進(jìn)行替換實(shí)現(xiàn)外源基因特異性的刪除(如開花啟動刪除、乙醇誘導(dǎo)刪除等),進(jìn)而保障和提高轉(zhuǎn)基因植物的安全性,為培育不含選擇標(biāo)記的轉(zhuǎn)基因煙草新種質(zhì)提供理論基礎(chǔ)。
4 結(jié)論
轉(zhuǎn)基因煙株葉片衰老可誘導(dǎo)外源重組酶基因FLP表達(dá),其表達(dá)產(chǎn)物FLP重組酶特特異性識別LoxP/FRT融合位點(diǎn),進(jìn)一步引起包括篩選報告融合基因GUS::Bar及外源重組酶基因FLP在內(nèi)的所有外源基因的清除。該啟動子還能誘導(dǎo)煙株配子細(xì)胞中外源基因的刪除。
本研究可為利用該系統(tǒng)實(shí)現(xiàn)轉(zhuǎn)基因植株中外源基因的特定時空清除、培育不含選擇標(biāo)的轉(zhuǎn)基因煙草新種質(zhì)提供支持。

