酶轉化三七莖葉總皂苷制備稀有人參皂苷C-K
王彩艷,劉春瑩,肖永坤,左康澤,陳雙,徐龍權,宋建國,魚紅閃*
1(大連工業大學 生物工程學院,遼寧 大連,116034)2(大連大學,遼寧 大連,116622) 3(葵花藥業集團(天津)藥物研究院,天津,300457)
三七為常用的貴重中藥,但其入藥部位大多為其根部,其莖葉部分還沒有得到充分利用。在三七莖葉中總皂苷含量為5%(質量分數)以上,其中主要為Rb3、C-Mx1、Fa、Rc、Fc、Rd、Rb1、Gyp17等人參二醇類皂苷,它們含有相同的人參二醇苷元非糖基部分,但是帶有不同的3-O-和20-O-糖基[1-3],故導致其功效有所差異。三七莖葉總皂苷中含量高的Rb1、Rc等分子,由于帶多個糖基,故生理活性很低,但口服后能在腸道內轉化為低糖基的皂苷C-K等,但是這種轉化非常微弱,而且大部分很難被利用[4-5]。與三七莖葉總皂苷含有相同苷元的人參稀有皂苷C-K、Rg3、Rh2等,具有很好的抗癌、抗血栓、抗炎、抗皮膚老化以及治療神經系統疾病等功效,對醫藥、保健食品、化妝品的生產意義很大[6-10]。
為了從低活性的三七莖葉總皂苷中生物轉化得到高活性人參稀有皂苷,柴瑞華等用酶法將三七莖葉總皂苷轉化制備人參稀有皂苷C-K,但是其轉化得率很低[11-12]。本實驗室相繼報道了4種人參皂苷糖苷酶:即轉化原人參二醇類皂苷Rb1、Rb2、Rc和Rd的第3(碳)-O-和20(碳)-O-多種糖基的人參皂苷糖苷酶I型[13-15];轉化原人參二醇類皂苷的20-O-多種糖基的人參皂苷酶Ⅱ型[16];克隆在E.coliC41(DE3)菌種中表達的人參皂苷酶Ⅲ型,能轉化原人參二醇類皂苷的3-O-多種糖基[17],能轉化原人參三醇類皂苷的6-O-多種糖基的人參皂苷糖苷酶Ⅳ型[18]。本實驗室也報道了不同菌來源的人參皂苷糖苷酶I型[13-15],雖然都能轉化原人參二醇類皂苷第3(碳)-O-和20(碳)-O-多種糖基,但是在個別性質上有所差異。如來源于A.nigersp.G4菌的酶(分子質量80kDa),能轉化人參二醇類皂苷變成F2、C-K和少量的Rh2[13];來源于A.nigersp.G8菌的酶(分子質量75 kDa),經2個途徑轉化人參二醇類皂苷Rb1和Rb3的3-O-和20-O-糖基,即Rb1→Rd→F2→C-K和Rb1→Gyp17→Gyp75→C-K途徑;Rb3→C-Mx1→C-Mx→C-K和Rb3→Rd→F2→C-K途徑[14];也報道過利用來源于A.nigersp.G8菌的人參皂苷糖苷酶I型,生物轉化三七莖葉總皂苷制備高生理活性的稀有皂苷C-K、C-Mx[19-20];但是,上述研究的C-K轉化得率低,并且反應后殘留中間產物C-Mc。
本文為了提高三七莖葉總皂苷的C-K轉化得率,嘗試了3種菌來源的人參皂苷酶、混合酶轉化三七莖葉總皂苷,并對其酶反應條件進行優化,為充分利用三七莖葉總皂苷提供新的研究方向。
1 材料與方法
1.1 材料與試劑
三七莖葉總皂苷,遼寧桓仁陽光保健品公司;人參皂苷對照品Rb3、C-Mx1、Rc、Rb1、Rd等,天津天宿光華健康科技公司;人參皂苷對照品C-K、C-Mx、C-Mc、R7、Fc等,由本實驗室提供(全部經國家電化學和光譜研究中心以核磁共振核對結構)[19-20]。Aspergillusnigersp.G4菌[13]、Aspergillusnigersp.G8菌[14]、Aspergillusoryzaesp.G9菌[18],從大曲中篩選;AB-8大孔吸附樹脂、D-280離子交換樹脂,天津興南允能高分子技術有限公司;薄層層析板Silica gel 60-F254,德國默克公司。
1.2 儀器與設備
Waters2695高效液相色譜分析儀(帶Waters2996光電二極管陣列(PDA)檢測器及Empower色譜工作站),Waters公司。
1.3 實驗方法
1.3.1 酶液制備
配制150 mL 50 g/L麥芽汁中加入0.5 g/L的三七莖葉總皂苷的溶液,共制備30瓶,經高壓蒸汽滅菌,冷卻至室溫。經嚴格無菌操作,A.nigersp.G4菌、A.nigersp.G8菌和A.oryzaesp.G9菌各接種10瓶;在30 ℃恒溫振蕩培養箱中培養5~7 d,將發酵培養好的150 mL發酵液,用高速冷凍離心機在8 000 r/min下離心15 min,去除菌體,收集上清液;在磁力攪拌條件下,緩慢加入已研磨好的硫酸銨粉末至80%飽和度,于4 ℃下靜置4 h。再用高速冷凍離心機在13 000 r/min下離心20 min,棄上清,收集蛋白質沉淀。沉淀用10 mL、20 mmol/L、pH 5.0 醋酸-醋酸鈉緩沖液溶解,然后裝入透析袋,用相同緩沖液透析24 h,約每2 h更換一次緩沖液。透析結束后,用高速冷凍離心機在13 000 r/min下離心10 min,除去不溶性雜蛋白,所得上清液即為粗酶液。
1.3.2 酶反應方法
取0.1 mL酶液與0.1 mL 50 g/L的三七莖葉總皂苷底物溶液,加入1.5 mL離心管中,混合均勻,在45 ℃下反應24 h,反應結束后,加入0.2 mL水飽和正丁醇,混合均勻后離心,取正丁醇層溶液采用1.3.4中的TLC方法進行定性分析,取正丁醇層溶液濃縮蒸干后采用1.3.5中HPLC法進行定量分析。
C-K產率的計算方法如公式(1)所示:
(1)
式中:PC-K-酶反應產物進行HPLC分析,根據對照品C-K的回歸方程計算出產物中C-K的含量;S-酶反應中底物(三七莖葉總皂苷)的含量。
1.3.3 C-K等稀有皂苷的制備
稱取50.0 g三七莖葉總皂苷,溶于1 000 mL 20 mmol/L pH 5.0 醋酸-醋酸鈉緩沖液中,然后加入1 000 mL酶液混合,置于反應釜中,在45℃下反應24 h時。反應結束后,加入6 000 mL 950 g/L乙醇沉淀酶,并在13 000 r/min下離心20 min,取上清液濃縮,去除溶液中的乙醇,得到粗產品濃縮液。上述粗產品的濃縮液經預先處理好的1 000 mL AB-8大孔吸附樹脂柱反復吸附后(重復吸附3~4次,使皂苷充分吸附),用6倍柱體積的去離子水洗脫去除糖等雜質,再用5倍柱體積的840 g/L乙醇溶液洗脫皂苷,其洗脫液再經D-280樹脂柱脫色,減壓濃縮、干燥,得到三七莖葉總皂苷酶轉化產物混合皂苷[19-20]。
1.3.4 薄層層析法[21](thin layer chrmatographic,TLC)
薄層層析板采用Silica gel 60-F254,展開劑比例為V(氯仿)∶V(甲醇)∶V(水) = 7∶2.5∶0.5,顯色劑為10% H2SO4溶液。
1.3.5 高效液相色譜(HPLC)
色譜條件[21]:采用Waters 2695高效液相色譜分析儀,Waters 2996光電二極管陣列(PDA)檢測器及Empower色譜工作站;色譜柱:Hypersil C18柱(5 μm,φ 4.6 mm×250 mm);流動相:乙腈(A)-水(B):0~20 min,20%A等度;20~31 min,20%A~32%A線性梯度,31~40 min,32%A~43%A線性梯度;40~70 min,43%A~100%A線性梯度;進樣量:10 μL;柱溫:35℃;體積比流速:0.6 mL/min;檢測波長:203 nm。
待測樣品的溶液配制:稱取三七莖葉總皂苷4 mg,加1 mL色譜級甲醇充分溶解,待用;取4 mg酶轉化產物,充分溶解于1 mL色譜級甲醇溶液中,待用;分別精密稱取對照品人參皂苷Rb1、R7、Fc、Rc、Rb3、Rd、C-Mx1、C-K、C-Mc和C-Mx,分別配制成1 g/L色譜級甲醇溶液,待用;上述配置待用的樣品溶液,經過0.22 μm濾膜過濾后,進行HPLC分析。
1.3.6 C-K標準曲線及回歸方程
取上述配制好的對照品C-K溶液適量,加入適量的色譜級甲醇等倍稀釋成5個濃度的對照液,分別取10 μL按1.3.5色譜條件進樣分析,以對照品質量濃度為X坐標,面積值為Y坐標,繪制標準曲線并進行回歸計算,回歸方程為Y=3.72×106X-1.44×104,相關系數為0.999 2。
2 結果與分析
2.1 三七莖葉總皂苷的組成成分分析
市銷的三七莖葉總皂苷的組成,因廠家、生產批次的不同,而有所差別。對本溪陽光保健品公司的三七莖葉總皂苷產品和人參皂苷產品進行高效液相色譜分析,其結果如圖1、圖2、表1所示。
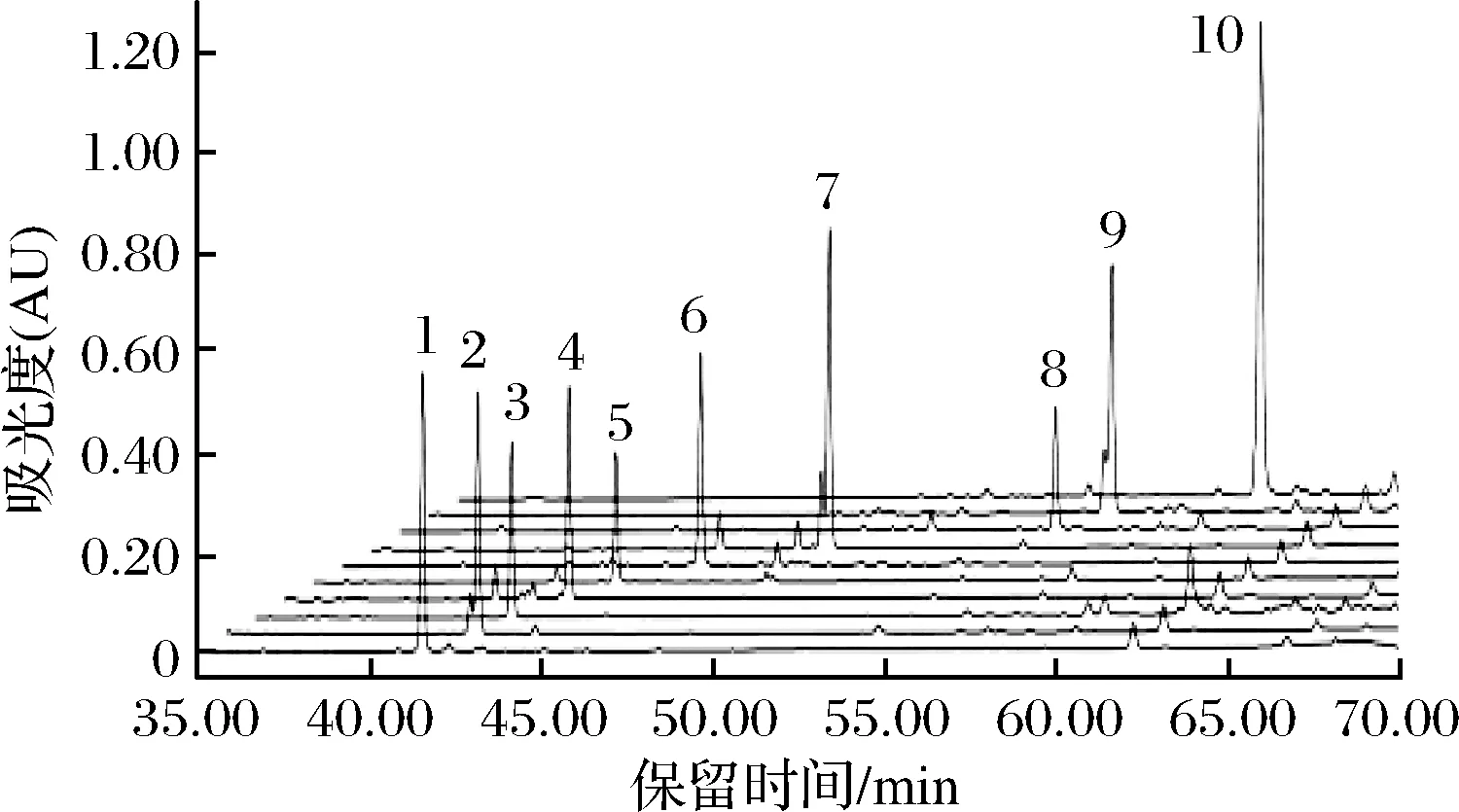
1-人參皂苷Rb1;2-人參皂苷Fc;3-人參皂苷Rc;4-人參皂苷Rb3;5-人參皂苷R7;6-人參皂苷Rd;7-人參皂苷C-Mx1;8-人參皂苷C-Mc;9-人參皂苷C-Mx;10-人參皂苷C-K圖1 人參皂苷對照品的HPLC圖譜Fig.1 The HPLC of ginsenoside standards
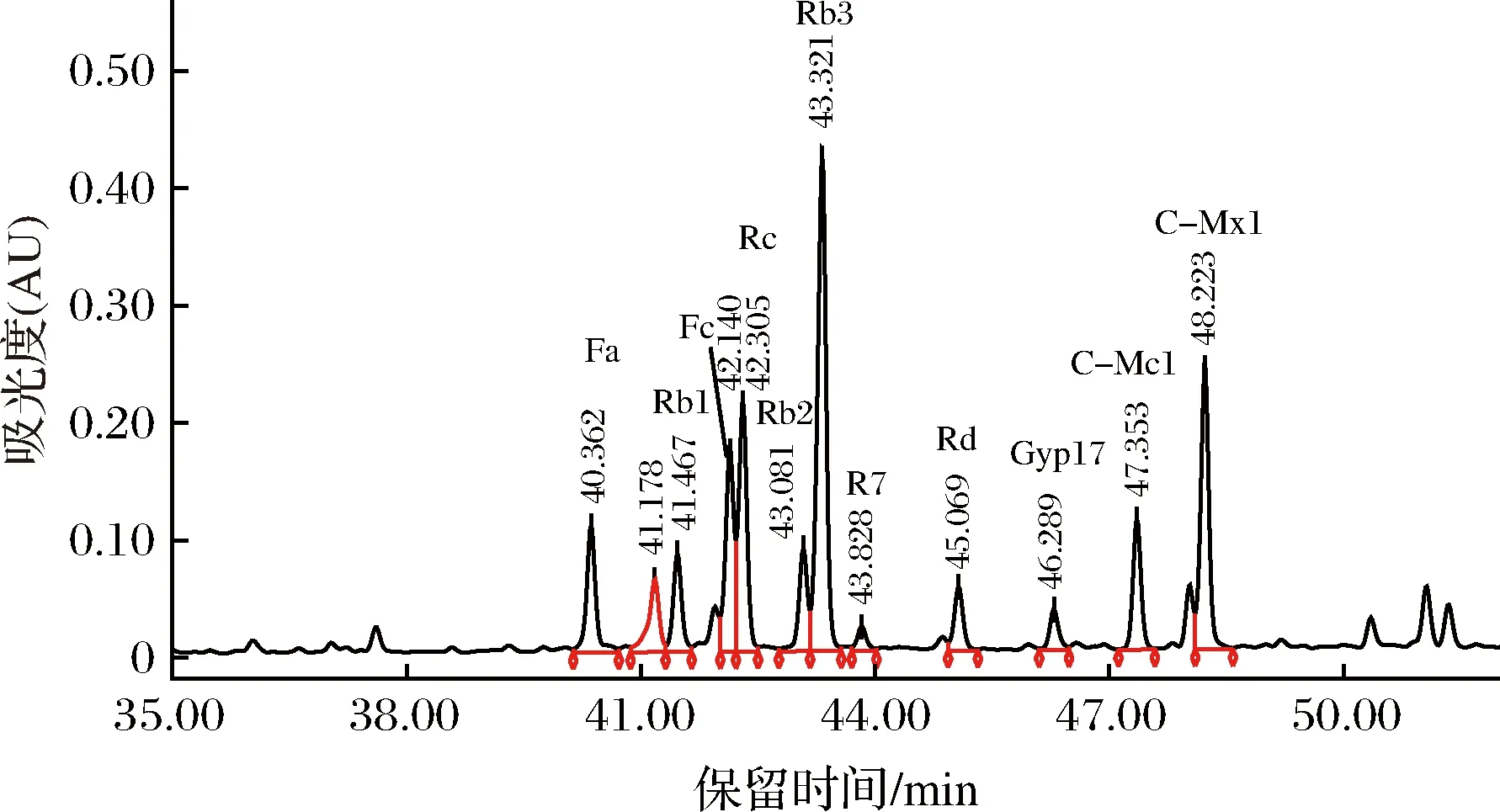
圖2 市銷三七莖葉總皂苷的HPLC圖譜Fig.2 The HPLC of notoginseng stem-leaf ginsenosides
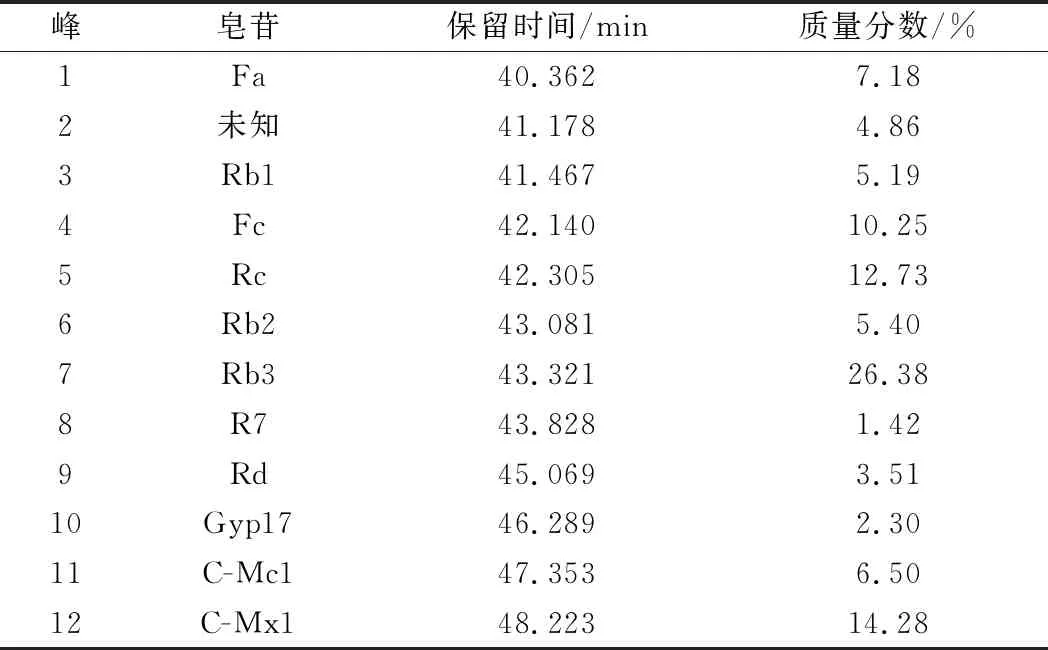
表1 三七莖葉總皂苷中各組分的含量Table 1 Contents of each component in total saponins of Panax notoginseng
由圖2和圖1比對可知,市銷的三七莖葉總皂苷中含有皂苷:Fa、Rb1、Fc、Rc、Rb2、Rb3、R7、Rd、Gyp17、C-Mc1和C-Mx1共11種。把HPLC圖中各皂苷的峰面積比近似認為各皂苷的含量比[20],則各皂苷的質量分數為Fa 7.18%、Rb1 5.19%、Fc 10.25%、Rc 12.73%、Rb3 26.38%、R7 1.42%、Rd 3.51%、Gyp 17 2.30%、C-Mc1 6.50%、C-Mx1 14.28%,即在三七莖葉總皂苷中含量最高的是Rb3,其次是C-Mx1。
2.2 三七莖葉總皂苷的酶轉化反應
取A.nigersp.G4菌、A.nigersp.G8菌和A.oryzaesp.G9菌所產酶以及它們兩者的等體積混合液各0.1 mL,分別與0.1 mL 50 g/L三七莖葉總皂苷溶液混合,在pH 5.0、45℃下反應24 h;加0.2 mL水飽和正丁醇,混合均勻后離心,上清液采用TLC法進行定性分析,結果如圖3所示。
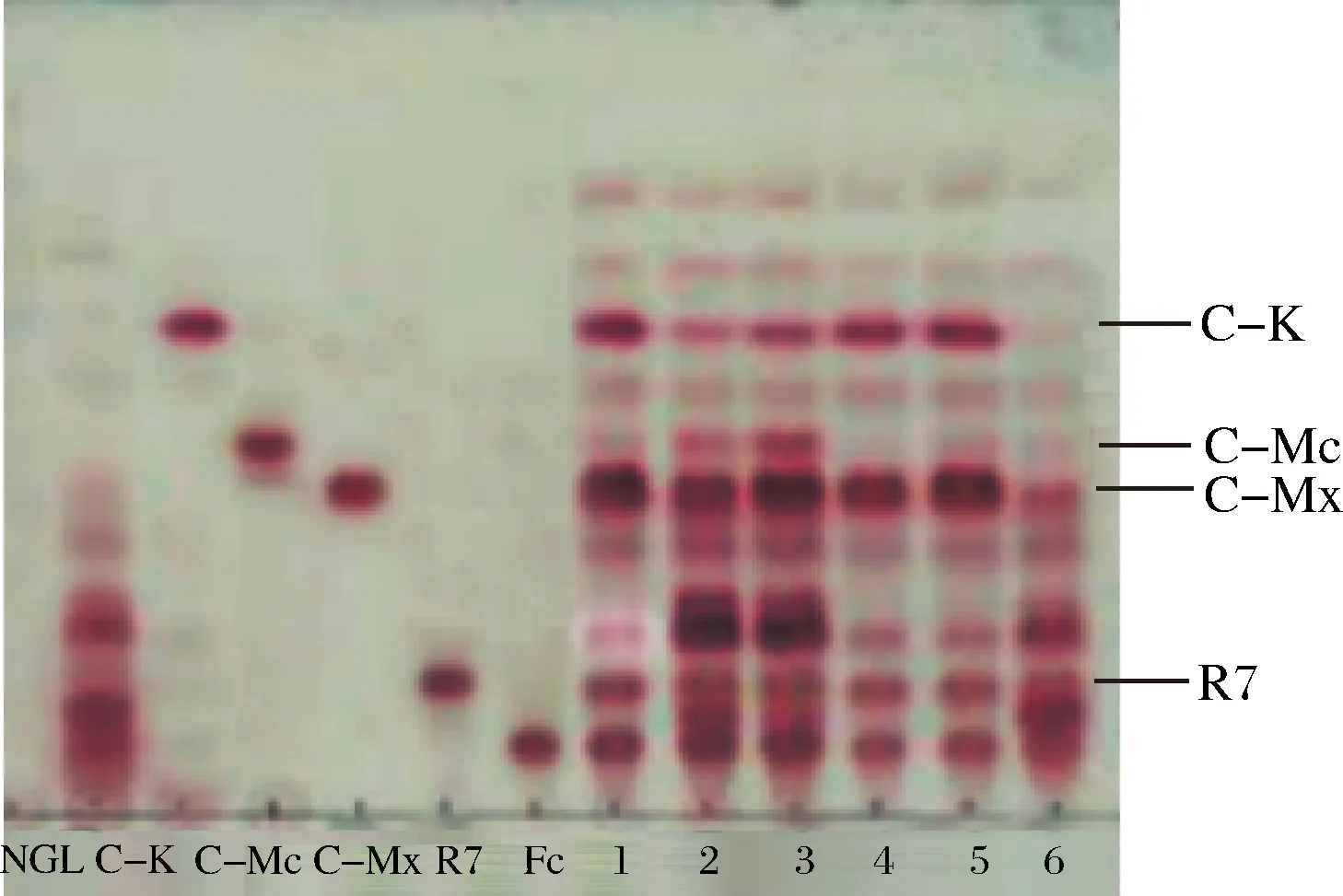
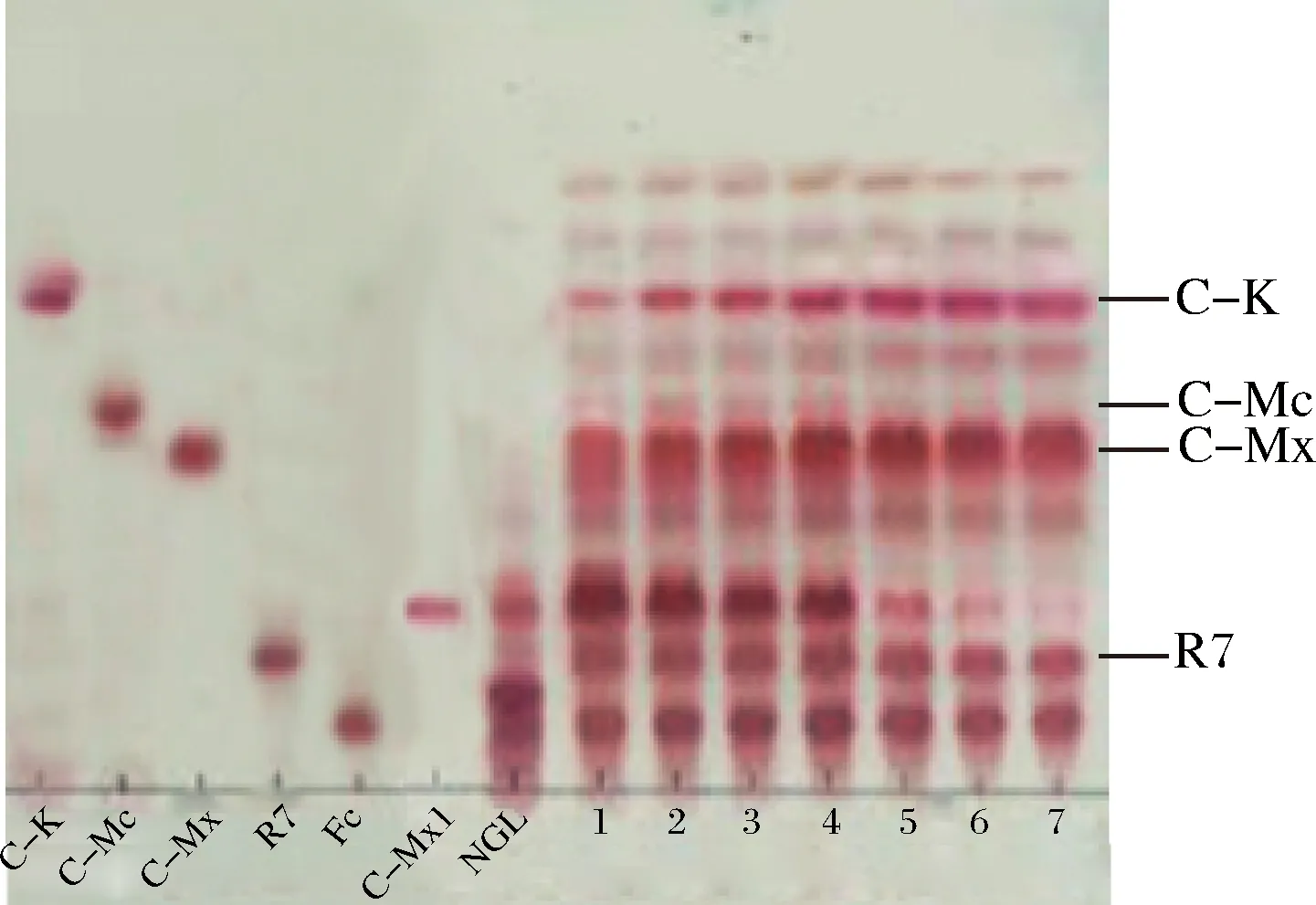
NGL-三七莖葉總皂苷;C-K、C-Mc、C-Mx、R7、Fc-人參皂苷對照品;1-A. niger sp.G4菌所產酶和A. niger sp.G8菌所產酶的等體積混合酶液;2-A. niger sp.G4菌所產酶和A. oryzae sp.G9菌所產酶的等體積混合酶液;3-A. niger sp.G8菌所產酶和A. oryzae sp.G9菌所產酶的等體積混合酶液;4-A. niger sp.G4菌所產酶;5-A. niger sp.G8菌所產酶;6-A. oryzae sp.G9菌所產酶圖3 酶轉化三七莖葉總皂苷的TLC圖Fig.3 Enzyme on notoginseng stem-leaf in TLC
由圖3可知,A.nigersp.G8菌所產酶和A.nigersp.G4菌所產酶的等體積混合酶液轉化三七莖葉總皂苷生成C-K的效果最好,其次為A.nigersp.G8菌所產酶;而A.nigersp.G8菌所產酶和A.oryzaesp.G9菌所產酶的等體積混合酶、A.nigersp.G4菌所產酶和A.oryzaesp.G9菌所產酶的等體積混合酶、A.oryzaesp.G9菌所產酶、A.nigersp.G4菌所產酶對三七莖葉總皂苷的轉化效果差。因此本文采用了A.nigersp.G8菌所產酶和A.nigersp.G4菌所產酶的等體積混合酶(以下簡稱G8-G4混合酶),以及A.nigersp.G8菌所產酶轉化三七莖葉總皂苷制備稀有皂苷C-K。
2.3A. niger sp.G8菌所產酶和G8-G4混合酶的最佳酶反應條件
2.3.1 反應時間的優化
G8-G4混合酶與三七莖葉總皂苷溶液等體積混合,在底物質量濃度25 g/L,pH 5.0,45 ℃下反應3、6、9、12、24、36、48 h,反應結束后,分別取樣0.2 mL,與0.2 mL水飽和正丁醇混合,混合均勻后離心,取正丁醇層用TLC法進行定性檢測,并采用HPLC法進行定量分析,TLC結果如圖4所示。
NGL-三七莖葉總皂苷;C-K、C-Mc、C-Mx、R7、Fc、C-Mx1-人參皂苷對照品;1、2、3、4、5、6、7-3、6、9、12、24、36、48 h圖4 不同時間對G8-G4混合酶轉化三七莖葉總皂苷的影響Fig.4 Reaction time effect on the hydrolysis of notoginseng stem-leaf ginsenosides by enzyme mixture of A. niger sp.G8 and A. niger sp.G4 strains
由圖4可知,G8-G4混合酶與三七莖葉總皂苷的反應,隨時間的延長C-K產率越來越高,當反應進行到24 h,C-K產率達到28.6%(質量分數)。同理,A.nigersp.G8菌所產酶的反應時間優化表明,反應24 h,C-K產率最高,為22.4%(質量分數)。
2.3.2 酶反應溫度和pH的優化
G8-G4混合酶液與三七莖葉總皂苷溶液等體積混合,反應溫度分別設在35、40、45、50、55、60 ℃,底物質量濃度25 g/L,pH 5.0,反應24 h。結果如圖5所示。G8-G4混合酶與三七莖葉總皂苷溶液等體積混合,反應pH值設為3.0、4.0、5.0、6.0、7.0,底物質量濃度為25 g/L,45 ℃反應24 h。結果如圖6所示。
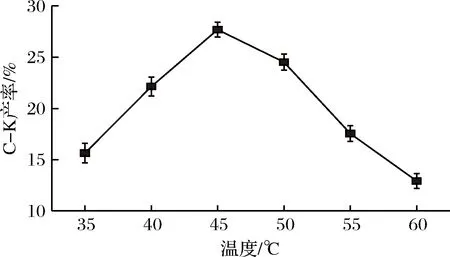
圖5 溫度對酶反應生成C-K的影響Fig.5 The effects of temperature on enzyme reaction to C-K

圖6 pH對酶反應生成C-K的影響Fig.6 the effects of pH on enzyme reaction to C-K
由圖5可知,G8-G4混合酶與三七莖葉總皂苷在45℃條件下反應后,C-K的產率最高,達27.68%(質量分數),由圖6可知,在pH 5.0條件下,G8-G4混合酶轉化三七莖葉總皂苷的C-K產率最高,為21.56%(質量分數)。故G8-G4混合酶轉化三七莖葉總皂苷的最佳反應條件為pH 5.0,45℃,底物質量濃度25 g/L,反應24 h。
A.nigersp.G8菌所產酶與三七莖葉總皂苷溶液等體積混合,反應溫度分別設在:35、40、45、50、55、60℃,底物質量濃度25 g/L,pH 5.0,反應24 h。結果如圖7所示。A.nigersp.G8菌所產酶與三七莖葉總皂苷溶液等體積混合,反應pH設為3.0、4.0、5.0、6.0、7.0,45℃,底物質量濃度25 g/L,反應24 h。結果如圖8所示。
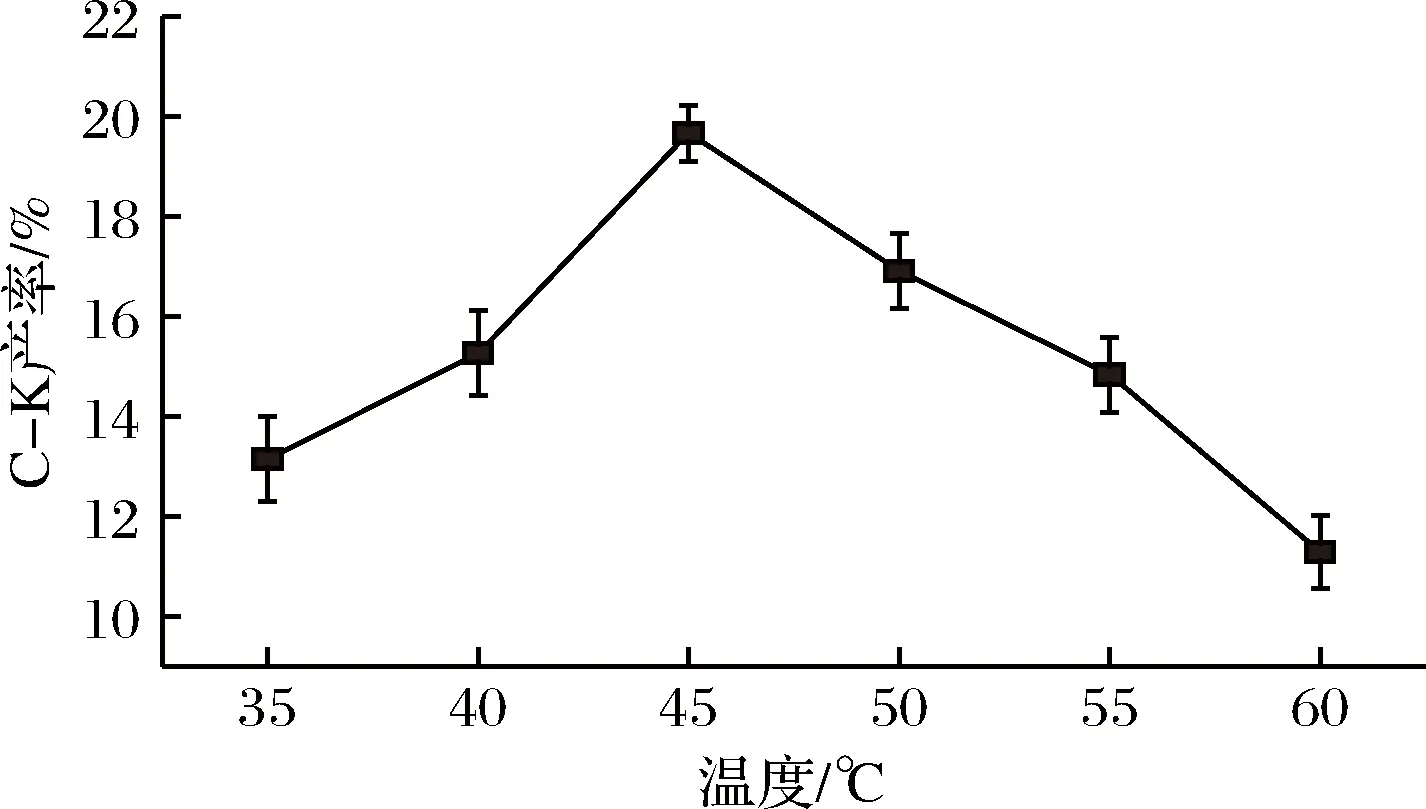
圖7 溫度對酶反應生成C-K的影響Fig.7 The effects of temperature on enzyme reaction to C-K
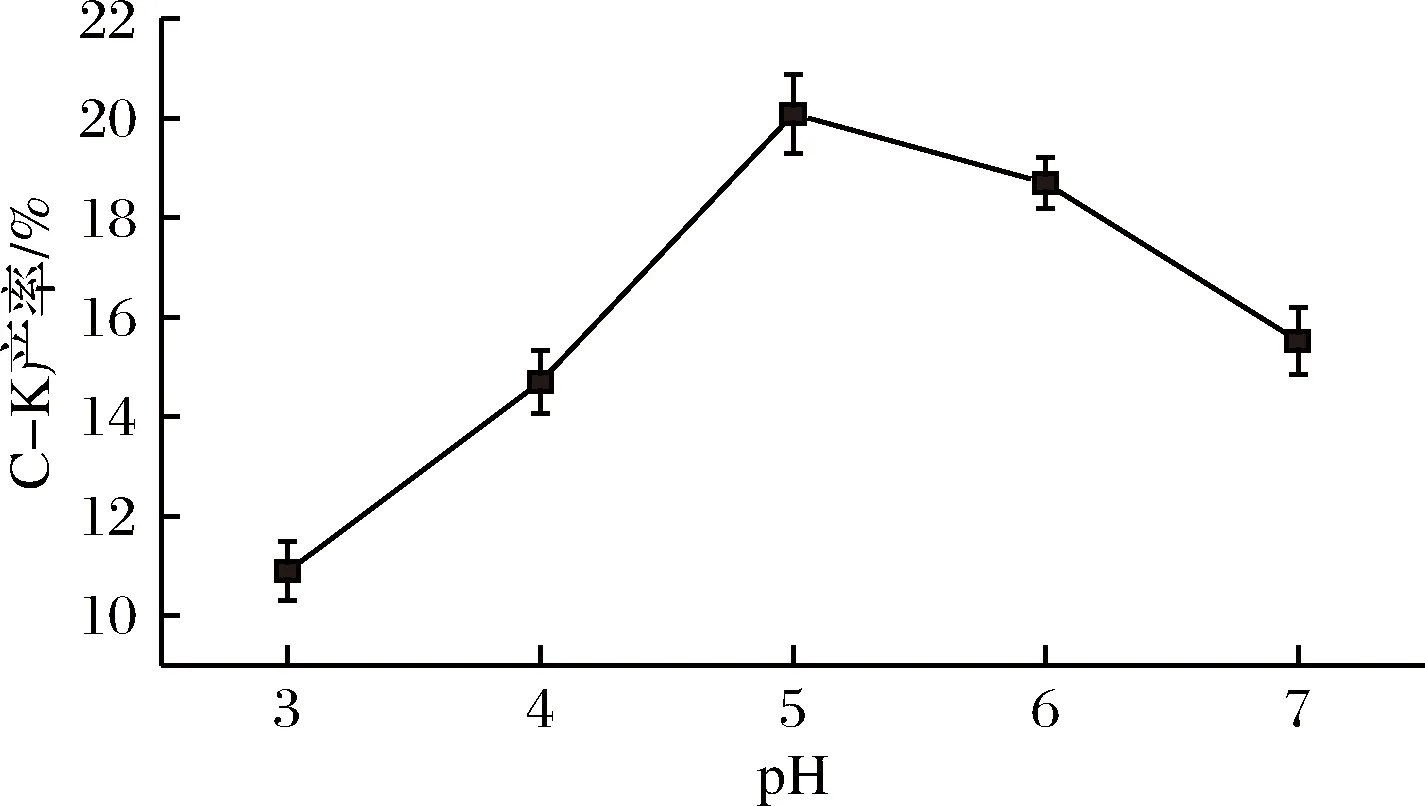
圖8 pH對酶反應生成C-K的影響Fig.8 the effects of pH on enzyme reaction to C-K
由圖7可知,A.nigersp.G8菌所產酶與三七莖葉總皂苷在45℃反應后,C-K的產率最高,達19.67%;由圖8可知,A.nigersp.G8菌所產酶轉化三七莖葉總皂苷的pH為5.0時,C-K產率最高,為20.08%。故A.nigersp.G8菌所產酶轉化三七莖葉總皂苷的最佳反應條件為pH 5.0,45℃,底物質量濃度25 g/L,反應24 h。
2.3.3 酶轉化產物的HPLC檢測
用HPLC法檢測三七莖葉總皂苷經G8-G4混合酶和A.nigersp.G8菌所產酶轉化后的產物,如圖9及表2所示。
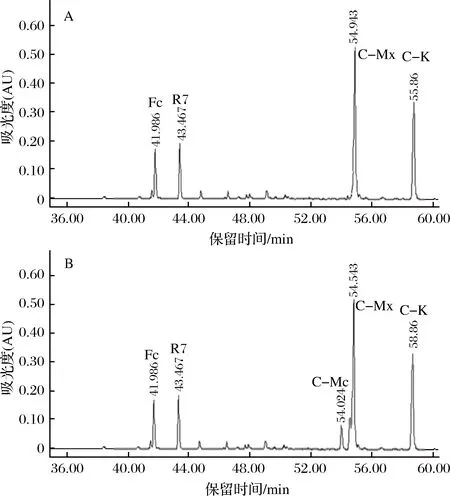
A-G8-G4混合酶轉化三七莖葉總皂苷的產物;B-A. niger sp.G8菌所產酶轉化三七莖葉總皂苷的產物圖9 G8-G4混合酶和A. niger sp.G8菌所產酶轉化三七莖葉總皂苷的HPLC圖Fig.9 Enzyme from G8-G4 enzyme mixture and G8 strains hydrolysis on notoginseng stem-leaf ginsenoside in HPLC注:反應時間為24 h。
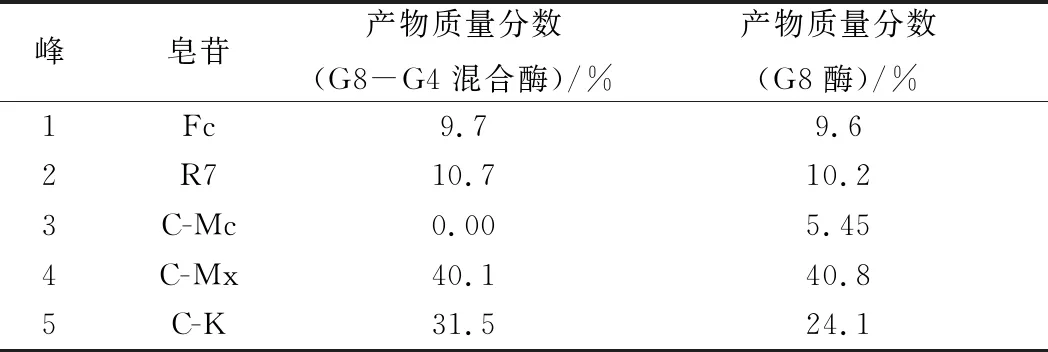
表2 G8-G4混合酶、A. niger sp.G8菌所產酶轉化三七莖葉總皂苷的產物皂苷比較Table 2 Products from notoginseng stem-leaf ginsenosides by the G8-G4 enzyme mixture, A. niger sp.G8 enzyme
由圖9和表2可知,A.nigersp.G8菌所產酶轉化三七莖葉總皂苷的產物有5種:C-K、C-Mx、Fc、R7、C-Mc;而G8-G4混合酶轉化三七莖葉總皂苷的產物有4種:C-K、C-Mx、Fc、R7。
分析得知,三七莖葉總皂苷中的部分皂苷經酶催化降解3-O-或20-O-糖基主要生成C-K、C-Mx、R7、C-Mc,其結構如圖10中所示。初步推斷酶催化降解底物皂苷生成產物的對應情況如下:
Rb1、Rd、Gyp17→降解3-O-和20-O-葡萄糖基→生成C-K;Rc和C-Mc1→降解3-O-葡萄糖基→生成C-Mc和C-K;Rb3和C-Mx1→降解3-O-葡萄糖基→生成C-Mx;Fa→降解20-O-葡萄糖基→生成R7。
G8-G4混合酶液轉化三七莖葉總皂苷的C-K轉化得率,相比A.nigersp.G8菌所產酶有所提高,這可能是C-Mc的20-O-阿拉伯糖基繼續被酶降解轉化生成C-K的緣故,圖9-A中沒有檢測到C-Mc,也能說明此結果。而G8-G4混合酶液和A.nigersp.G8菌所產酶,均不能水解C-Mx的20-O-末端木糖基,也不能水解R7和Fc的3-O-末端木糖基,因此上述2種酶液的催化反應產物中均有Fc的殘留。
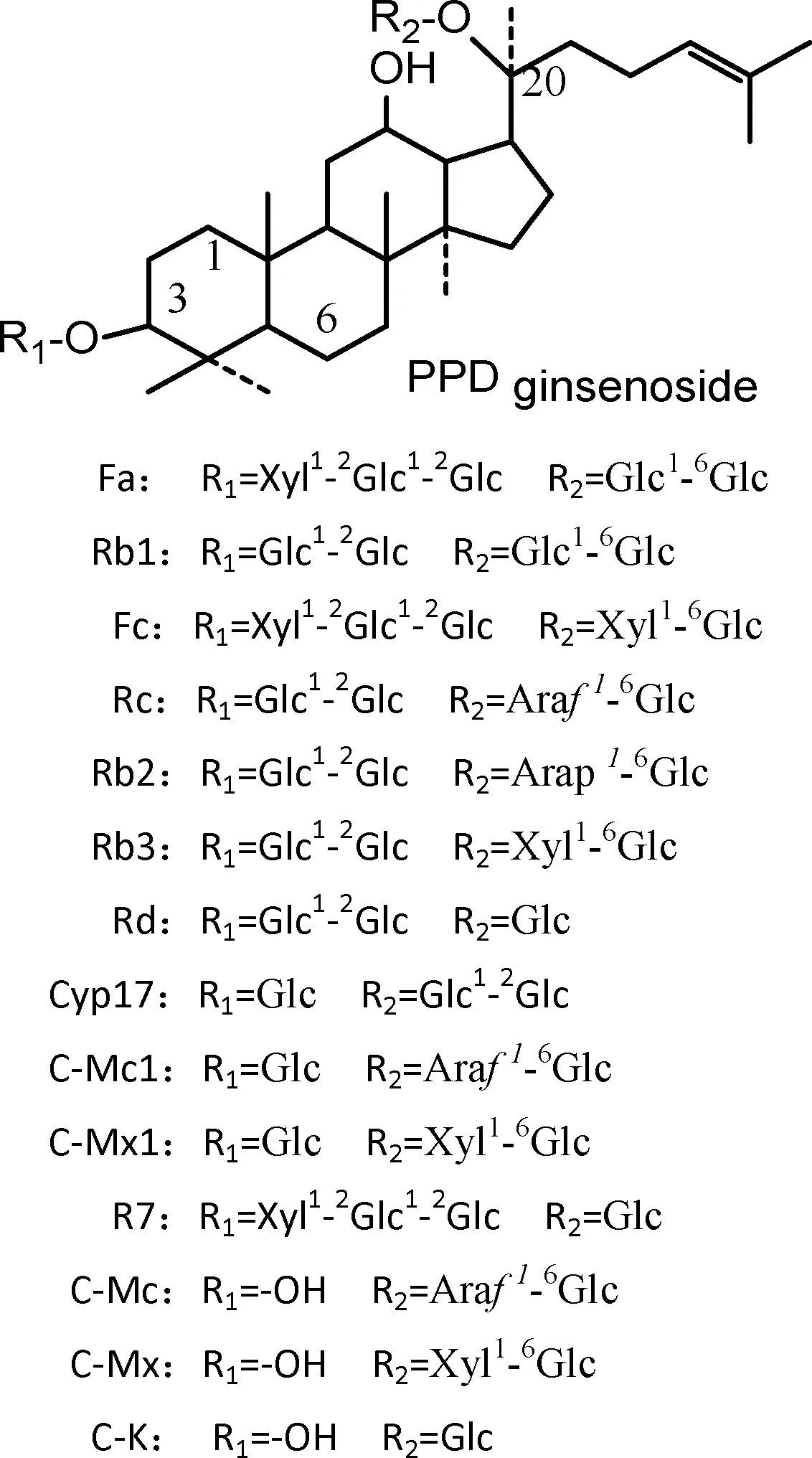
圖10 圖2 HPLC中三七莖葉總皂苷的結構式Fig.10 Structure of notoginseng leaf ginsenosides of figure 2 HPLC
2.4 三七莖葉總皂苷酶轉化產物C-K等的制備
綜上結果可知G8-G4混合酶液轉化三七莖葉總皂苷的C-K得率相比A.nigersp.G8菌所產酶有所提高。其結果由如下制備生產來驗證。
將50.0 g三七莖葉總皂苷溶于1 000 mL的20 mmol/L pH 5.0 醋酸-醋酸鈉緩沖液中,分別與等體積G8-G4混合酶或等體積A.nigersp.G8菌所產酶液混合,置于生化反應器中,在45℃下攪拌反應24 h。反應結束后,分別加入3倍體積的95%(體積分數)乙醇沉淀酶,其上清濃縮后,經AB-8脫糖、D-280脫色、濃縮干燥,得到酶反應產物混合皂苷。50.0 g三七莖葉總皂苷經G8-G4混合酶反應后,得到產物33.1 g,得率為66.2%,其中C-K為32.7%;50 g三七莖葉總皂苷經A.nigersp.G8菌所產酶反應后,得到產物34.9 g,得率為69.8%,其中C-K為24.6%。
3 結論
市銷的三七莖葉總皂苷中,主要為人參二醇類皂苷,其組成成分和含量(質量分數)如下:Rb3 26.38%,C-Mx1 14.28%,Rc 12.73%,Fc 10.25%,還含有Rb1、Rb2、Rd、Gyp17、R7、C-Mc1等皂苷。
G8-G4混合酶和A.nigersp.G8菌所產酶轉化三七莖葉總皂苷的最佳反應條件為45 ℃,pH 5.0,底物質量濃度25 g/L、反應24 h。
A.nigersp.G8菌所產酶轉化三七莖葉總皂苷的產物有5種:C-K、C-Mx、Fc、R7、C-Mc;而G8-G4混合酶液轉化三七莖葉總皂苷的產物有4種:C-K、C-Mx、Fc、R7;且G8-G4混合酶液轉化三七莖葉總皂苷的C-K產率比A.nigersp.G8菌所產酶高,推斷是C-Mc被繼續降解轉化生成C-K所致。
三七莖葉總皂苷和酶轉化產物的分析結果表明,三七莖葉總皂苷中Rb1、Rd、Gyp17、Rc、 Rb3、C-Mc1、 C-Mx1和Fa的3-O-和20-O-葡萄糖基或阿拉伯糖基被酶水解,產物中約含24%~30%(質量分數)的C-K。而Fc的3-O-和20-O-末端木糖基無法被酶降解,在酶轉化產物中有所殘留。今后,還需進一步開發能夠降解C-Mx、Rb3、R7、Fa、Fc的3-O-和20-O-末端木糖基的酶,以提高酶轉化產物中C-K的含量。

