姜黃素調控Nrf2信號通路改善運動性腎損傷大鼠腎臟細胞外基質沉積的機制研究
牛衍龍,曹建民,王 禎,周海濤,胡 戈,郭 嫻,魏江山,邵芙蓉
1贛南醫學院,贛州 341000;2北京體育大學運動人體科學學院,北京 100084;3北京聯合大學生物化學工程學院,北京 100023;4北京聯合大學 生物活性物質與功能食品北京市重點實驗室,北京 100191;5長治醫學院 長治 046000
腎臟細胞外基質(extracellular matrix,ECM)主要由不同類型的膠原蛋白、糖蛋白、蛋白多糖、彈性蛋白等成分組成,是細胞生理活動的外環境,在細胞間起機械支撐作用和連接作用,是細胞間信號轉導的橋梁。在腎臟發育及生理、病理過程中,ECM(成分表達量、組成成分、排列結構)常發生顯著改變,直接參與組織形態重構,還可通過信號轉導機制,影響腎臟病理/生理活動進程。研究表明,病理(糖尿病等)/生理應激(大強度運動等)可引發腎臟炎癥因子過度表達并促進腎臟固有細胞增殖,黏附因子表達增加,ECM生成過多,進而破壞腎臟ECM代謝的動態平衡,對腎臟結構和功能造成損傷[1,2]。核轉錄因子NF-κB是炎癥級聯反應的重要調控因素。而Nrf2通路與NF-κB通路可以相互作用,Soares等[3]驗證了受Nrf2調控的HO- 1是Nrf2信號通路與NF-κB信號通路之間相互作用的樞紐,激活Nrf2通路可以上調HO- 1的表達,進而抑制NF-κB的活化與核異位,從而減輕機體的炎癥反應。姜黃素是天然中草藥(姜科、天南星植物根莖)提取的酚類黃色素,具有抗氧化、抑炎及免疫調節等作用[4]。團隊前期研究表明[5,6],姜黃素不僅可以通過調控Nrf2信號通路,有效緩解過度訓練引發的氧化應激,抑制大鼠腎臟細胞凋亡,還能抑制NF-κB活化,降低TNF-α等炎癥因子的分泌,進而保護腎臟組織結構和功能的正常。本研究采用團隊前期研究成熟的過度訓練致大鼠腎臟損傷模型,選用姜黃素為干預物,探究其發揮級聯效應通過調控Nrf2信號通路,抑制NF-κB的活化與核異位,緩解炎癥因子的過度表達,進而抑制和改善運動性腎損傷大鼠腎臟ECM過度沉積的作用機制。
1 材料與儀器
1.1 實驗動物
實驗選用雄性SPF級大鼠44只(7 周齡),體重213.50±10.13 g,由北京大學醫學部實驗動物科學部提供,合格證編號:SCXK(京)2016- 0010。標準實驗動物飼養環境下喂養:溫度20~24 ℃,相對濕度50%~70%,晝夜明暗交替各12 h,以中華人民解放軍軍事醫學科學院實驗動物中心提供的基礎飼料和動物飲用蒸餾水常規飼養(不限制飲食量)。實驗周期46天,遞增負荷訓練42天。
1.2 試驗用藥及主要試劑
姜黃素(純度>99%,陜西源泰生物科技公司購得,產品批號:17012571),用0.5%羥甲基纖維素鈉配成懸濁液,置于4 ℃冰箱備用。
Jaffe苦味酸法測定血清肌酐(SCr,生產批號:20180514);二乙酰- 肟法測定血清尿素氮(BUN,生產批號:20180515);放射免疫法測定血清睪酮、皮質酮(T、Cor,生產批號分別是:20180518、20180519);免疫組化法檢測Nrf2、血紅素氧合酶(HO- 1)的表達和分布情況(抗體批號:ab137550、ab13248);Western- blot法測定NF-κB蛋白表達量(抗體批號:SAB4502610),內參選用GAPDH鼠單克隆抗體(抗體批號:D16H11);Elisa法測定血清和腎臟內TGF-β1含量(試劑盒批號:ab119558)。以上試劑盒和抗體依次由北京華英生物技術研究所、武漢谷歌生物科技有限公司、abcam公司提供。
1.3 主要儀器
動物跑臺(杭州段式),Tecnai Spirit電子顯微鏡(美國680FEI公司),Nikon 50i光學顯微鏡(日本Nikon公司),酶標儀(美國BIO- RAD公司),r- 911全自動放免計數儀(中國科技大學實業總公司),Pannoramic MIDI 全自動數字切片掃描系統(匈牙利3D HISTECH 公司),CM- 2000B生物醫學圖像分析系統(北京航空航天大學),凝膠成像系統(美國BIO- RAD公司)。
2 實驗方法
2.1 動物分組
44只大鼠經4 天適應性飼養后,以數字隨機分組法分為3組:對照組(C組,12只),過度訓練組(OL組,16只)和姜黃素+過度訓練組(COL組,16只)。
2.2 實驗方案
2.2.1 訓練及干預方案[6,7]
C組常規飼養,不進行運動與灌胃干預。OL和COL組進行為期6周的遞增負荷跑臺訓練,跑臺坡度為10°,每周訓練6天,具體方案如下圖所示。訓練期間COL組于每天訓練前1 h灌胃200 mg/kg/d、5 mL/kg姜黃素1次,其他組灌胃等體積0.5%羧甲基纖維素納。

圖1 大鼠跑臺訓練方案Fig.1 Treadmill training program of rat注:從第2周開始,每次訓練初始速度為10 m/min,每5 min增加5 m/min,直至本周目標強度。最后一周訓練,大鼠若無法維持目標強度,則運動至力竭。Note:10 m/min as initial velocity.Training starts from 10 m/min and increases by 5 m/min every 5 min until the target speed of this week starting from the second week.During the last week of training,if the rats could not maintain the target speed,they would exercise to exhaustion.
2.2.2 實驗樣品采集
訓練期間受訓練強度、訓練時間、恢復時間等因素影響,進行運動干預的大鼠出現意外死亡,OL組剩余13只,COL組剩余15只。
6 周末訓練結束后24 h,各組大鼠采用戊巴比妥鈉(濃度為2%)腹腔注射麻醉,腹主動脈取血,并4 ℃、3 000 rpm離心10 min分離制備血清后放入- 20 ℃冰箱中保存待測。分離左側腎臟剔除筋膜后切取約1 mm×1 mm×1 mm腎皮質,迅速放于2.5%戊二醛固定液常溫固定4 h后4 ℃保存,剩余左側腎臟浸入組織固定液(4%多聚甲醛),固定24 h。分離右側腎臟剔除筋膜后置于預冷的生理鹽水中洗凈血污,分成4塊用錫紙包裹后后迅速投入液氮暫存,隨后保存于- 80 ℃冰箱凍存待測。
STM32有USART_CR1~3三個串口控制寄存器,USART_CR1是最常用的,其中RXNEIE為接受緩沖區非空中斷使能.系統采用串口中斷法進行串口通信.首先在程序中啟用USART中斷功能,當數據接收完之后,USART_CR1寄存器中的RXNEIE置為‘1’,然后產生中斷,可以在中斷函數中將數據讀出,然后清除中斷標志.串口中斷法的優點在于擺脫了對CPU的實時依賴,當數據接收完畢之后,自動進入中斷函數,然后CPU去執行數據處理,通過中斷法,大大提高了CPU的執行速率.同時串口中斷法大大降低了CPU的占用率,各個串口按照中斷優先級協調工作,數據有條不紊地進行接收處理顯示.
2.2.3 腎臟病理學和超微結構觀察
取出固定在多聚甲醛中的腎臟組織,分別進行沖洗、脫水、透明、滲透、包埋、切片、HE染色。光鏡下低倍鏡隨機選取腎小球位置,然后切換至400倍鏡下進行拍照,觀察視野中所包含腎小球的內部組織結構。
取出固定在戊二醛中的腎臟組織塊,依次進行沖洗、鋨酸固定、鈾染、脫水、滲透、高溫聚合、修塊等操作,最終切片機制成1 μm切片并撈至銅網中。透射電鏡(TEM)觀察腎臟超微結構。
2.2.4 腎組織PAS染色切片圖像分析
腎臟石蠟切片脫蠟脫水,依次進行固定液固定,1%過碘酸水溶液染色,Schiff試劑染色,滴加0.5%亞硫酸氫鈉,蘇木精復染細胞核,水洗,脫水,透明,封片。最終結果為,PAS陽性表達,呈紅色顆粒狀或彌散狀。紅色的深度與所含糖原的量呈正相關。腎臟組織的染色分布為:腎小球的基底膜、囊壁層以及細胞外基質將會被染成紅色,而細胞核經蘇木精復染后將呈現藍黑色。
400倍光鏡下,使用北航圖像采集模塊軟件,采集視野要求:視野中的腎小球必須同時包含尿極和血管極;采用北航醫學病理圖象分析軟件,描繪出腎小球毛細血管袢輪廓,將胞外基質和細胞成分區分開來,測量單一腎小球及其基質的面積。
2.2.5 免疫組化分析抗氧化通路因子
免疫組化法檢測Nrf2和HO- 1蛋白的表達情況。腎臟石蠟切片進行脫蠟脫水、抗原修復、阻斷內源性過氧化物酶、一抗和二抗孵育、DAB顯色、復染細胞核、封片。顯微鏡400倍鏡下觀察:細胞核呈藍色,而DAB顯出的陽性表達則為棕黃色,隨機選取視野,拍照后采集圖像,分析并計算組織化學評分(H- SCORE),H- SCORE = ∑(PI × i)=(percentage of cells of weak intensity × 1)+(percentage of cells of moderate intensity × 2)+(percentage of cells of strong intensity × 3),其中PI表示陽性細胞數與所有細胞數的百分比;i代表著色強度[8]。
2.2.6 蛋白印跡法分析炎癥調控因子
取出- 80 ℃冰箱中腎臟組織塊,研磨制備定量蛋白溶液,并依次進行上樣、電泳、轉膜、封閉、一抗和二抗孵育、曝光等,凝膠成像后用Image- Lab軟件進行分析。
2.3 數據統計與分析
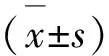
3 結果
3.1 大鼠腎臟組織形態學及超微結構變化
光鏡下觀察大鼠腎皮質腎單位的組織學形態,具體變化如下圖。
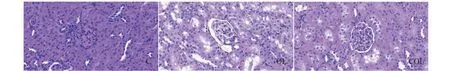
圖2 大鼠腎組織形態學變化(HE × 400)Fig.2 Pathological changes in renal tissue of rats (HE × 400)
C組腎小球內結構緊湊有致,未出現淤血,血管球與囊腔壁界限明顯,血管內紅細胞分布規律;OL組腎小球出現明顯腫脹、淤血,內部間隙變窄,部分血管球與囊腔壁界限不清,系膜區增大,毛細血管管腔擴張,血紅細胞有不規則堆積現象;COL組腎小球略顯腫脹,界限不清等情況減輕,系膜區、毛細血管等形態學異常仍然存在。
透射電鏡下觀察大鼠腎小球內部超微結構,每張銅網切片視野下包含基底膜、足細胞及間質細胞,具體變化如下圖。
C組:腎小球濾過屏障內皮層結構清晰,基底膜厚度均勻,足細胞結構完整,足突分布均勻,間質細胞完整清晰;OL組:腎小球內血管結構擴張,基底膜厚度不均,足細胞體結構殘缺,部分足突融合,間質細胞分散且雜亂;COL組:腎小球內皮層部分異常,少量足突融合,間質細胞收縮。
3.2 大鼠腎組織PAS染色結果
光鏡(400 倍)下采集視野,視野中腎小球必須包含尿極和血管極,如下圖。采用北航醫學病理圖像分析軟件,描出腎小球毛細血管袢輪廓,將胞外基質和細胞成分區分開來,測量單一腎小球及其基質的面積。
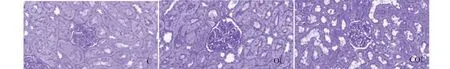
圖4 大鼠腎ECM沉積情況Fig.4 ECM deposition in glomeruli of rats (PAS × 400)
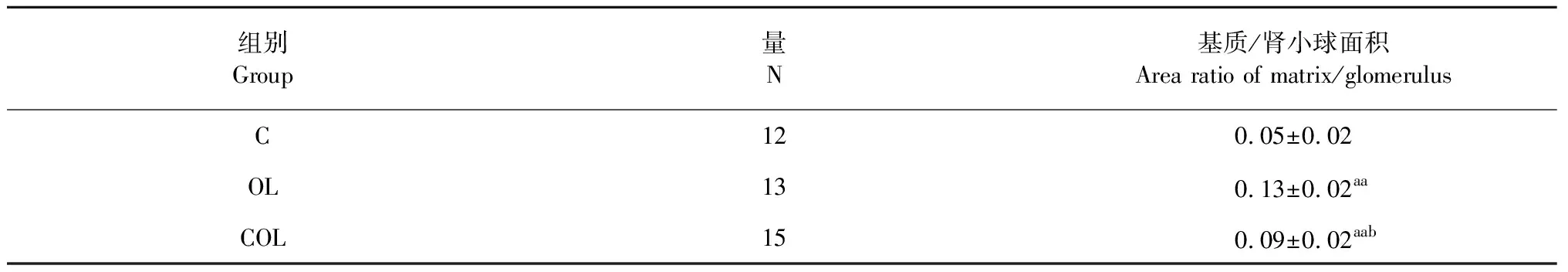
表1 各組大鼠腎組織ECM沉積情況
注:與C組比,aaP<0.05;與OL組比,bP<0.05。
Note:aaP<0.01vsgroup C;bP<0.05vsgroup OL.
圖4、表1結果可知,對比各組大鼠腎單位基質與腎小球面積的比值:OL和COL組均顯著高于C組(P<0.01);而COL組顯著低于OL組(P<0.05)。
3.3 大鼠模型確定指標檢測結果
血液生化指標是用來確定動物模型建立的,主要分為兩類:過度訓練的檢測指標:睪酮(T)和皮質酮(Cor);腎臟損傷的檢測指標:血肌酐(SCr)和尿素氮(BUN)。
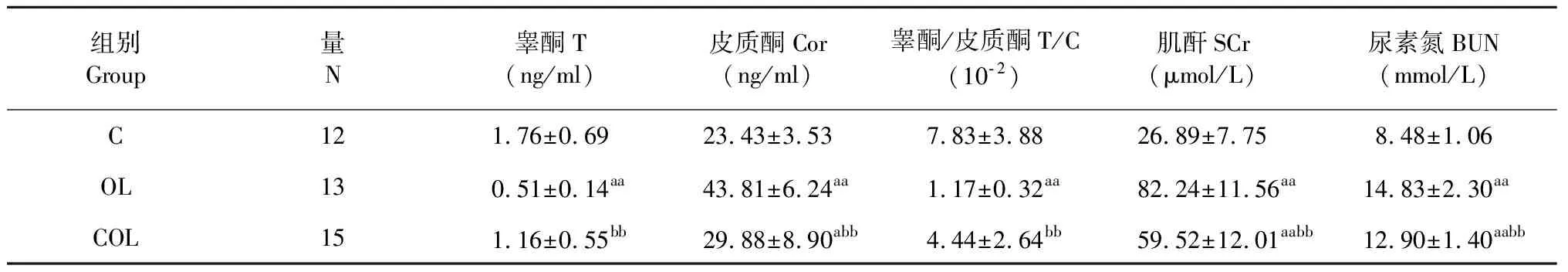
表2 各組大鼠血液模型指標
注:與C組比,aP<0.05,aaP<0.01;與OL組比,bbP<0.01。
Note:aP<0.05vsgroup C;aaP<0.01vsgroup C;bbP<0.01vsgroup OL.
表2結果可知,過度訓練的檢測指標:血清睪酮,OL組顯著低于C組(P<0.01),COL組顯著高于OL組(P<0.01),而C組和COL組無顯著性差異(P>0.05);血清皮質酮,OL組、COL組均顯著高于C組(P<0.01,P<0.05),而COL組顯著低于OL組(P<0.01);且睪酮與皮質酮比值的變化趨勢與睪酮變化一致。腎臟損傷的檢測指標:血清肌酐與尿素氮變化趨勢一致,OL組、COL組均顯著高于C組(P<0.01),而COL組顯著低于OL組(P<0.01)。
3.4 大鼠腎組織炎癥因子的含量變化
分別檢測腎臟組織內TGF-β1、TNF-α、IL- 1β的含量,具體數值如下表。

表3 各組大鼠腎組織內炎癥因子含量
注:與C組比,aP<0.05,aaP<0.01;與OL組比,bbP<0.01。
Note:aP<0.05vsgroup C;aaP<0.01vsgroup C;bbP<0.01vsgroup OL.
表3結果可知,腎臟組織TGF-β1含量,OL組、COL組均顯著高于C組(P<0.01),而COL組顯著低于OL組(P<0.01);TNF-α:OL組、COL組均顯著高于C組(P<0.01,P<0.05),而COL組顯著低于OL組(P<0.01);IL- 1β:OL組、COL組均顯著高于C組(P<0.01),而COL組與OL組無顯著性差異(P>0.05)。
3.5 大鼠腎臟組織通路蛋白表達結果
光鏡(400倍)下觀察腎組織切片,如下圖,并計算組織化學評分(H- SCORE)。
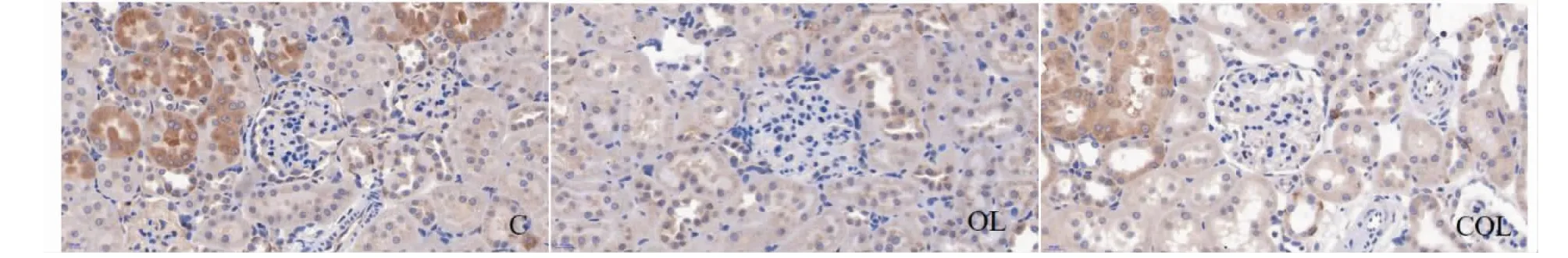
圖5 大鼠腎組織Nrf2的表達Fig.5 The expressions of Nrf2 in renal tissue of rats
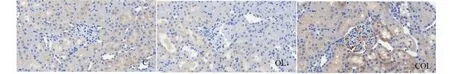
圖6 大鼠腎組織HO- 1的表達Fig.6 The expressions of HO- 1 in renal tissue of rats
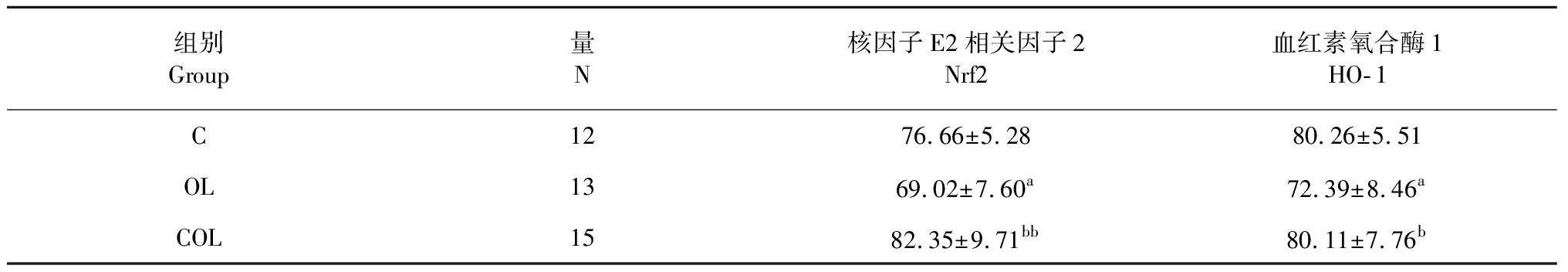
表4 各組大鼠腎臟Nrf2、HO- 1的表達
注:與C組比,aP<0.05;與OL組比,bP<0.01,bbP<0.01。
Note:aP<0.05vsgroup C;bP<0.05vsgroup OL;bbP<0.01vsgroup OL.
圖5、圖6及表4結果可知,腎臟組織Nrf2和HO- 1蛋白主要分布腎小管,而腎小球內表達相對較少,而且這兩種蛋白的表達量變化趨勢一致,OL組顯著低于C組(P<0.05),COL組顯著高于OL組(P<0.01,P<0.05),而COL組與C組無顯著差異(P>0.05)。
選用- 80 ℃凍存的腎臟組織研磨后,進行蛋白定量后的Western- blot檢測NF-κB的蛋白表達量,具體結果如下圖。

圖7 大鼠腎組織NF- κB的表達Fig.7 The expressions of NF- κB in renal tissue of rats注:與C組比,aP<0.05,aaP<0.01;與OL組比,bP<0.01。Note:aP<0.05 vs group C;aaP<0.01 vs group C;bP<0.05 vs group OL.
由圖7可知,腎臟組織NF-κB的蛋白表達量,OL組和COL組均顯著高于C組(P<0.01,P<0.05),而COL組顯著低于OL組(P<0.05)。
4 討論
腎臟ECM作為腎小球及腎小管基底膜的重要組分,主要承擔機械支撐和連接作用,其對保證腎小球濾過屏障的完整性和保護腎小管上皮細胞的結構與功能具有重要作用。前期研究表明[10,11],大強度運動所致過度訓練可引發大鼠腎臟TGF-β1、TNF-α等炎癥因子的過度表達,促使腎臟固有細胞的增殖,刺激其表達粘附分子并生成過量ECM,進而打破腎臟ECM合成與分解代謝間的動態平衡。ECM合成與降解之間的動態平衡遭到破壞后,大量ECM沉積于腎小球、腎間質內,造成腎臟各級血管堵塞,分隔混亂,腎臟組織形態學和超微結構改變,腎損傷加重,腎單位喪失且功能衰竭,嚴重者出現不可逆轉的腎小球硬化。炎癥因子的TGF-β1是腎臟內調控ECM合成與分解平衡最主要的上游細胞因子,ECM沉積情況與TGF-β1的表達呈正相關[12]。TGF-β1通過以下三種途徑調控ECM沉積[13,14]:①促進ECM主要組分如膠原(Col- I、Col- III、Col- IV)、纖維連接蛋白(FN)的表達;②促進纖溶酶原激活物抑制因子(PAI)和金屬蛋白酶組織抑制因子(TIMP)等抑制ECM降解的酶類合成;③促進整合素表達進而影響ECM沉積。NF-κB是調控炎癥級聯反應的重要核轉錄調控子,抑制NF-κB蛋白表達,可以下調TGF-β1、TNF-α等炎癥因子的表達[15,16]。Nrf2是機體重要的抗氧化應激反應調節通路,激活后的Nrf2向核易位,與抗氧化反應元件(ARE)作用,進而上調HO- 1、SOD等抗氧化酶表達水平及活性,發揮抗氧化作用[17]。NF-κB通路與Nrf2通路相互作用。受Nrf2調控的HO- 1是Nrf2信號通路與NF-κB信號通路之間相互作用的樞紐,激活Nrf2通路可以上調HO- 1的表達,可以抑制IκB活化,進而降低NF-κB/IκB復合體解離程度,阻礙NF-κB的活化與向核異位,從而減輕機體的炎癥反應[18]。也有研究證實[19],高表達的HO- 1通過抑制LPS刺激導致的Toll樣受體4(TLR4)/NF-κB活化,減輕組織內的炎癥反應。
睪酮與皮質酮是反應機體內合成與分解代謝的重要指標,兩者的比值降低超過基礎水平的30%時可診斷出現過度訓練[20]。血肌酐與血尿素氮是常用的腎功能診斷指標,兩者水平升高意味著腎功能的損害[21]。本研究結果表明,過度訓練組大鼠T/Cor比值下降幅度約85%,遠超對照組均值水平7.83的30%;而過度訓練組大鼠血肌酐與血尿素氮指標顯著上升。這說明6 周的遞增負荷訓練引發大鼠出現過度訓練,同時也造成其腎臟損傷。姜黃素作為天然多酚類色素,具有極強的抗氧化及抑炎活性[4]。前期研究證實[5,6,22],姜黃素可通過以下兩種途徑改善大鼠運動性腎損傷:①激活Nrf2通路,增強腎臟抗氧化能力,防止腎臟出現過度的細胞凋亡;②抑制NF-κB通路活性,阻礙炎癥級聯反應,下調炎癥因子的表達,降低腎素- 血管緊張素系統活性。本實驗結果顯示,過度訓練組大鼠腎組織內Nrf2和HO- 1表達水平顯著降低,氧化應激水平升高,而NF-κB的蛋白表達量顯著高于對照組,腎組織內炎癥因子TGF-β1、TNF-α、IL- 1β含量均表現出高水平狀態,腎ECM沉積現象嚴重,組織形態學與超微結構異常;而姜黃素+過度訓練組大鼠Nrf2和HO- 1表達水平較過度訓練組明顯升高,恢復至接近安靜水平,而NF-κB的蛋白表達量出現明顯下調,但仍高于對照組,腎組織TGF-β1、TNF-α、IL- 1β含量的變化趨勢與NF-κB的變化趨勢一致,腎ECM沉積得到明顯改善。以上結果表明,訓練期間補充姜黃素,有效地激活Nrf2通路,上調Nrf2/HO- 1的蛋白表達,進而抑制NF-κB的蛋白表達,降低其通路活性,炎癥級聯反應隨之受阻,TGF-β1、TNF-α、IL- 1β等炎癥因子減少,腎臟ECM合成與降解之間的平衡得到修復,減輕ECM沉積,穩定腎臟正常的組織形態學與超微結構。由此可見,姜黃素可以發揮級聯效應通過調控Nrf2信號通路,抑制NF-κB的活化與核異位,緩解炎癥因子的過度表達,進而抑制和緩解運動性腎損傷大鼠腎臟ECM的過度沉積,保護腎臟結構和功能的正常。
5 結論
姜黃素能夠發揮級聯效應,通過顯著提高運動性腎損傷大鼠腎臟組織內Nrf2蛋白表達,增強Nrf2通路活性,上調HO- 1蛋白表達,抑制NF-κB炎癥通路的過度激活,下調炎癥因子TGF-β1、TNF-α、IL- 1β的表達,緩解腎小球ECM的過度沉積,維護腎臟基本結構與功能,預防和延緩過度運動應激導致的運動性損傷,對腎臟具有保護作用。

