抗衰老酶1-p53信號通路在吸入麻醉致原代海馬神經元細胞凋亡中的神經保護作用
熊萬霞,趙曦寧,王 穎
復旦大學附屬中山醫院麻醉科,上海 200032
吸入麻醉藥作為天然分子,可廣泛作用于多個位點,具有復雜的作用方式。除了常規的麻醉作用之外,吸入麻醉藥還可能引起情緒、記憶和運動功能的改變,并對大腦產生持續的影響[1-3]。手術麻醉后,部分患者,尤其是老年患者,可出現學習、記憶、注意力和專注力等的障礙,而吸入麻醉藥是引起認知功能障礙的可能原因之一。吸入麻醉藥與手術創傷等因素能誘導圍手術期氧化應激,引起細胞內活性氧自由基(reactive oxygen species,ROS)水平升高[4]。細胞內ROS及其他一系列分子相互作用可引起細胞膜電位及細胞內離子平衡的損害,最終促使細胞凋亡[5-6]。
臨床常用的七氟醚(sevoflurane,Sev)、地氟醚及異氟醚能直接激活或增強γ-氨基丁酸(gamma-amino butyric acid,GABA)受體通道活性,誘導氯離子外流,導致神經元細胞膜的去極化,激活N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受體,使電壓依賴性鈣通道開放,引起鈣離子內流,而細胞內鈣超載可引起細胞凋亡[7-8]。有研究發現,吸入2%異氟醚6 h能上調促凋亡因子Bax水平,下調抗凋亡因子Bcl-2水平,并上調ROS水平,引起線粒體細胞色素C釋放,半胱氨酸蛋白酶3(caspase-3)和caspase-9活性升高,最終誘導細胞凋亡。本課題組之前研究[9]表明,Sev聯合一氧化二氮(N2O)麻醉可誘導老年大鼠海馬神經元細胞的凋亡,并最終導致空間學習和記憶能力損害。
沉默信息調節因子2蛋白(silent information regulator 2,Sir2)是一組高度保守的煙酰胺腺苷酸核酸(nicotinamide adenine dinucleotide,NAD)依賴的Ⅲ類組蛋白去乙酰化酶。Sir2可通過抑制基因組轉錄,調節與能量代謝和促存活機制相關的蛋白表達,在能量限制引起的長壽效應中扮演重要角色[10]。目前發現的人類Sir2同源蛋白質共有7種,分別命名為抗衰老酶(sirtuin)1~7(SIRT1~SIRT7),其中以SIRT1的研究最為廣泛。其作用主要依賴于其去乙酰化組蛋白和非組蛋白底物。目前,已在多種神經退行性疾病模型中發現SIRT1具有明確的神經保護作用,包括阿爾茨海默病(Alzheimer disease,AD)、肌萎縮側索硬化(amyotrophic lateral sclerosis,ALS)、瓦勒變性(Wallerian degeneration)和多發性硬化癥(multiple sclerosis)等[11-15]。本研究在以往研究的基礎上進一步探討Sev聯合N2O吸入麻醉藥對原代海馬神經元細胞凋亡的影響及其可能機制。
1 材料與方法
1.1 實驗動物及試劑 出生24 h內的SD大鼠,雌雄不限,購于上海斯萊克實驗動物有限責任公司。
細胞培養液、1×PBS緩沖液、20×PBS緩沖液和DMEM購于HyClone公司;胎牛血清(fetal bovine serum,FBS)、D-hanks液、Nerobasal培養液和B27購于Gibco公司;多聚-L-賴氨酸和驢血清封閉液購于北京鼎國生物技術有限責任公司;0.25%胰蛋白酶和0.02%EDTA液購于上海吉諾生物科技有限公司;組織細胞蛋白裂解液、BCA蛋白質定量檢測試劑盒、Tris-HCl、過硫酸銨(APS)、十二烷基硫酸鈉(SDS)、四甲基乙二胺(TEMED)、丙烯酰胺、麗春紅S、甘氨酸、Tween-20和DAPI購于上海碧云天生物技術有限公司;蛋白Marker購于Fermentas公司;脫脂奶粉購于上海光明食品廠;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)購于Millipore公司;ECL高靈敏化學發光試劑盒購于Thermo公司;6孔細胞培養板、離心管和細胞培養皿購于Corning公司;Sev購于Baxter公司;N2O由復旦大學附屬中山醫院供應中心提供。SIRT1拮抗劑Sirtinol、Salermide和激動劑Resveratrol購自Sigma公司;兔抗鼠SIRT1、Bax、剪切型聚腺苷酸二磷酸核糖轉移酶[cleaved poly (ADP-ribose)polymerase,,c-PARP)和β-actin抗體均購自Santa Cruz公司,兔抗鼠剪切型caspase-3(cleaved caspase-3,c-caspase-3)和磷酸化組蛋白H2A家族成員X(phosphorylated H2A histone family member X,γ-H2AX)抗體均購自Epitomics公司,兔抗鼠乙酰化p53[acetylated p53(lysine 381),Acetyl-p53]抗體購自Abcam公司。小鼠抗大鼠神經元特異性核蛋白(neuron-specific nuclear protein,NeuN)抗體購自Millipore公司。
1.2 原代海馬神經元的分離培養和處理 將新生24 h內的SD大鼠用75%乙醇溶液全身消毒,斷頭處死,無菌條件下分層剪開頭皮、顱骨,用彎鑷暴露腦區視野,小心拔開大腦顳葉皮質,顯露出新月狀海馬回。小心夾出海馬組織,置于4 ℃預冷的D-hanks液中,仔細剔除微血管,并充分剪碎組織。加入同體積0.125%的胰蛋白酶溶液,瓶口用錫箔紙蓋上,置于37 ℃培養箱內消化15 min,每3 min輕搖1次,過濾。加入FBS終止消化,輕輕吹打數分鐘,至糊狀,然后用400目網篩過濾,收集濾液。1 000 r/min室溫離心5 min,棄上清液,用含10%FBS的DMEM/F12培養液重懸細胞,輕輕吹打,錐出藍染色后快速計數。調整細胞終密度為(1~10)×105個/mL,接種于多聚賴氨酸包被的培養板中,置于37 ℃、含5%CO2的培養箱中培養。接種12 h后將培養液換成加入了2%B27和L-谷氨酰胺的Nerobasal培養液繼續培養,隨后每3 d半量換液1次。
采用定制的透明玻璃箱(20 cm×20 cm×10 cm),放置于37 ℃水浴箱中30 min,然后將培養2周的原代神經元置于玻璃箱中,內置氣體監測儀探頭,外接1.3%Sev聯合50%N2O吸入麻醉+50%O2(對照組僅給予50%空氧混合氣)處理2 h。或將原代神經元先分別予以100 μmol/L Resveratrol、50 μmol/L Salermide或50 μmol/L Sirtinol預處理24 h后,再吸入麻醉處理2 h。24 h后收集各組細胞,進行后續檢測。
1.3 蛋白質印跡法檢測SIRT1-p53信號通路相關蛋白表達 離心細胞,棄上清液,用預冷的PBS沖洗2次,吸盡上清液后,加入適量含PMSF的細胞蛋白裂解液,200 μL移液器反復吹打,冰上孵育30 min;冰上超聲振蕩;4 ℃,12 000×g離心30 min,將上清液移至新的EP管中。采用BCA法測定所提取蛋白的濃度后,取30 μg蛋白質,在10%十二烷基硫酸鈉聚丙烯酰胺凝膠中進行電泳分離,隨后在300~350 mA恒流條件下,轉膜9 min,將電泳分離后的蛋白質條帶轉移至PVDF膜。然后,使用5%脫脂牛奶于室溫封閉2 h,分別加入不同的一抗:兔抗鼠SIRT1抗體、兔抗鼠c-caspase-3抗體、兔抗鼠Bax抗體、兔抗鼠γ-H2AX抗體、兔抗鼠c-PARP抗體、兔抗鼠Acetyl-p53抗體和兔抗鼠β-actin抗體,4℃條件下孵育過夜。隨后與相應的HRP標記山羊抗兔 IgG (Santa Cruz)、HRP 標記山羊抗鼠 IgG (Santa Cruz)在室溫孵育1 h,使用ECL高靈敏化學發光試劑盒進行顯影。對膠片進行曝光,并記錄圖片,然后進行灰度值分析。將各目的蛋白條帶灰度值與內參蛋白(β-actin)條帶灰度值的比值作為該蛋白的相對表達量。
1.4 免疫熒光法檢測相關蛋白表達 將各處理組細胞在含2%甲醛的PBS中冰上固定10 min,用預冷PBS沖洗2次,每次5 min。然后,細胞在含0.1% Triton X-100和10%驢血清的PBS中進行內源性抗原封閉30 min。用PBS漂洗2次后,在每個35 mm培養皿中分別加入0.75~1 mL含兔抗鼠c-caspase-3抗體、小鼠抗大鼠NeuN抗體、兔抗鼠SIRT1抗體和兔抗鼠Acetyl-p53抗體的一抗工作液(用含10%驢血清的PBS稀釋液按比例稀釋NeuN 1∶500;c-caspase-3 1∶200;SIRT1 1∶100;Acetyl-p53 1∶250),室溫孵育2 h。PBS洗滌3次后,每個35 mm培養皿中各加入0.75~1 mL熒光標記驢抗兔 IgG (Alexa Fluor-555)、熒光標記驢抗鼠 IgG (Alexa Fluor-488)的二抗工作液(用含10%驢血清的PBS稀釋按1∶1 000比例稀釋)室溫孵育30 min。PBS洗滌3次后,加入稀釋體積比例為1∶1 000的DAPI 染色液1 mL,室溫孵育1 min。洗滌3次后,置于免疫熒光顯微鏡下觀察染色結果并拍照。
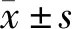
2 結 果
2.1 Sev聯合N2O吸入麻醉誘導原代海馬神經元細胞凋亡 蛋白質印跡法檢測結果(圖1A)顯示,Sev聯合N2O處理后原代海馬神經元細胞內凋亡相關指標Bax、c-caspase-3和c-PARP表達水平顯著升高(均P<0.001)。為了驗證該結果,進一步采用免疫熒光實驗檢測c-caspase-3的表達情況,結果如圖1B所示,神經元特異性蛋白NeuN在對照組和Sev聯合N2O處理組均有表達,而Sev聯合N2O處理后c-caspase-3的熒光染色比對照組明顯增強。以上結果表明,Sev聯合N2O麻醉處理可引起原代海馬神經元細胞的凋亡。
2.2 Sev聯合N2O吸入麻醉上調γ-H2AX蛋白水平 蛋白質印跡法檢測結果(圖2)顯示,Sev聯合N2O吸入麻醉處理后,原代海馬神經元細胞中γ-H2AX的蛋白水平顯著升高(P<0.001),證實吸入麻醉可引起原代海馬神經元細胞的DNA斷裂。

圖1 Sev聯合N2O吸入麻醉對原代海馬神經元細胞凋亡的影響
A:蛋白質印跡法檢測凋亡相關蛋白Bax、c-caspase-3和c-PARP的表達(β-actin為內參照);B:免疫熒光法檢測c-caspase-3表達(NeuN為神經元特異性核蛋白).Sev+N2O:1.3%Sev聯合50%N2O+50%O2吸入麻醉處理;對照組:僅給予50%O2+50%空氣的混合氣;***P<0.001

圖2 Sev聯合N2O吸入麻醉對DNA損傷標志蛋白γ-H2AX表達的影響
Sev+N2O:1.3%Sev聯合50%N2O+50%O2吸入麻醉處理;對照組:僅給予50%O2+50%空氣的混合氣;***P<0.001
2.3 Sev聯合N2O吸入麻醉上調SIRT1蛋白水平并促進p53去乙酰化 蛋白質印跡法檢測結果(圖3A)顯示:Sev聯合N2O處理可明顯上調原代海馬神經元細胞中的SIRT1蛋白水平(P<0.01)。此外,SIRT1作為一個去乙酰化酶,其活性作用的發揮依賴于蛋白底物的去乙酰化;而且p53蛋白是細胞凋亡的重要調節因子,也是SIRT1的主要作用底物之一。因此,本研究進一步檢測了p53蛋白的乙酰化水平。結果顯示Sev聯合N2O處理后Acetyl-p53蛋白水平明顯降低(P<0.01)。進一步使用免疫熒光實驗驗證Sev聯合N2O吸入麻醉對SIRT1和Acetyl-p53蛋白水平的影響,結果顯示Sev聯合N2O處理可明顯增強SIRT1的熒光染色(圖3B),而Acetyl-p53的熒光強度明顯減弱(圖3C)。

圖3 Sev聯合N2O吸入麻醉對SIRT1及去乙酰化p53蛋白表達的影響
A:蛋白質印跡法檢測 SIRT1和Acetyl-p53表達水平;B、C:免疫熒光實驗檢測SIRT1和Acetyl-p53表達.Sev+N2O:1.3%Sev聯合50%N2O+50%O2吸入麻醉處理;對照組:僅給予50%O2+50%空氣的混合氣;**P<0.01與對照組相比
2.4 激活或抑制SIRT1通路對吸入麻醉引起原代海馬神經元細胞凋亡的影響 蛋白質印跡法檢測結果(圖4A)表明:SIRT1拮抗劑salermide或sirtinol預處理可明顯下調SIRT1蛋白的表達水平(P<0.001),并明顯上調p53的乙酰化水平(P<0.001),同時抑制SIRT1后細胞凋亡相關指標Bax(P<0.001)、c-caspase-3(P<0.001)、c-PARP(P<0.001)和γ-H2AX(P<0.01)的蛋白水平進一步升高。與之相反的是,SIRT1激動劑resveratrol預處理可上調SIRT1蛋白水平(P<0.01),而抑制p53的乙酰化(P<0.05),并且凋亡相關指標Bax(P<0.05)、c-caspase-3(P<0.05)、c-PARP(P<0.05)和γ-H2AX(P<0.01)的表達水平也相應降低。
免疫熒光實驗結果(圖4B)進一步證實,SIRT1激動劑resveratrol預處理能減弱Sev聯合N2O處理后神經元細胞的凋亡;而SIRT1拮抗劑salermide和sirtinol預處理則在吸入麻醉藥引起細胞凋亡的基礎上進一步增加凋亡相關指標的表達。以上結果提示,吸入麻醉引起的海馬神經元細胞中SIRT1蛋白水平的反饋性升高具有神經保護作用,而抑制SIRT1表達將加重吸入麻醉導致的神經元細胞凋亡。

圖4 激活或抑制SIRT1通路對Sev聯合N2O麻醉誘導原代海馬神經元細胞凋亡相關蛋白水平的影響
A:蛋白質印跡法檢測SIRT1、Acetyl-p53、Bax、c-caspase-3、c-PARP和γ-H2AX 的表達;B:免疫熒光實驗檢測SIRT1、Acetyl-p53和c-caspase-3蛋白表達.Sev+N2O:1.3%Sev聯合50%N2O+50%O2吸入麻醉處理;Sev+N2O+sirtinol:先用SIRT1拮抗劑sirtinol預處理,再用1.3%Sev聯合50%N2O+50%O2吸入麻醉處理;Sev+N2O+salermide:先用SIRT1拮抗劑salermide預處理,再用1.3%Sev聯合50%N2O+50%O2吸入麻醉處理;Sev+N2O+resveratrol:先用SIRT1激動劑resveratrol預處理,再用1.3%Sev聯合50%N2O+50%O2吸入麻醉處理.*P<0.05,**P<0.01,***P<0.001與對照組(Sev+N2O)相比
3 討 論
近年來研究發現Sir2蛋白家族在延長壽命方面具有一定的功能,是目前醫學研究的熱點之一[16]。SIRT1作為人類Sir2同源蛋白質之一,在發育期大腦中具有廣泛的表達,并且中樞神經系統受損后被激活的SIRT1具有神經保護作用[17-18]。有研究[19]顯示,SIRT1在AD患者的大腦皮質內存在明顯的下降趨勢,這可能與tau和Aβ蛋白的積聚及認知功能損害密切相關。另外,在AD動物模型中,過表達SIRT1能降低Aβ水平,而敲除SIRT1則能引起Aβ水平升高[20]。另一項關于Huntingtin疾病的研究[21]也顯示,過表達SIRT1可減輕亨廷頓蛋白(huntingtin protein)介導的代謝異常,減少大腦萎縮,并改善運動功能。事實上,SIRT1抑制神經退行性變的功能是其具有延長壽命作用的機制之一;另外SIRT1還具有調節神經元分化,以及在海馬缺血預處理中發揮神經保護的作用[22-23]。
組蛋白的乙酰化修飾對基因表達具有重要的調控作用,是學習與記憶的重要部分[24]。同時,在記憶的鞏固中,組蛋白乙酰化通過調節染色質重塑也發揮了重要作用,而SIRT1在染色質重塑及組蛋白乙酰化過程中均扮演著重要角色[25]。本研究以原代海馬神經元細胞為研究對象,結果顯示Sev聯合N2O吸入麻醉能促進原代海馬神經元細胞的凋亡,同時也可引起SIRT1表達增加。鑒于SIRT1的神經保護作用,本研究進一步給予SIRT1抑制劑sirtinol、salermide或激動劑resveratrol共培養后進行吸入麻醉干預,以期雙向驗證Sev聯合N2O吸入麻醉引起的SIRT1上調對其誘導的神經細胞凋亡的影響,結果初步闡明了上調SIRT1表達可以減弱Sev聯合N2O吸入麻醉的促神經細胞凋亡作用,表明SIRT1具有潛在的神經保護作用。
目前已有的文獻報道[26-27]顯示,SIRT1能使p53在內的多種蛋白發生去乙酰化。p53蛋白在進化上相對保守,p53乙酰化修飾對其功能具有重要的調節作用,并且在p53依賴的細胞凋亡途徑中發揮重要作用。當一些信號刺激引起DNA損傷時,一方面p53發生乙酰化,促進其下游促凋亡基因的激活或轉錄,進而引起細胞凋亡;另一方面,機體也會同時啟動自我修復機制,上調SIRT1的表達,以維持p53的去乙酰化狀態,使p53活性下降,導致依賴于p53的Bax等促凋亡基因的轉錄被抑制,從而保護細胞免受凋亡損害[28]。研究[29]顯示,通過 SIRT1 對 p53 的去乙酰化可以抑制p53 介導的細胞凋亡而發揮其促神經分化與存活的作用,而SIRT1 基因敲除時將增加 p53 的乙酰化及神經元細胞的凋亡。由此可見,SIRT1 通過 p53 去乙酰化平衡在神經元生存中發揮了重要的作用。本研究中Sev聯合N2O吸入麻醉處理在引起SIRT1表達水平上調的同時,也促進了p53的去乙酰化,并且進一步使用SIRT1的激動劑和拮抗劑證明Sev聯合N2O吸入麻醉處理后神經細胞內上調的SIRT1通過去乙酰化p53發揮其抗凋亡作用,從而減緩吸入麻醉所致神經細胞凋亡。
本研究用從新生大鼠中提取的原代海馬神經元細胞作為體外模型,驗證了Sev聯合N2O吸入麻醉可致神經元細胞凋亡及DNA損傷,但與此同時也可反饋性地促進SIRT1的表達,上調的SIRT1進一步促進p53的去乙酰化,從而緩解Sev聯合N2O吸入麻醉誘導的神經元細胞凋亡。因此,本研究闡明了SIRT1-p53信號通路在Sev聯合N2O吸入麻醉所致大鼠原代海馬神經元細胞凋亡中具有神經保護作用。該結果為臨床上減輕吸入麻醉藥引起的神經細胞損傷提供了一個潛在的治療靶點。

