雙相體系中一種誘變株細胞催化制備(S) 奧美拉唑
王志勇 李德鵬 王繁業
摘要:? 針對傳統方法制備(S) 奧美拉唑過程中存在的催化劑活性弱及底物濃度過低等問題,本文以氯仿 水雙相體系為反應介質,采用R. rhodochrous誘變株細胞催化奧美拉唑硫醚的生物氧化制備(S) 奧美拉唑。使得底物及細胞濃度分別達到180 mmol/L和100 g/L,且得到較高的產率(99.29%)和對映體過量百分率(enantiomeric excess,ee%)。同時,采用響應面法(response surface methodology,RSM)優化反應條件,建立了(S) 奧美拉唑收率的二次多項式模型,該模型的相關系數(correlation coefficient,R2)達到0.9990。研究結果表明,R. rhodochrous誘變株細胞表現出高對映選擇性,催化活性以及底物和產物耐受性,可以用于高效制備手性亞砜。該研究對提高(S) 奧美拉唑單位體積產率及降低生產成本具有重要意義。
關鍵詞:? 生物氧化; 氯仿 水雙相系統; (S) 奧美拉唑; 靜息細胞; 響應面法
中圖分類號: TQ463? 文獻標識碼: A
抗潰瘍藥物質子泵抑制劑(proton-pump inhibitor,PPI)屬于手性亞砜,奧美拉唑是其代表性藥物之一,其立體構型與藥物的藥理活性及代謝速率等密切相關[1] ,采用單一對映體給藥,可以大幅度提高其藥理活性,(S) 奧美拉唑的高效制備一直是現在面臨的問題。目前,手性亞砜主要由金屬配合物催化劑[2] 催化硫化物的不對稱氧化制得,但存在環境不友好等許多缺陷;也有許多研究者采用酶催化制備手性亞砜,如單加氧酶[3] ,辣根過氧化物酶[4] ,肌紅蛋白和細胞色素等,利用酶催化制備手性亞砜存在許多不足,例如需要輔助因子循環系統,酶的價格昂貴等,而采用全細胞催化,不需要昂貴的輔因子再生。近年來,單水相系統中硫化物的全細胞生物氧化引起了人們的廣泛關注[5 7] 。R.Holt等人[8] 在單水相體系中對15株菌株進行了生物氧化奧美拉唑硫醚實驗,獲得ee%為17%~99%的(R) 奧美拉唑;T.Yoshida等人[9] 在單水相體系中利用真菌CunninghamellaechinulataMK40制備了ee%>99%的(S) 雷貝拉唑。但在單水相體系中,由于底物和產物對細胞有較強的抑制作用,因此底物的質量濃度維持在較低水平(0.08~1.5 g/L),而且轉化率隨著底物質量濃度的增加而顯著降低[7] 。相較于單水相體系,采用有機溶劑 水雙相體系可以有效提高底物和產物的濃度。底物和產物的高濃度對提高單位體積產率,降低生產成本具有重要意義。因此,許多科學家致力于提高底物和產物的質量濃度,以提高反應器的操作強度,降低生產成本。Liu Z Q等人[10] 采用有機溶劑 水雙相系統制備依折麥布手性中間體,可以顯著增加底物的質量濃度。目前,在有機溶劑 水雙相系統中利用細胞催化奧美拉唑硫醚生物氧化制備(S) 奧美拉唑尚未有報道。因此,為了顯著提高底物濃度和(S) 奧美拉唑的產率,本研究在有機溶劑 水雙相體系中利用R. rhodochrous誘變株細胞催化奧美拉唑硫醚的生物氧化制備(S) 奧美拉唑,并采用響應面法(response surface methodology,RSM)優化不對稱細胞催化生物氧化的反應條件,建立了(S) 奧美拉唑收率的二次多項式模型,以大幅度提高(S) 奧美拉唑的產率。該研究對提高(S) 奧美拉唑單位體積產率及降低生產成本具有重要意義。
1 實驗部分
1.1 實驗材料和儀器
(S) 奧美拉唑,蘇州維他化學有限公司;奧美拉唑硫醚,濟南沃爾德化工有限公司;奧美拉唑,山東壽光富康制藥有限公司。其他化學制品均為分析純。本研究使用RhodococcusrhodochrousATCC 4276誘變株細胞,該誘變株具有比野生菌株更好的生物氧化活性和底物耐受性。
UV 1000型紫外可見分光光度計,翱藝儀器(上海)有限公司;Agilent 1200 LC型高效液相色譜儀,安捷倫科技有限公司;PHS 25C PH計,杭州奧立龍儀器有限公司。
1.2 靜息細胞在有機 水雙相體系中催化奧美拉唑硫醚氧化形成(S) 奧美拉唑
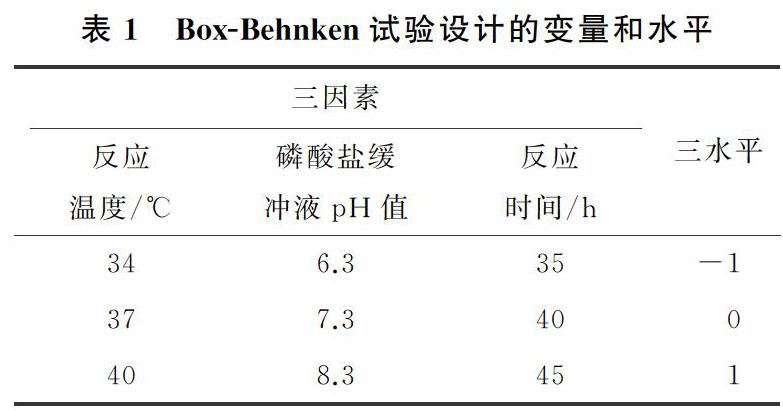
在反應瓶中進行生物氧化反應,反應溫度為34~40 ℃,時間為35~45 h,轉速150 rad/min,反應瓶通入潔凈空氣。反應有機相為氯仿,水相為磷酸鹽緩沖液(pH=6.3~8.3,葡萄糖2 g/L)。將奧美拉唑硫醚溶解在氯仿中,使最終濃度為100~200 mmol/L(32.9~65.8 g/L,以氯仿體積計)。如果以水和氯仿總體積計,濃度為10~20 mmol/L(3.29~6.58 g/L)。將溶解奧美拉唑硫醚后的氯仿溶液、磷酸鹽緩沖液和R. rhodochrou誘變株的靜息細胞以反應瓶體積的30%~40%加入到反應瓶中,使濕細胞質量濃度為60~100 g/L,氯仿與磷酸鹽緩沖液的體積比為1∶9。取樣,用離心機(6 000 rad/min,6 min)分離靜息細胞、氯仿和水,所得有機相用于測定對映體純度和轉化率。
1.3 高效液相色譜分析
采用Agilent 1200 LC型高效液相色譜儀進行高效液相色譜(high-performance liquid chromatography,HPLC)分析,在波長為302 nm下,測定奧美拉唑硫醚的轉化率、ee%和(S) 奧美拉唑的產率。手性柱型號為Amylose-SA(規格為250 mm×4.6 mm,填料粒徑為5 μ m,廠家為日本維美希公司)。流動相為乙腈和磷酸鹽緩沖液(pH=6.0),體積比為15∶85,流速為0.6 mL/min。(S) 奧美拉唑和(R) 奧美拉唑的保留時間分別為5.8 min和6.9 min。
1.4 實驗設計與統計分析
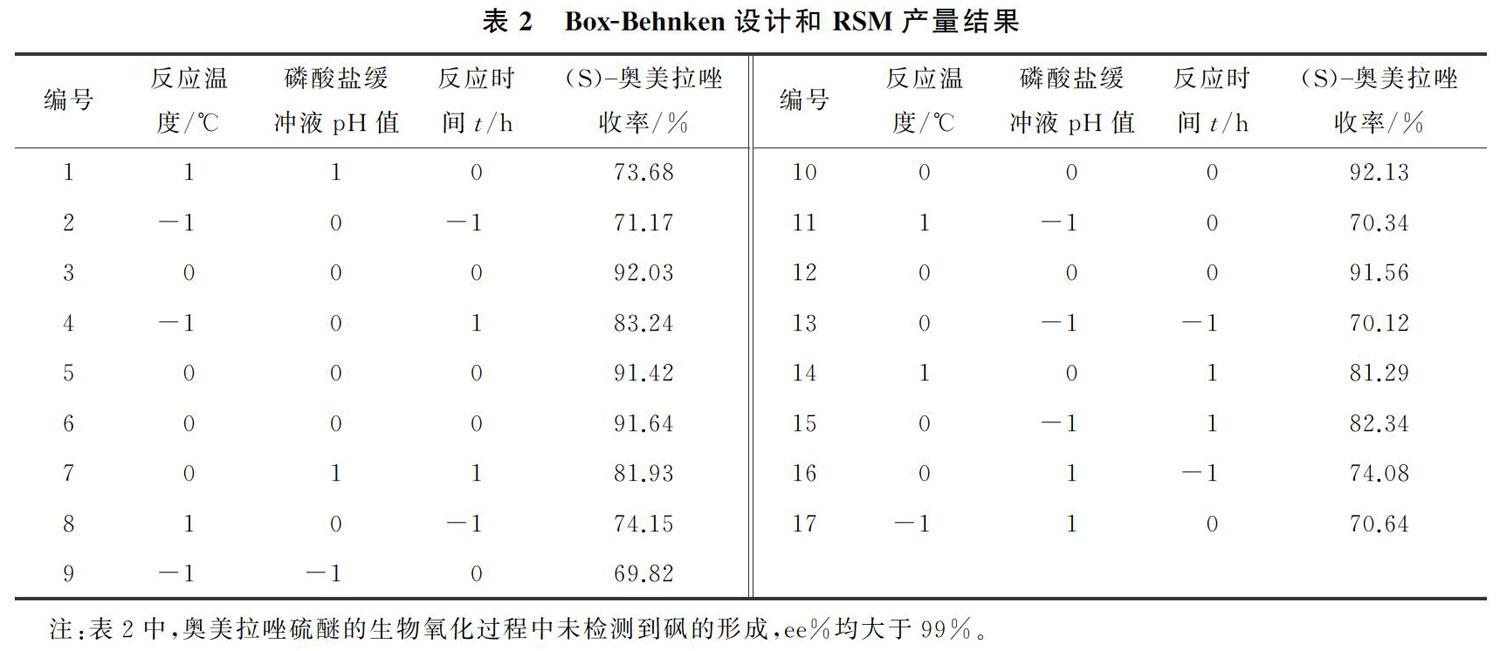
根據單因素預備實驗,選擇3個獨立變量:即反應溫度(A),磷酸鹽緩沖液pH值(B)和反應時間(C);選擇(S) 奧美拉唑的收率(Y)為響應變量。采用Design Expert 8.0.5設計了三因素三水平試驗,共計17個試驗點,這些試驗點中有5個為中心試驗點。Box-Behnken試驗設計的變量和水平如表1所示。
2 結果與討論
2.1 R. rhodochrous誘變株的靜息細胞催化奧美拉唑硫醚的生物氧化制備(S) 奧美拉唑Box-Behnken設計和RSM產量結果如表2所示。由表2可以看出,(S) 奧美拉唑的最高收率為92.13%(編號10),ee%>99%。在奧美拉唑硫醚的生物氧化過程中,R. rhodochrous誘變株的靜息細胞催化反應沒有檢測到砜的形成。以氯仿和磷酸鹽緩沖液總體積計,底物的質量濃度為5.92 g/L,該結果優于文獻[9,11 14]中底物的質量濃度0.5~1.5 g/L。
本研究之所以獲得了較高的產量、ee%和底物濃度,其主要原因如下:
1) R. rhodochrousATCC 4276誘變株具有較高的對映選擇性、催化活性和對底物與產物的耐受性,并且沒有進一步氧化亞砜產生砜,說明該菌株是制備手性亞砜的很好生物催化劑,優于文獻[15]報道的許多菌株,包括Trametes species H. specie,M. isabellina,Rhizopus specie,Trichaptum specie,B. cinerea,T. virideand和E. lata。
2) 為反應瓶提供潔凈空氣,支持細胞催化奧美拉唑硫醚的生物氧化,實現了高質量濃度的靜息細胞反應。否則,細胞的質量濃度通常不會太高,如濕細胞20~40 g/L[7] ,濕細胞70~100 g/L[16] ,凍干酵母6.6 g/L[13] 。
3) 采用氯仿磷酸鹽緩沖液雙相體系是顯著提高底物質量濃度的最重要因素,而采用有機 水雙相體系可以提高細胞對底物的耐受性和對映體選擇性[9 10] 。對于有機 水雙相系統,水與有機溶劑的比例不僅影響微生物細胞與底物的反應界面面積,還會影響微生物細胞,因此會對微生物的催化活性產生顯著影響[7,16 17] 。通常認為有機溶劑可以顯著影響酶的活性[17] ,酶的生物氧化活性與溶劑的油水分配系數(oil-water partition coefficient,P呈正相關,一般用logP表示)即隨著log P的增加,生物氧化活性增加,例如異辛烷(logP=4.5)[16] 的相對活性為161%,乙酸乙酯(logP=0.68)的相對活性為33.5%,通常認為logP低的溶劑(當logP<1時),會破壞細胞膜,導致細胞活性降低[9] 。
通過單變量實驗,確定磷酸鹽緩沖液與氯仿的最佳體積比為9∶1。在氯仿 磷酸鹽緩沖液雙相系統中,奧美拉唑硫醚和產物(S) 奧美拉唑幾乎全部分布在氯仿中;相反,細胞則分布在磷酸鹽緩沖液中。由此可以看出,氯仿中的奧美拉唑硫醚和(S) 奧美拉唑對細胞的損害很小,因此對細胞的生物催化活性幾乎沒有抑制作用。在單水相系統中,可能發生細胞對底物的吸附,造成底物富集,使得只有一小部分被吸附的底物參與了生物氧化反應,而其他被吸附的底物則可能會損傷細胞,抑制其催化活性。與單水相體系相比,在有機 水雙相體系中,底物幾乎完全分布在有機溶劑中,因此,細胞吸附的底物顯著減少,吸附的底物主要參與生物氧化,而不會損害細胞和抑制其生物催化活性。
2.2 RSM優化R. rhodochrous誘變株細胞催化的奧美拉唑硫醚的不對稱生物氧化
通過RSM設計和分析自變量對實驗結果的影響,確定最佳實驗條件,探索實驗變量之間的相互作用并建立最佳擬合模型。給出(S) 奧美拉唑的產率回歸模型為
Y=91.76+0.57A+0.96B+4.91C+0.63AB-1.23AC-1.09BC-10.15A 2 -10.49B 2 -4.15C 2? (1)
式中,A為反應溫度的水平;B為磷酸鹽緩沖液pH值的水平;C為反應時間的水平;AB為反應溫度的水平和磷酸鹽緩沖液pH值的水平的乘積;AC為反應溫度的水平和反應時間的水平的乘積;BC為磷酸鹽緩沖液pH值的水平和反應時間的水平的乘積。當式(1)中變量系數為正時,(S) 奧美拉唑的產量與該變量成正相關,線性項A,B,C和交互作用項AB具有正系數,表明這些變量的增加將提高(S) 奧美拉唑的產率。
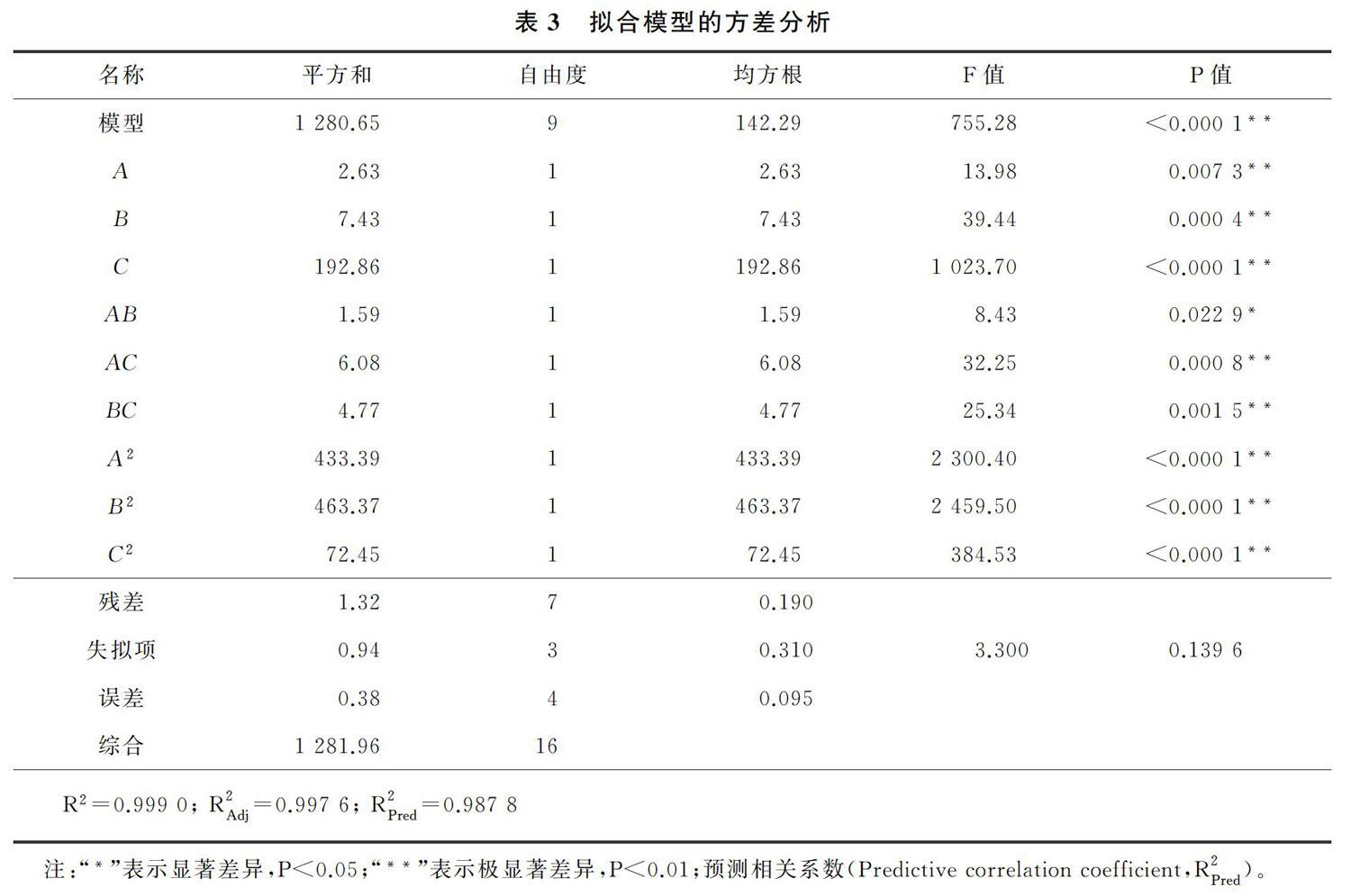
對擬合模型進行方差分析,計算了擬合模型和模型中含有A,B,C等各單項式(如:0.57A,-1.09BC)在表2中的17個試驗點水平下的平方和、自由度和均方根等。擬合模型的方差分析結果如表3所示。由表3可以看出,(S) 奧美拉唑的產率基于R2=0.999 0,說明該模型很好的擬合了實驗數據。校正相關系數(adjusted correlation coefficient)R2Adj 為0.997 6,與R2僅相差0.001 4,進一步證明該模型很好的擬合了實驗數據。該模型的P(P value)<0.000 1,證明了該模型的可靠性。
由式(1)和表3可知,除了相互作用項AB(P=0.022 9)外,所有線性,相互作用項的P<0.000 1~0.007 3,表明它們對(S) 奧美拉唑產率有較大影響。值得注意的是,反應溫度(A),緩沖液pH和反應時間(相互作用項BC)對(S) 奧美拉唑產率的影響更大。
反應溫度和磷酸鹽緩沖液pH值對(S) 奧美拉唑產率的影響的響應面圖如圖1所示;反應溫度和反應時間對(S) 奧美拉唑產率的影響的響應面圖如圖2所示。由圖1和圖2可以看出,當反應溫度從34 ℃升至約37 ℃,(S) 奧美拉唑的產率隨著反應溫度的增加而增加;而當反應溫度從37 ℃進一步升高,(S) 奧美拉唑的產率隨著的溫度的升高而降低,表明R. rhodochrous誘變株細胞催化反應的最佳溫度為37 ℃,當反應溫度偏離該最佳點時,R. rhodochrous誘變株細胞的生物催化活性將降低。通常情況下,生物催化劑對溫度非常敏感,因此反應溫度對酶、細胞的生物催化活性和穩定性具有顯著影響[18 20] 。
磷酸鹽緩沖液pH值和反應時間對(S) 奧美拉唑產率的影響的響應面圖如圖3所示。由圖1和圖3可以看出,隨著緩沖液pH值從6.3升高至7.3,(S) 奧美拉唑的產率也隨之升高;但是隨著緩沖液pH值從 7.3進一步升高至8.3,(S) 奧美拉唑的產率降低。pH會影響底物和酶的離子狀態,從而影響酶和整個細胞催化產物的產量和ee%[14] ,因此緩沖液的pH會影響R. rhodochrous細胞的生物催化活性;由圖2和圖3可以看出,隨著反應時間從35 h延長至約43 h,(S) 奧美拉唑的產率迅速增加;而當反應時間從43 h延長至45 h,收率幾乎沒有提高。因此,最佳反應時間約為43 h,如果反應時間進一步延長,收率增加很小,而時間成本會大幅增加。
2.3 驗證R.rhodochrous誘變株的靜息細胞催化奧美拉唑硫醚的生物氧化的最優條件
用模型方程(1)進行優化計算,確定不對稱生物氧化的最佳條件,并進行實驗驗證。確定的最佳參數如下:反應溫度為37 ℃,磷酸鹽緩沖液的pH值為7.3,反應時間為43 h。在靜息細胞質量濃度為100 g/L和奧美拉唑硫醚的物質的量濃度為180 mmol/L的條件下,進行3次重復驗證實驗,所得(S) 奧美拉唑的平均收率為92.9%,該結果與模型計算結果(93.2%)非常吻合,相應的ee%>99%。實驗結果表明,在異辛烷 水雙相系統中,R. rhodochrousis誘變株細胞能夠高效催化奧美拉唑硫醚的不對稱生物氧化,可以用于高效制備手性亞砜。
3 結束語
本文通過對氯仿 水雙相系統中誘變株細胞催化奧美拉唑硫醚生物氧化制備(S) 奧美拉唑進行研究。在高底物物質的量濃度(180 mmol/L)和細胞質量濃度(100 g/L)下,采用RSM對實驗條件進行優化,獲得的(S) 奧美拉唑的最佳收率為92.9%,ee%>99%;最佳條件:反應溫度為37 ℃,磷酸鹽緩沖液的pH值為7.3,反應時間為43 h;沒有檢測到砜產物形成。同時,建立了(S) 奧美拉唑收率的二次多項式模型,該模型的R2 =0.9990,可以很好的預測實驗數據。實驗表明氯仿 水雙相系統可以顯著提高細胞對底物的耐受性,因為幾乎所有底物都分布在有機相中,不會損壞和抑制細胞的催化作用。R. rhodochrousATCC 4276誘變株顯示出高對映選擇性、催化活性以及底物和產物的耐受性,可以用于高效制備手性亞砜。該研究對提高(S) 奧美拉唑單位體積產率及降低生產成本具有重要意義。
參考文獻:
[1] 劉文強, 李莉. 手性藥物及其中間體拆分方法的研究進展[J]. 藥學學報, 2018, 53(1): 37 46.
[2] Zhang J, Jiang T, Mai Y, et al. Selective catalytic oxidation of sulfides to sulfoxides or sulfones over amorphous Nb2O5/AC catalysts in aqueous phase at room temperature[J]. Catalysis Communications, 2019, 127(1): 10 14.
[3] 李仁結, 張龑, 許建和, 等. CYP116B家族單加氧酶的發現、表征及分子改造研究進展[J]. 生物加工過程, 2019, 17(1): 29 35, 43.
[4] 姜標, 黃浩, 羅軍, 等. 硫化物的生物氧化成手性亞砜[J]. 有機化學, 2005, 25(12): 1542 1547.
[5] Li A T, Yu H L, Pan J, et al. Resolution of racemic sulfoxides with high productivity and enantioselectivity by a Rhodococcus sp. strain as an alternative to biooxidation of prochiral sulfides for efficient production of enantiopure sulfoxides[J]. Bioresour Technol, 2011, 102(2): 1537 1542.
[6] Elkin A A, Kylosova T I, Grishko V V, et al. Enantioselective oxidation of sulfides to sulfoxides by gordonia terrae IEGM 136 and rhodococcus rhodochrous IEGM 66[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 89(1): 82 85.
[7] Li A T, Zhang J D, Yu H L, et al. Significantly improved asymmetric oxidation of sulfide with resting cells of rhodococcus sp. in a biphasic system[J]. Process Biochemistry, 2011, 46(3): 689 694.
[8] Holt R, Lindberg P, Reeve C, et al. Preparation of pharmaceutically active compounds by biooxidation: U. S. 5, 840, 552[P]. 1998 11 24.
[9] Yoshida T, Kito M, Tsujii M, et al. Microbial synthesis of a proton pump inhibitor by enantioselective oxidation of a sulfide into its corresponding sulfoxide by cunninghamella echinulata MK40[J]. Biotechnology Letters, 2001, 23(15): 1217 1222.
[10] Liu Z Q, Dong S C, Yin H H, et al. Enzymatic synthesis of an ezetimibe intermediate using carbonyl reductase coupled with glucose dehydrogenase in an aqueous-organic solvent system[J]. Bioresource Technology, 2017, 229(1): 26 32.
[11] El′Kin A A, Grishko V V, Ivshina I B. Oxidative biotransformation of thioanisole by rhodococcus rhodochrous IEGM 66 cells[J]. Applied Biochemistry & Microbiology, 2010, 46(6): 586 591.
[12] Tarasova E V, Grishko V V, Ivshina I B, et al. Cell adaptations of rhodococcus rhodochrous IEGM 66 to betulinbiotransformation[J]. Process Biochemistry, 2017, 52: 1 9.
[13] Aguirre-Pranzoni C, Bisogno F R, Orden A A, et al. Lyophilized rhodotorula yeast as all-in-one redox biocatalyst: Access to enantiopure building blocks by simple chemoenzymatic one-pot procedures[J]. Journal of Molecular Catalysis B Enzymatic, 2015, 114(1): 19 24.
[14] Grishko V V, Tarasova E V, Ivshina I B. Biotransformation of betulin to betulone by growing and resting cells of the actinobacterium rhodococcus rhodochrous IEGM 66[J]. Process Biochemistry, 2013, 48(11): 1640 1644.
[15] Gonzalo G D, Mascotti M L, Orden A A, et al. Aspergillus genus as a source of new catalysts for sulfide oxidation[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 82(1): 32 36.
[16] He Y C, Ma C L, Yang Z X, et al. Highly enantioselective oxidation of phenyl methyl sulfide and its derivatives into optically pure (S)-sulfoxides with rhodococcus sp. CCZU10 1 in an n-octane-water biphasic system[J]. Applied Microbiology & Biotechnology, 2013, 97(24): 10329 10337.
[17] He Y C, Zhou Q, Ma C L, et al. Biosynthesis of benzoylformic acid from benzoyl cyanide by a newly isolated Rhodococcus sp. CCZU10 1 in toluene-water biphasic system[J]. Bioresource Technology, 2012, 115(1): 88 95.
[18] Waghmare G V, Chatterji A, Rathod V K. Kinetics of enzymatic synthesis of cinnamyl butyrate by immobilized lipase[J]. Applied Biochemistry and Biotechnology, 2017, 183(3): 792 806.
[19] De Miranda A S, Miranda L S M, De Souza R O M A. Lipases: Valuable catalysts for dynamic kinetic resolutions[J]. Biotechnology Advances, 2015, 33(5): 372 393.
[20] Mathpati A C, Badgujar K C, Bhanage B M. Kinetic modeling and docking study of immobilized lipase catalyzed synthesis of furfurylacetate[J]. Enzyme & Microbial Technology, 2016, 84(1): 1 10.
Preparation of (S)-Omeprazole by Biological Oxidation of Mutagenic Strains in Biphasic System
WANG Zhiyong, LI Depeng, WANG Fanye
(School of Chemical Engineering, Qingdao University of Science and Technology, Qingdao 266042, China)
Abstract:? Aiming at the problems of weak catalyst activity and low substrate concentration in the process of preparing (S)-omeprazole by traditional methods, this paper uses the chloroform-water two-phase system as the reaction medium and uses the R. rhodochrous mutant strain Cells catalyze the biological oxidation of omeprazole sulfide to prepare (S)-omeprazole. The substrate and cell concentration reached 180 mmol/L and 100 g/L, respectively, and a higher yield (99.29%) and enantiomeric excess (ee%) were obtained. Response surface methodology (RSM) was used to optimize the reaction conditions, and a quadratic polynomial model of (S)-omeprazole yield was established. The correlation coefficient (R2) of the model reached 0.9990. The results of the study showed that R. rhodochrousmutagen strain cells exhibited high enantioselectivity, catalytic activity, substrate and product tolerance, and could be used to efficiently prepare chiral sulfoxides. This research is of great significance for increasing the yield per unit volume of (S)-omeprazole and reducing production costs.
Key words: biological oxidation; chloroform-water two-phase system; (S)-omeprazole; resting cells; response surface methodology

