基于均勻設計法的枯草芽孢桿菌me-1的發酵培養基優化
蘇榮榮 楊武 王威 趙輝 陳美杉 羅坤
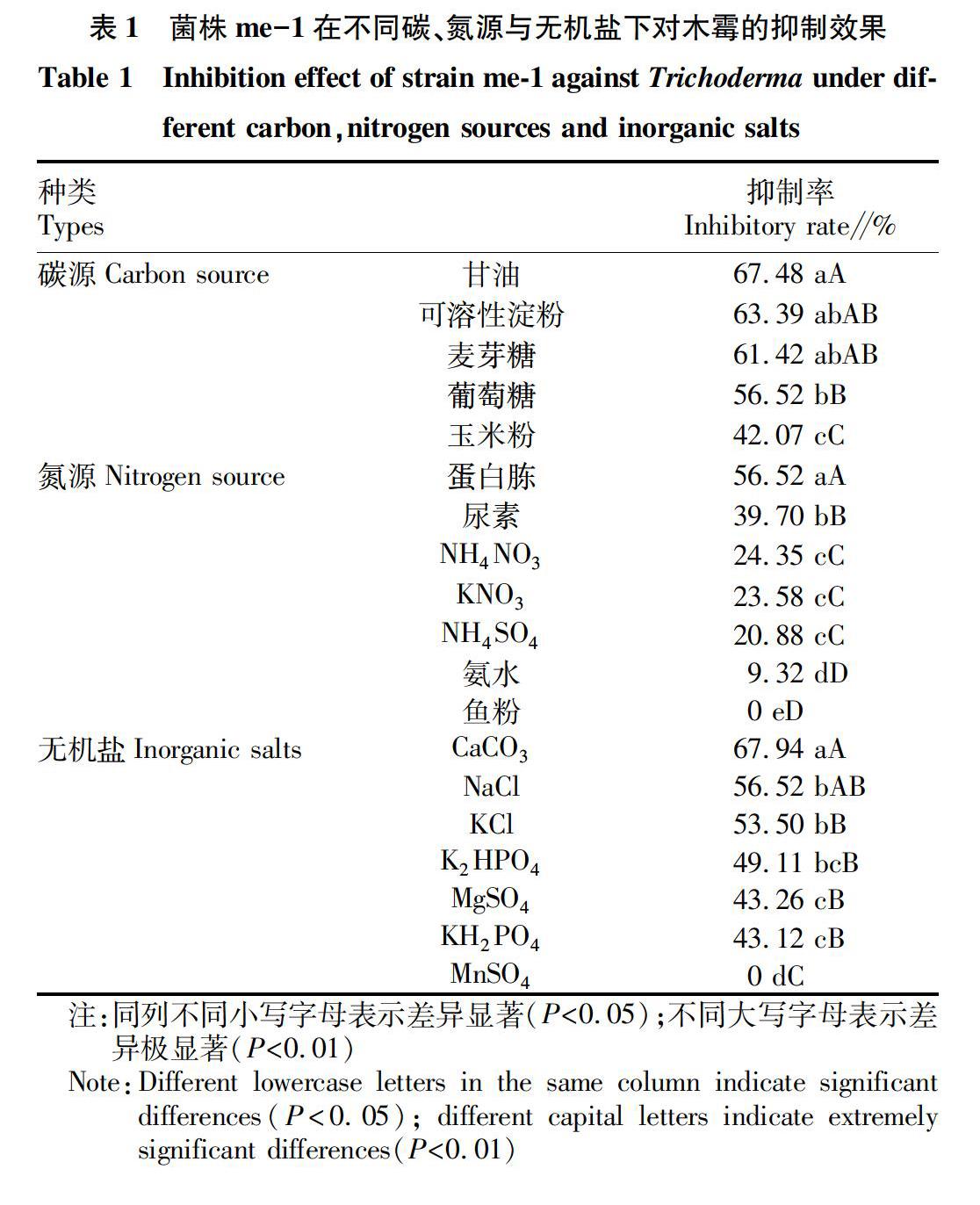
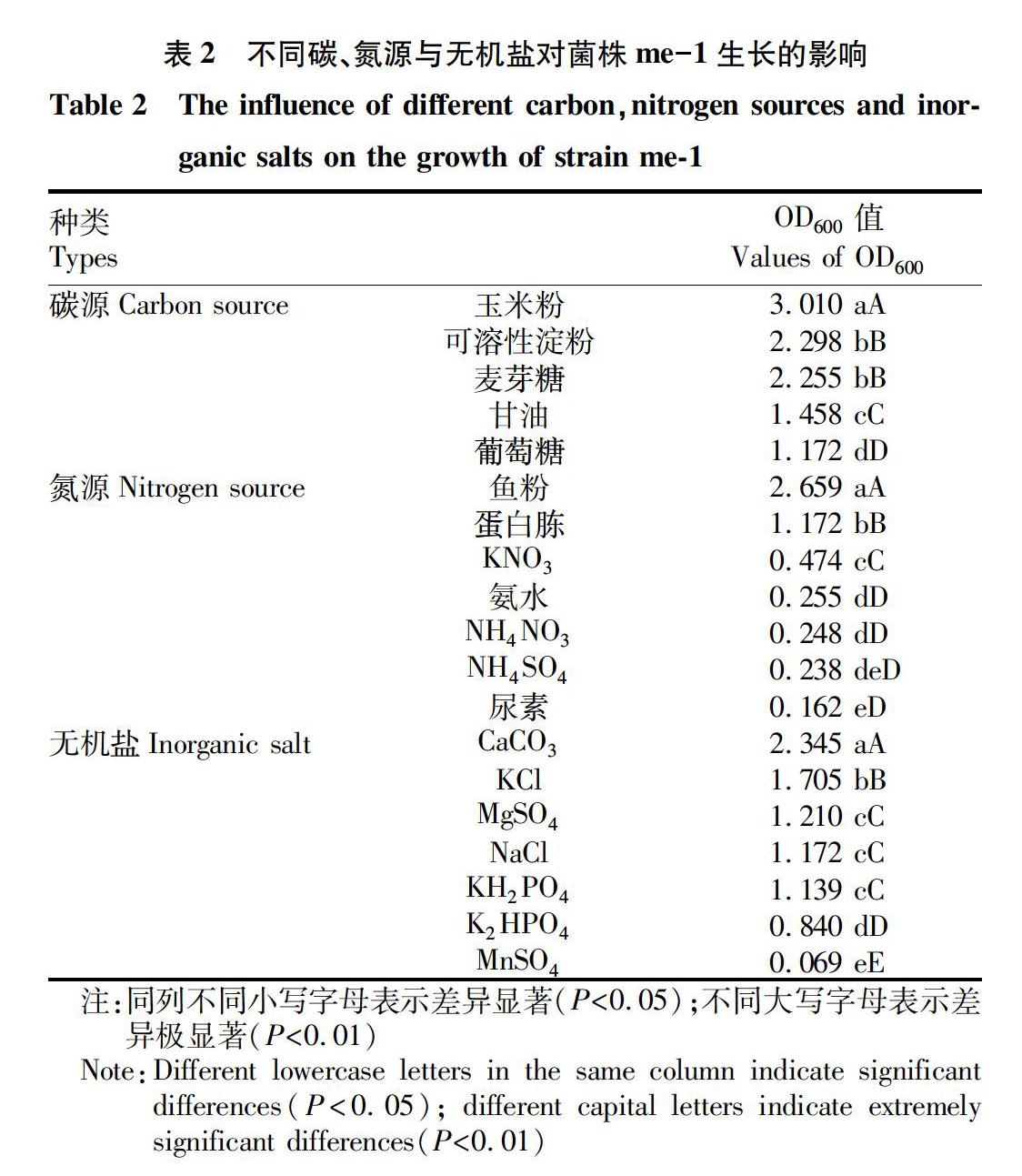
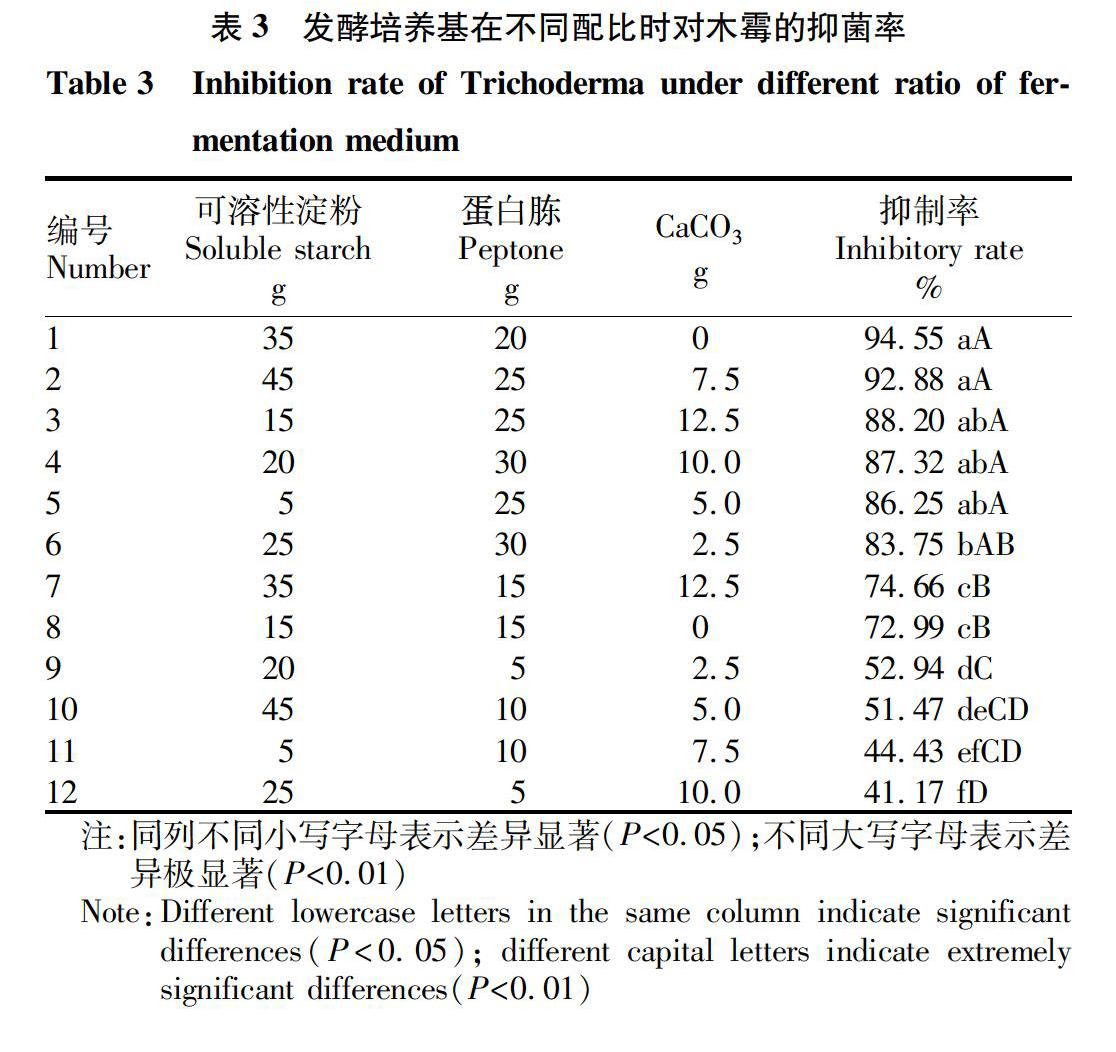
摘要?為提高枯草芽孢桿菌me-1對食用菌綠霉病的防治效果,以常見綠霉病病原真菌長枝木霉(Trichoderma longibrachiatum)為指示菌,采用單因素試驗和均勻設計法對菌株me-1發酵培養基的碳源、氮源、無機鹽進行了篩選及優化,最終確定其最適發酵培養基:可溶性淀粉35 g,蛋白胨20 g,水1 000 mL,pH 7.2,培養條件:30 ℃, 150 r/min,接種量7.0%。優化后對木霉的抑菌率達94.55%,比優化前提高了38.03%。選用優化后的培養基,繪制菌株生長曲線,結果表明,其發酵液培養3.0 d至3.5 d可使菌株me-1的菌量達到最大。該研究結果為枯草芽孢桿菌me-1的工業化生產奠定了基礎。
關鍵詞?枯草芽孢桿菌;長枝木霉;發酵培養基優化;均勻設計
中圖分類號?S?476文獻標識碼?A
文章編號?0517-6611(2019)23-0164-03
doi:10.3969/j.issn.0517-6611.2019.23.047
開放科學(資源服務)標識碼(OSID):
Optimization of Fermentation Medium for Bacillus subtilis me?1 Based on Uniform Design
SU Rong?rong1,YANG Wu2,WANG Wei2 et al
(1.Institute of Edible Fungi,Hunan Agriculture University,Changsha,Hunan410128;2.College of Plant Protection,Hunan Agriculture University,Changsha,Hunan410128 )
Abstract?To improve the control effect of Bacillus subtilis against Trichoderma,the optional fermentation medium of me?1 for the production of antimicrobial substance were soluble starch 35 g,peptone 20 g,water 1 000 mL,pH 7.2 under the culture conditions:fermentationtemperature 30 ℃,rotation speed 150 r/min ,amount of inoculation 7% and twodays cultivation through single?factor test and uniform design. Because of the optimization,the inhibitory rate reached 94.55%,which increased by 38.03% before the optimization.Furthermore,the growth curve of me?1 was drawn through six days cultivation by using the optimized medium,the results showed that the amount of me?1 could reach the maximum by the cultivation between 3.0 days and 3.5 days.The results of this experiment provided useful information forthe industrial production of me?1.
Key words?Bacillus subtilis;Trichoderma longibrachiatum;Optimization of fermentation medium;Uniform design
枯草芽孢桿菌(Bacillus subtilis)是一類廣泛存在于不同環境中需氧型革蘭氏陽性菌,可產生內生芽孢,抗逆性強,能產生70多種抗菌物質,如肽類、脂肽類和氨基酸類等多種化合物[1-3],其防病機制包括競爭作用、誘導植物抗性和拮抗作用等方面,在植物病害防治方面具有廣泛的應用[4-5]。研究發現,枯草芽孢桿菌對香蕉枯萎病、小麥紋枯病、煙草赤星病等真菌性病害,煙草青枯病等細菌性病害和煙草花葉病毒等病毒性病害均有較好的防治效果[6]。木霉是國內外食用菌大規模人工栽培和菌種生產中為害嚴重的一種真菌性病害[7-8],其適應性強,繁殖速度快,可侵害香菇、杏鮑菇、黑木耳等食用菌,造成嚴重減產甚至絕收[9-10]。筆者所在實驗室前期篩選獲得一株木霉拮抗菌枯草芽孢桿菌me-1,能有效防治食用菌綠霉病。為提高拮抗菌me-1對綠霉病的防治效果,筆者通過單因素試驗法和均勻設計法相結合的方式對枯草芽孢桿菌的發酵培養基進行優化,并以OD600為指標繪制其生長曲線,旨在為菌株me-1的規模化生產提供理論依據。
1?材料與方法
1.1?材料
1.1.1?供試菌株。供試病原真菌長枝木霉(Trichoderma longibrachiatum)和供試菌株枯草芽孢桿菌(Bacillus subtilis)為筆者前期研究分離。
1.1.2?供試培養基。供試細菌與真菌的培養分別采用LB培養基、馬鈴薯瓊脂葡萄糖(PDA)培養基。種子培養液為LB液體培養基,發酵初始培養基:葡萄糖20 g/L、蛋白胨10 g/L、NaCl 10 g/L、pH 7.2。
3?討論
目前,關于微生物培養基優化的方法有單因子設計、正交設計、均勻設計、Plackett-Burman 設計等[15]。均勻設計(uniform design)是1978年由方開泰等[16]中國專家提出來的,其出發點是將設計點均勻地分散在試驗范圍內,所用試驗點不多卻能使積分值得到較好的近似,與正交設計不同,當試驗因素較多時可顯著減少試驗次數,其試驗結果不具有整齊可比性,但可結合回歸分析得到較為精準的結果[17-18]。
對拮抗菌的發酵條件進行優化可以提高其對相關病原菌的防治效果,而目前關于枯草芽孢桿菌對食用菌木霉的拮抗作用鮮有報道。高越等[19]通過單因子試驗和正交試驗相結合的方法對枯草芽孢桿菌GS8菌株的發酵條件進行了優化,優化后GS8菌株發酵濾液對葡萄炭疽病菌的抑制率提高13.1%。張璐等[20]通過單因子碳源、氮源試驗與正交試驗對發酵培養基成分進行優化,優化后枯草芽孢桿菌對芒果炭疽菌(Colletotrichum gloeosporioides)抑菌圈直徑達27.3 mm,較優化前提高了13.3 mm。陳丹等[21]通過單因子變量法和均勻設計法對菌株CZB40極暗黃鏈霉菌(Streptomyces fulvissimus)進行發酵條件研究,經優化后,菌株CZB40無菌濾液的10倍稀釋液對水稻紋枯菌絲生長抑制率最高,達94.85%,比優化前明顯提高。
該研究通過單因素試驗和均勻設計法對菌株me-1的發酵培養基進行了優化,最終選定可溶性淀粉為最優碳源,蛋白胨為最優氮源,CaCO3為最優無機鹽,并確定了其最優發酵培養基為可溶性淀粉35 g,蛋白胨20 g,水1 000 mL,pH 7.2,培養條件:30 ℃,150 r/min,接種量為7%。以優化后的培養基為液體發酵培養基,發現枯草芽孢桿菌發酵液過濾液對木霉的抑菌率達94.55%,比優化前提高了38.03%。選用優化后的培養基,繪制菌株生長曲線,結果表明,其發酵液培養3.0~3.5 d可使菌株me-1的菌量達到最大。該研究為枯草芽孢桿菌me-1的工業化生產以及食用菌綠霉病害的有效防治提供理論依據。
參考文獻
[1] 李睿,崔曦,汪新星,等.枯草芽孢桿菌微生態制劑的研究與應用進展[J].預防醫學論壇,2018,24(12):959-960,969-970.
[2] 張彩鳳.生防菌枯草芽孢桿菌的研究進展[J].現代農村科技,2015(21):47.
[3] ZHAO Q Y,RAN W,WANG H,et al.Biocontrol of Fusarium wilt disease in muskmelon with Bacillus subtilis Y?IVI [J].BioControl,2013,58(2):283-292.
[4] 關小紅.枯草芽孢桿菌Tpb55抗菌物質純化及特性的初步研究[D].北京:中國農業科學院,2008.
[5] YNEZ?MENDIZBAL V,VIAS I,USALL J,et al.Production of the postharvest biocontrol agent Bacillus subtilis CPA?8 using low cost commercial products and by?products[J].Biological control,2012,60(3):280-289.
[6]胡亞杰,韋建玉,盧健,等.枯草芽孢桿菌在農作物生產上的應用研究進展[J].作物研究,2019,33(2):167-172.
[7] 馬林,曲紹軒,王曉強,等.食用菌木霉的生防細菌鑒定及相關基因功能預測[J].江蘇農業學報,2016,32(3):528-533.
[8] 張旭,劉燦,生吉萍,等.食用菌致病木霉優良拮抗菌株的篩選及生理特性的初步研究[J].食品科學,2012,33(1):186-190.
[9] 吳曉金.食用菌栽培相關木霉的調查和分析[D].福州:福建農林大學,2008.
[10] 王晶.食用菌病害的調查與新病害病原鑒定研究[D].沈陽:沈陽農業大學,2010.
[11] 劉春紅,張麗霞,李 燕,等.枯草芽胞桿菌B201產芽孢培養基優化[J].中國生物防治學報,2016,32(5):650-656.
[12] 胡亮亮,徐漢虹,廖美德.膠凍樣類芽孢桿菌PS04產抗真菌物質培養條件的優化[J].華中農業大學學報,2011,30(3):276-279.
[13] 朱宏建,歐陽小燕,周倩,等.一株辣椒尖孢炭疽病菌拮抗菌株的分離鑒定與發酵條件優化[J].植物病理學報,2012,42(4):418-424.
[14] 方開泰.均勻試驗設計的理論、方法和應用——歷史回顧[J].數理統計與管理,2004(3):69-80.
[15] 代志凱,張翠,阮征.試驗設計和優化及其在發酵培養基優化中的應用[J].微生物學通報,2010,37(6):894-903.
[16] 李澤.方開泰、王元首創“均勻設計”法[M]//《中國精神文明年鑒》編輯部.中國精神文明年鑒:1993-1994.北京:學習出版社,1995.
[17]左斌,胡超,謝達平.均勻設計對大腸桿菌產谷氨酸脫羧酶培養基優化的應用[J].湖南農業大學學報(自然科學版),2008,34(5):531-533.
[18] 石小丹,李嘯,張松,等.均勻設計法優化重組大腸桿菌產酮基還原酶培養基[J].天津農業科學,2015,21(6):1-6.
[19] 高越,馬貴龍,臧超群,等.葡萄炭疽病生防菌株GS8發酵培養基及發酵條件的優化[J].吉林農業大學學報,2015,37(4):411-416.
[20] 張璐,齊希猛,劉婷婷,等.一株拮抗芒果炭疽菌海洋細菌的鑒定和發酵培養基優化[J].廣東海洋大學學報,2011,31(4):75-80.
[21] 陳丹,葉波,劉燕娟,等.水稻紋枯病菌拮抗菌CZB40的篩選、鑒定及其發酵條件優化[J].植物保護,2015,41(5):46-53.

