低溫對腋路臂叢神經阻滯羅哌卡因半數有效濃度的影響
張忠其 林卓鵬 劉 念 張奕文 邢祖民
外周神經阻滯與全身麻醉相比,在不良反應的發生率和術后鎮痛需求方面具有一定優勢。研究[1-2]發現,使用不同溫度的局部麻醉藥進行外周神經阻滯,能影響其麻醉起效時間和維持時間。本研究團隊的前期研究[3]結果顯示,使用低溫低容量局部麻醉藥羅哌卡因進行臂叢神經阻滯能產生更強的麻醉作用,且麻醉起效時間更快,維持時間更長。上述研究結果表明,使用低溫局部麻醉藥羅哌卡因進行神經阻滯具有一定優勢,但用于神經阻滯的最適宜濃度目前鮮見報道。本研究通過Dixon-Massey法比較經超聲引導下腋路臂叢神經阻滯低溫(4 ℃)與室溫(23 ℃)羅哌卡因的半數有效濃度(EC50),旨在為外周神經阻滯時局部麻醉藥的使用方法提供參考。
1 對象與方法
1.1 研究對象 本研究已經在中國臨床中心注冊(注冊號:ChiCTR1800016721),經醫院倫理委員會批準,并由患者或家屬簽署麻醉知情同意書。選擇2018年6—10月在南方醫科大學順德醫院和順德和平外科醫院擇期行單側手部手術的患者60例,均為美國麻醉醫師協會(ASA)分級Ⅰ或Ⅱ級,隨機分為2組,每組30例。低溫組麻醉藥物為4 ℃羅哌卡因+1 μg/kg右美托咪定,室溫組麻醉藥物為23 ℃羅哌卡因+1 μg/kg右美托咪定,每組容量定量為25 mL。排除標準:無本研究所用藥物過敏史,無經腋路臂叢神經阻滯禁忌證,近期無使用其他鎮痛藥物史等。
1.2 麻醉方法 手術室溫度設定在23 ℃,所有患者入手術室后均予常規吸氧并連接多功能監護儀監測平均動脈壓(MAP)、心率、心電圖(ECG)與脈搏血氧飽和度(SpO2),并使用加溫系統(溫度設置為40 ℃),將測溫探頭置于患者前額,持續監測前額皮膚的體表溫度。常規開放外周靜脈通道,患者取仰臥位,上肢外展90°。神經阻滯技術操作參照前期研究[3],注射藥液為0.9%氯化鈉溶液稀釋的羅哌卡因混合右美托咪定25 mL。低溫組術前預先配制藥液,密封無菌保存于4 ℃冰箱30 min~1 h;室溫組使用手術室溫度保存的已配制好的藥液。注藥后每5 min測定橈神經、正中神經、尺神經和肌皮神經皮膚阻滯區域的痛覺疼痛感覺(針刺痛覺評分標準: 0分,正常;1分,痛覺減退;2分,痛覺消失)。記錄痛覺消失時間,即阻滯起效時間;痛覺消失(2分)至正常(0分)的時間,即阻滯維持時間。兩組初始的羅哌卡因濃度設定為0.5%,采用Dixon-Massey法確定下一患者羅哌卡因濃度。若阻滯開始至30 min內感覺神經被阻滯至能滿足手術切皮要求則定義為“成功”,否則定義為“失敗”。如“成功”,下一患者則降低一個濃度,相反則升高一個濃度,相鄰濃度相差比值為1.2。對神經阻滯效果不全的患者,加用舒芬太尼0.1~0.2 μg/kg靜脈注射行強化麻醉,仍不能滿足手術要求者,改行全身麻醉。鎮靜評分(Ramsay法)標準:1分,焦慮、煩躁;2分,安靜;3分,對指令有反應;4分,睡眠狀態但可喚醒;5分,對大聲刺激反應表現遲鈍;6分,無反應。鎮靜評分≥5分定義為過度鎮靜。以術中心率和血壓降低為基礎值的20%定義為心率減慢和血壓降低;以術中SpO2低于90%定義為呼吸抑制;以前額皮膚體表溫度低于36 ℃為低體溫。當出現心率減慢或血壓降低時,給予阿托品或麻黃素;當出現呼吸抑制時,充分給氧,必要時予正壓通氣。
1.3 觀察指標 按順序記錄所有患者的用藥濃度,記錄入手術室和神經阻滯30 min后的MAP、心率,記錄阻滯起效時間、阻滯維持時間和不良反應(惡心、嘔吐、寒戰、低體溫、注射痛、過度鎮靜、呼吸抑制、低血壓、心動過緩、止血帶反應)。

2 結 果
2.1 一般資料比較 兩組間的性別構成、ASA Ⅰ/Ⅱ分級構成、年齡、身高、體重、手術時間、阻滯維持時間的差異均無統計學意義(P值均>0.05), 低溫組阻滯起效時間顯著短于室溫組(P<0.05)。見表1。

表1 兩組患者一般資料比較 (N=30)
與室溫組比較:①P<0.05
2.2 阻滯前后30 min的MAP和心率比較 兩組間神經阻滯前和阻滯后30 min MAP和心率的差異均無統計學意義(P值均>0.05);兩組阻滯后30 min的MAP和心率均顯著低于同組阻滯前(P值均<0.05)。見表2。
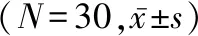

組別MAP(mmHg)阻滯前阻滯后30 min心率(次/min)阻滯前阻滯后30 min低溫組96.3±10.581.8±8.7①72.0±11.964.8±8.2①室溫組98.9±11.379.2±8.8①70.1±14.162.7±9.6②
1 mmHg=0.133 kPa。與同組阻滯前比較:①P<0.01,②P<0.05
2.3 不良反應比較 兩組患者均未發生惡心、嘔吐、低體溫、過度鎮靜、呼吸抑制等不良反應。低溫組發生寒戰1例、注射痛3例、低血壓2例、心動過緩3例、止血帶反應2例,室溫組發生低血壓1例、心動過緩1例、止血帶反應4例,兩組間不良反應發生情況的差異均無統計學意義(P值均>0.05)。
2.4 羅哌卡因EC50值比較 低溫組羅哌卡因的EC50為0.154%(95%CI為0.124%~0.191%),室溫組羅哌卡因的EC50為0.219%(95%CI為0.180%~0.267%),兩組間的差異有統計學意義 (Z=2.674,P=0.008)。低溫組和室溫組均有11例患者阻滯失敗,室溫組的失敗患者的羅哌卡因濃度普遍高于低溫組。見圖1、2。
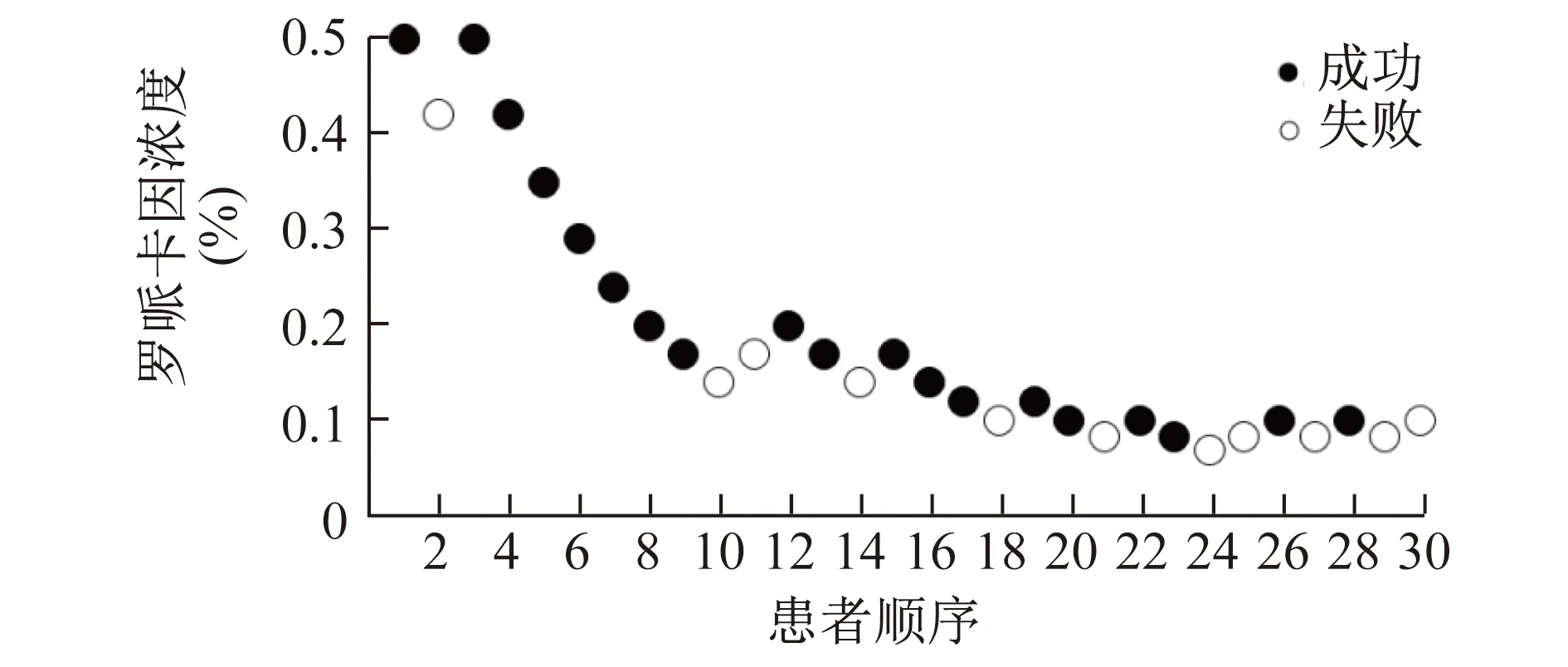
圖1 低溫組患者腋路臂叢神經阻滯結果
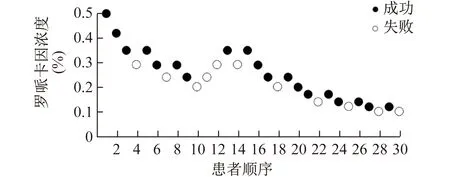
圖2 室溫組患者腋路臂叢神經阻滯結果
3 討 論
低溫本身不能產生麻醉作用,但是低溫能使組織局部血管收縮,作用于神經產生局部麻醉樣效應。有研究[4-6]結果顯示,使用不同溫度的局部麻醉藥進行外周神經阻滯,所需的藥物濃度、劑量、起效時間和維持時間都有所不同。溫度越低,阻滯神經所需要的局部麻醉藥濃度越低[5]。認為其可能的原因是局部麻醉藥的解離常數隨著溫度的降低而增加,當局部麻醉藥在低溫下注射,將以更多的離子化形式存在,使之能更好地穿透神經纖維,加快麻醉起效時間,增強麻醉效能[7]。本研究結果顯示,低溫(4° C)比室溫(23 °C)更能降低阻滯所需羅哌卡因EC50(0.154%比0.219%,P<0.05);經過低溫處理后的局部麻醉藥用于臂叢神經阻滯能明顯降低局部麻醉藥所需的濃度,且這種下降比例達29.7%。
目前,臨床上通常將右美托咪定作為一種佐劑添加至局部麻醉藥中,以增強麻醉效果,但可能會發生患者心率減慢、血壓降低等不良反應[8]。Keplinger等[9]研究發現,局部麻醉藥中添加右美托咪定進行外周神經阻滯,感覺阻滯的平均持續時間、鎮靜程度與右美托咪定呈劑量依賴性,認為添加100 μg右美托咪定的鎮靜和阻滯效果最佳。本研究在羅哌卡因中加入右美托咪定劑量1 μg/kg,所有患者總劑量并未超過100 μg,所有患者均未出現過度鎮靜現象。右美托咪定具有穩定血流動力學的作用,但是本研究加入1 /mg/kg右美托咪定阻滯30 min后,低溫組與室溫組間MAP和心率的差異無統計學意義,可見不同溫度的局部麻醉藥對血流動力學并無影響;然而,兩組阻滯后30 min MAP和心率均較本組基礎值顯著降低,但降低值均在可接受范圍內。不良反應方面,低溫組分別有2例低血壓和3例心動過緩,兩組間不良反應發生情況的差異無統計學意義,但是仍需注意防范術中可能出現血流動力學不穩定。因此,為了降低不良反應的發生率,可考慮進一步減少混合的右美托咪定劑量。另外,本研究采用不同濃度羅哌卡因,通過序貫圖發現,低溫組使用低濃度羅哌卡因的患者數量更多、起效時間顯著縮短,但兩組間阻滯維持時間的差異無統計學意義。因此,使用同等濃度不同溫度的羅哌卡因進行外周神經阻滯的阻滯起效時間和維持時間可能存在更大的差異。
低溫注射可產生更多的寒戰和注射痛,Hogan等[10]的meta分析結果顯示,注射痛的產生與注射速度、注射部位、注射藥物溫度和參與者年齡等密切相關,將局部麻醉藥的溫度升高能明顯降低注射痛的發生率。本研究中低溫組有3例注射痛患者,室溫組無1例注射痛患者,兩組間的差異無統計學意義,在臨床麻醉操作過程中可通過減慢注藥速度以減少注射痛的發生。也有研究使用更高溫度的局部麻醉藥,發現能同時加快感覺與運動阻滯起效時間[11],并有效降低寒戰發生率[12]。本研究使用低溫羅哌卡因注射過程中僅1例患者發生寒戰,體溫監測過程中并未發生低體溫現象,可能的原因:①低溫局部麻醉藥使用容量較小,不足以影響體溫變化;②整個圍術期給予患者適當的保溫措施。
本研究的局限性:①Dixon-Massey法最大的優勢是利用最小的樣本量即可得到較準確的結果[13],但每次得出的羅哌卡因濃度作為一個獨立的結果會影響下一個濃度的選擇,最終的結果可能會因為個體對疼痛的敏感程度不同導致結果不準確,所以需要更多的樣本量,才能得出更準確的結果;②在臨床麻醉神經阻滯過程中人為操作失誤,也可能造成結果不準確,例如,低溫組第2例患者,使用較高的羅哌卡因濃度(0.42%)阻滯失敗,可能為操作失誤,也可能是其自身體質的原因。
綜上所述,使用低溫(4 °C)羅哌卡因行臂叢神經阻滯比使用室溫(23 °C)更能降低羅哌卡因EC50,且無明顯不良反應,值得在臨床推廣應用。

