顯微手術下廣泛性切除低分化膠質瘤的效果
康國創(chuàng) 韋 祎 李學文 閆前錦 何兵孝 李安民
膠質瘤是1種顱內惡性腫瘤,約占顱內腫瘤的一半左右[1]。該病在臨床上具有發(fā)病率、復發(fā)率、死亡率高及治愈率低等特點,早期診治能顯著提高患者的生存率。不過膠質瘤的腫瘤呈浸潤性生長,向腦組織外呈指狀深入破壞腦組織,多數不限于1個腦葉,對于手術治療的要求比較高[2-3]。膠質瘤手術治療的原則是最大程度維持腦組織的正常功能,最大限度切除腫瘤,防止其擴散,減少術后腫瘤復發(fā)[4-6]。不過傳統(tǒng)手術常會損傷運動皮質功能區(qū)、錐體束或弓狀束等重要功能結構,容易導致術后出現視野缺損、失語、肢體癱瘓等并發(fā)癥,可嚴重影響患者的生活質量[7]。當前隨著影像學技術的發(fā)展,特別是神經導航技術的出現這使得膠質瘤顯微手術的具有可行性[8]。神經導航技術是影像學技術、立體定向技術、人工智能技術和微創(chuàng)手術結合的產物,在術前可把患者的影像學信息與實際手術部位進行顯示,可顯示病灶切除范圍,也可將病灶的三維空間位置與毗鄰關系準確地顯示出來,可提高病變的完全切除率,改善患者的預后[9-11],不過在膠質瘤中的應用還不多見。本文具體探討了顯微手術下廣泛性切除低分化膠質瘤的效果,以促進改善患者預后。現總結報告如下。
1 資料與方法
1.1 資料
對我院在2016年2月至2017年11月診治的79例低分化膠質瘤患者,納入標準:根據臨床癥狀明確診斷為膠質瘤,病理學確診為低分化膠質瘤,具有手術指征;患者具備良好合作的意愿和能力;占位病變累及或者靠近功能區(qū);年齡為18~65歲;首次進行顱內手術操作;術前未進行活檢、放化療等輔助治療;臨床與病理學資料完整;預計生存期≥3個月。排除標準:體內植入性心臟除顫器者;精神心理異常者;合并心、肺、骨髓功能損害;既往有腦栓塞和腦出血病史。
根據手術方法的不同分為觀察組50例與對照組29例,兩組患者的臨床分期、體重指數、病灶部位、性別、年齡等對比差異不顯著(P>0.05)。見表1。

表1 兩組一般資料比較
1.2 手術方法
手術由一組有經驗的神經外科主任醫(yī)師對患者進行手術治療。對照組:給予常規(guī)手術治療,不進行神經導航。觀察組:給予基于神經導航的顯微手術廣泛性切除治療,采用氣管插管麻醉,將導航參考架固定在頭架上。根據患者的面部特征進行導航并連接顯微鏡,可把患者術前的影像學信息與患者手術部位的實際位置進行對比。先切除將距離功能區(qū)或者錐體束較遠的病變,然后切除靠近功能區(qū)或者錐體束的病變。行術中MRI成像掃描來判斷腫瘤的切除程度,如腫瘤仍有殘留,則同術前方法將殘余腫瘤勾劃出來,并重建錐體束,直到腫瘤已經達到了術前計劃的切除范圍或者全切。
1.3 觀察指標
①膠質瘤切除程度分級。Ⅰ級:腫瘤擴大切除或瘤床周圍術中病理檢查無腫瘤細胞;Ⅱ級:腫瘤全切除僅限于手術切除,術中沒有病理學證實手術區(qū)全切腫瘤;Ⅲ級:腫瘤全切除但重要神經功能區(qū)疑似或有少許腫瘤殘留;Ⅳ級:腫瘤大部分切除,切除腫瘤≥80%以上;Ⅴ級:腫瘤部分切除或活檢。②肌力分級:在術后3個月進行判定。Ⅰ級:只有肌肉收縮,不能產生動作;Ⅱ級:肢體在創(chuàng)面上可以水平移動,不能抬離床面;Ⅲ級:肢體可以抬離床面,不能抗阻力;Ⅳ級:能夠抵抗重力和一定的阻力;Ⅴ級:正常肌力。③KPS與ECOG評分:在術后1 d與術后3個月后進行KPS與ECOG評分,KPS評分越高,ECOG評分越低,疾病狀況越好。④生存情況:所有患者隨訪至今,記錄患者術后1年生存率。
1.4 統(tǒng)計學方法
應用SPSS 22.00分析,研究結果以均數±標準差或%表示,采用t或χ2檢驗,采用Kaplan-Meier計算總生存率,對比采用Log-rank檢驗,檢驗水準為α=0.05,P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 切除程度分級對比
兩組膠質瘤切除程度分級對比差異無統(tǒng)計學意義(P>0.05),主要為Ⅰ~Ⅱ級。見表2。

表2 兩組膠質瘤切除程度分級對比/例
2.2 肌力分級對比
術后3個月觀察組的肌力分級狀況顯著好于對照組(P<0.05),多為Ⅳ~Ⅴ級,見表3。

表3 兩組術后3個月的肌力分級對比/例
2.3 分析兩組的KPS與ECOG評分
術后1 d,兩組的KPS與ECOG評分比較差異不顯著,術后3個月,兩組的以上評分均得到改善,且觀察組的KPS與ECOG評分均優(yōu)于對照組(P<0.05),見表4。
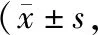
表4 兩組術后不同時間點KPS與ECOG評分對比分)
2.4 生存率對比
術后隨訪1年,觀察組的生存率為86.0%(43/50),顯著高于對照組的62.1%(18/29)(P<0.05)。
3 討論
膠質瘤起源于神經膠質細胞,常呈浸潤性生長、病死率高。其中低分化膠質瘤包括Ⅰ級和Ⅱ級膠質瘤,通過對腫瘤的手術切除,可以達到減輕腫瘤占位效應與改善預后的目的[12]。手術切除程度的提高不僅能夠減輕膠質瘤患者對進一步治療的反應,還能夠延遲膠質瘤的復發(fā),延長患者的生存期[13]。不過很多患者在術后仍有腫瘤細胞殘留在正常組織中,術后容易復發(fā),導致預后更差[14]。最大程度的切除腫瘤是膠質瘤取得良好治療效果的關鍵[15]。顯微手術是根據術前影像學資料設計手術切口,手術時經正常腦溝入路,松解腦表面的蛛網膜,釋放腦脊液,利用骨窗而減少腦組織暴露,從而對神經功能具有一定的保護作用;其也可以最大程度減少了腫瘤細胞的數量[16-17]。本研究顯示:兩組膠質瘤切除程度分級對比差異無統(tǒng)計學意義,主要為Ⅰ級與Ⅱ級;術后3個月觀察組的肌力分級狀況顯著好于對照組,多為Ⅳ級~Ⅴ級,表明顯微手術對周圍結構的損傷小,可以將手術損傷程度降至最低,且不會降低腫瘤切除程度。不過基于神經導航的顯微手術也同樣存在誤差,包括系統(tǒng)誤差與結構誤差等,為此在臨床上對于手術操作具有嚴格的要求。并且腦功能區(qū)膠質瘤因為其生長部位的特殊性,如果一味擴大切除可能會損傷錐體束、皮層運動功能區(qū)等重要功能結構,不利于患者康復[18]。
膠質瘤是最常見的惡性原發(fā)性顱內腫瘤,也是高度血管化腫瘤。伴隨著社會醫(yī)學模式的改變,膠質瘤手術治療的目的不僅局限于對臨床病情的控制或緩解上,患者術后生活質量的改善也成為評價手術療效的重要指標[19]。本研究顯示術后1 d,兩組的KPS與ECOG評分比較差異不顯著,術后3個月,兩組的以上評分均得到改善,且觀察組的KPS與ECOG評分均優(yōu)于對照組。從機制上分析,顯微手術能夠更準確、更清晰、更直接的辨別腫瘤組織、腫瘤增生帶、瘤周組織水腫帶和正常腦組織,可分辨、保護重要引流靜脈,既可以做到鏡下腫瘤全切除,術中也可迅速的止血[20]。并且由于顯微手術創(chuàng)傷小,對周邊正常腦組織直接損傷輕微,術后癥狀改善顯著,恢復較快,有利于增強患者治療信心,從而有利于改善患者的生存質量[21-22]。
多數膠質瘤患者的預后較差,平均生存期僅為3年左右。手術的目的是最大程度的保留神經系統(tǒng)功能,延長患者生存時間[23]。傳統(tǒng)手術時為了術中準確的顯示腫瘤,需要暴露大面積的腦組織,不利于改善患者的預后[24]。本研究顯示術后隨訪1年,觀察組的生存率為86.0%,顯著高于對照組的62.1%。從機制上分析,顯微手術治療膠質瘤的原則是先從瘤內吸除腫瘤組織,周圍結構的損傷小,可以將手術損傷程度降至最低,從而降低復發(fā)率和病死率[25]。不過本研究也有一定的不足,病例樣本過少,且隨訪時間比較短,術后并發(fā)癥也沒有進行分析,還需要進一步收集手術病例資料進行分析。
總之,顯微手術下廣泛性切除低分化膠質瘤能得到很大的切除效果,促進患者術后肌力改善,提高患者的生活質量,降低患者的隨訪死亡率。

