非小細胞肺癌的新曙光:抗血管生成治療聯合免疫治療
周建婭 阮柯欣
近年來,腫瘤發病率和死亡率在全球范圍內迅速增長,根據GLOBOCAN2018癌癥報告,2018年全球癌癥新發病例約為1 800萬例,死亡病例約960萬例[1]。肺癌年發病例約為210萬例,年死亡病例約180萬例,被稱為腫瘤“第一殺手”,其中男性是肺癌發病率較高人群[1]。肺癌包括小細胞肺癌(small cell lung cancer,SCLC)和非小細胞肺癌(non-small cell lung cancer,NSCLC),其中SCLC約占15%,NSCLC約占85%。多數患者初次確診時已屬晚期,常因腫瘤轉移而失去手術機會,而晚期肺癌患者5年生存率僅為4%[2]。近年來肺癌精準治療發展迅速,使得表皮生長因子受體(EGFR)、間變型淋巴瘤激酶(ALK)和C-ROS原癌基因1酪氨酸激酶(ROS1)等驅動基因異常的肺癌患者有了相應的酪氨酸激酶抑制劑(TKI)可供治療選擇,但這些藥物僅能使部分人群獲益[3]。如EGFR基因突變在亞裔不吸煙女性患者中的比例約為50%,而在高加索人群中僅10%~20%的肺腺癌患者發生EGFR基因突變。免疫檢查點抑制劑(以下簡稱免疫治療)可通過選擇性抑制程序性死亡受體1(PD-1)/程序性死亡配體 1(PD-L1)通路,激活殺傷 T淋巴細胞產生抗腫瘤活性。因其具有普適性及有效性,在腫瘤治療領域迅速占據了重要地位,改變了多種惡性腫瘤的治療模式,使部分晚期腫瘤患者獲得了長期療效。在KEYNOTE024臨床研究中,采用帕博利珠單抗治療晚期肺癌患者,其無進展生存期(PFS)為10.3個月,較傳統化療(6.0個月)明顯延長,死亡風險也降低了40%,因此被美國食品藥品監督管理局批準用于PD-L1高表達晚期NSCLC的一線治療[4]。但仍有半數以上的患者難以從免疫治療中獲益,尤其是PD-L1低表達的人群。
通過出芽方式形成新生血管是腫瘤的特征之一,抗血管生成藥物可以通過阻斷新生血管的形成起到抗腫瘤治療的作用,也可以逆轉腫瘤微環境的免疫抑制狀態,為免疫治療打好基礎。使用抗血管生成藥物可以使腫瘤內血管存在一段“正常化”的時間窗,期間可加強免疫治療藥物及免疫細胞的運輸,提高免疫治療的療效,從而增強抗腫瘤效果。因此,抗血管生成治療聯合免疫治療有望成為一種新的治療選擇。
1 血管生成
血管生成是一個復雜的過程,受許多信號通路的調節,在胚胎的發育、成人的月經周期和病理性損傷后修復等活動中起著重要作用。雖然在生理過程中也存在血管生成,但是腫瘤的新生血管在功能和結構上與正常血管不同。
Folkman提出的出芽式血管生成模型被認為是腫瘤血管生成的主要形式。在出芽式血管生成模型中,內皮細胞通過改變表型轉化為具有不同結構和功能的尖端細胞和柄細胞。它們的增殖、遷移和融合形成了新生血管腔。血管周細胞緊貼于內皮細胞之外,起著保持微血管穩定、調節內皮細胞功能等作用。由于血管生成因子和抗血管生成因子的失衡,導致了內皮細胞的大量增殖和遷移,異常增多的內皮細胞和血管周細胞形成了高通透性的管狀和囊狀血管。在腫瘤血管中,血管周細胞的低覆蓋率導致了血管的高通透性,使得腫瘤血管內維持滲透壓的小分子持續流失,這種壓力梯度的減低最終影響了血流和大分子物質的運輸,造成腫瘤組織的缺氧,也影響了抗腫瘤藥物的運輸及其作用效果[5]。因此,許多腫瘤通過影響血管生成機制來刺激腫瘤的生長,從而導致疾病進展。
血管內皮生長因子(VEGF)家族是調控血管生長的重要因子。在哺乳動物中,VEGF家族中有5種異構體,分別為 VEGF-A、VEGF-B、VEGF-C、VEGF-D 及胎盤生長因子(PLGF)。這些蛋白對應3種酪氨酸激酶受體,即VEGFR1、VEGFR2和VEGFR3。在血管生成的前端是VEGF濃度最高的地方,VEGF結合內皮細胞上的VEGFR2,促進尖端細胞和柄細胞表型轉變,誘導尖端細胞遷移。VEGFR2激活下游ERK1/2信號通路后,受體將迅速清除配體并重新接受信號刺激。受體的這種迅速更新,有利于感受高濃度的VEGF并決定新生血管的走向[6]。
內皮細胞TEK酪氨酸激酶(Tie2)是一種在內皮細胞上高度表達的跨膜酪氨酸激酶受體,配體為血管生成素(Ang)1和Ang2。在內皮細胞中,Ang2與Tie2特異性結合后能抑制下游的信號通路,從而引起血管結構不穩定和新生血管對血管生成信號敏感性增強。在缺乏Ang1的未成熟腫瘤血管中,Ang2仍可通過激活Tie2上的整合素和下游信號通路促使尖端細胞的遷移[7]。
肝細胞生長因子(HGF)通過激活內皮細胞表面的間充質-上皮轉化因子(c-MET)信號通路促進細胞的存活、擴增和上皮間質轉化,加強細胞的運動和侵襲,促進血管生成,抑制內皮細胞凋亡[8]。目前已在多種腫瘤中發現,由于基因的異常擴增,轉錄的異常激活或缺氧等原因引起的c-MET及HGF過表達,且與不良預后相關[9]。
血小板衍生生長因子(PDGF)是由4種單鏈(PDGFA、PDGF-B、PDGF-C、PDGF-D)組成的二聚體,分別為PDGF-AA、PDGF-BB、PDGF-AB、PDGF-CC、PDGFDD。PDGF可誘導血管平滑肌細胞、結締組織成纖維細胞、血管周細胞等間充質細胞的有絲分裂和趨化。激活PDGF/PDGFR通路可直接影響腫瘤的增殖,血管內皮細胞的重構、活化和血管周細胞的募集等[10]。
2 抗血管生成治療
目前我國批準用于治療晚期NSCLC的抗血管生成藥物有貝伐珠單抗、重組人血管內皮抑制素和安羅替尼。
貝伐珠單抗是一種來自小鼠的人源化VEGF單克隆抗體,可特異性結合VEGF-A以阻斷其與VEGFR1和VEGFR2間的相互作用。Reck等[11]一項關于貝伐珠單抗的Ⅲ期臨床研究結果發現,雖然兩組患者總生存期(OS)無明顯差異,貝伐珠單抗劑量對療效的影響也較小,但15mg/kg貝伐珠單抗聯合吉西他濱/卡鉑的高劑量組(HR=0.82,95%CI:0.68~0.98,P<0.05)、7.5mg/kg貝伐珠單抗聯合吉西他濱/卡鉑的低劑量組(HR=0.75,95%CI:0.62~0.91,P<0.01)的中位 PFS 均優于吉西他濱/卡鉑對照組;藥物有效率也明顯提高(30.4%、34.1%比20.1%)。基于此研究,貝伐珠單抗被批準列入晚期NSCLC一線治療。
重組人血管內皮抑制素是在人內皮抑素的N端加上9個氨基酸的衍生物,具有內皮抑素結合VEGF和FGF2阻斷血管生成的作用,也能提高內皮抑素的穩定性,延長藥物半衰期[12-13]。在一項Ⅲ期臨床試驗中,使用重組人血管內皮抑制素聯合卡鉑/長春瑞濱治療晚期NSCLC患者,無論是在緩解率、臨床獲益率還是中位PFS上均優于安慰劑+卡鉑/長春瑞濱的患者[14]。
安羅替尼是針對 VEGFR1-3、FGFR1-4、PDGFR、RET和c-Kit等多個靶點的TKI,具有顯著的抗腫瘤效果[15]。ALTER0303是一項隨機對照、雙盲的Ⅲ期臨床試驗,結果顯示接受安羅替尼為三線藥物的晚期NSCLC患者可獲得更長的中位PFS和OS(均P<0.01)[16]。
目前仍有眾多針對NSCLC的抗血管生成藥物處于早期臨床試驗階段,如阻斷HGF/c-MET通路的奧那妥珠單抗[17]、影響ANG/TIE2通路的Trebananib及多靶點的TKI[18]。但上述抗血管生成藥物在短期有效后都會不可避免出現耐藥,患者難以長期獲益。因此,需要不斷探索新的聯合治療策略,使患者獲得長期受益。
3 免疫治療當機體識別外來抗原時,
免疫系統會激活免疫反應對其進行清除。腫瘤細胞通過逃避抗原呈遞細胞和常規T細胞對于腫瘤抗原的識別,從而抑制了毒性T細胞的激活。腫瘤通過募集調節T細胞等免疫檢查點機制來逃避免疫系統對其的清除,從而在體內增殖擴散。許多研究證明,免疫檢查點分子高表達的腫瘤患者往往預后不良。
PD-1是表達在NK細胞、B細胞、樹突狀細胞、單核巨噬細胞以及CD4+、CD8+T細胞表面的免疫檢查點分子[19]。PD-1與表達在某些腫瘤細胞和免疫細胞上的配體PD-L1結合,可以抑制T細胞的激活、增殖,促進T細胞的凋亡[19-20]。激活PD-1/PD-L1通路可以誘導CD4+T細胞向調節性T細胞分化,調節性T細胞通過表達Foxp3轉錄因子等機制引起免疫抑制。PD-1/PDL1通路激活后,還可以誘導腫瘤細胞對T細胞介導的細胞毒性及其他抗腫瘤作用形成抵抗[21],從而產生耐藥。抑制PD-1/PD-L1通路,可提高免疫細胞對腫瘤抗原的識別,激活CD8+T細胞對腫瘤細胞進行殺傷[22]。目前,阻斷PD-1/PD-L1通路的抗PD-1抗體(如帕博利珠單抗、納武利尤單抗)和抗PD-L1抗體(如阿特珠單抗、德瓦魯單抗)已作為免疫檢查點抑制劑,成為臨床治療NSCLC的藥物[23]。
另一類免疫檢查點分子表達在調節T淋巴細胞表面,以毒性T淋巴細胞相關蛋白4(CTLA-4)為代表。CTLA-4通過與抗原呈遞細胞表面的CD80/CD86受體競爭性結合,阻斷T細胞表達的CD28對抗原呈遞細胞的激活,從而抑制免疫反應。調節T細胞還可以通過分泌IL-10等趨化因子來誘導效應T細胞的凋亡[24],從而形成免疫抑制。
免疫治療的療效在不同患者中的差異很大。目前研究發現腫瘤浸潤淋巴細胞(TIL)可能與之相關。TIL是免疫治療發揮抗腫瘤效應過程中不可或缺的參與者。腫瘤微環境的炎癥狀態大致可分為3類:大量的活性淋巴細胞浸潤(熱腫瘤)、淋巴細胞圍繞在腫瘤邊緣無法浸潤到中心、沒有淋巴細胞浸潤(冷腫瘤)[25]。在有炎癥反應存在的微環境中,免疫治療對腫瘤的殺傷性是最大的。因此,如何聯合其他抗腫瘤治療改變患者免疫表型,使其獲益于免疫治療是進一步探索的方向。
4 聯合治療的基礎
抗血管生成治療和免疫治療的抗腫瘤效果與腫瘤所處的微環境息息相關[26]。在如何提高免疫治療效果的探索上,許多聯合治療策略著重于提高淋巴細胞對腫瘤的浸潤,進而改變腫瘤微環境的免疫抑制狀態,而抗血管生成治療就是其中之一[27]。
4.1 VEGF的免疫抑制 VEGF是血管生成過程中的關鍵因子,同時具有免疫抑制作用,故使用VEGF相關抑制劑可以在抗血管生成層面上進行抗腫瘤治療,也可以通過以下幾個方面逆轉腫瘤微環境的免疫抑制狀態,為免疫治療打好基礎。
VEGF作用于樹突狀細胞表面的VEGFR2,通過抑制NF-κB通路阻止樹突狀細胞的成熟,進而阻止腫瘤的抗原呈遞,導致腫瘤潛在的免疫逃逸。在許多惡性腫瘤患者中,高濃度VEGF與樹突狀細胞的缺乏或成熟障礙有關。通過對比接受貝伐珠單抗治療患者治療前后的血液樣本,發現治療后外周血中樹突狀細胞數量明顯增多[28]。
VEGF可以通過抑制胸腺中的造血干細胞向CD4+、CD8+T細胞分化而直接影響T細胞的功能。VEGF結合于T細胞表面的VEGFR2,不僅可以直接抑制T細胞的增殖和細胞毒性作用,還可以通過上調PD-1、CTLA-4、TIM3等免疫檢查點分子來抑制T細胞活性[29]。VEGF與外周血中的調節T細胞相關,轉移性腎透明細胞癌患者在使用舒尼替尼后,外周血中的調節T細胞數量較前明顯減少,且獲得了更長的OS[30]。VEGF可誘導腫瘤血管表達FAS抗原配體(FASL),引起在腫瘤中浸潤的CD8+T細胞凋亡,從而為腫瘤的免疫逃逸提供條件[31]。
血管內皮高表達的ICAM-1、VCAM-1和選擇素E可以協助免疫細胞在血管內皮上的黏附,并從血管移出進入微環境發揮殺傷腫瘤的作用。VEGF可通過下調內皮細胞的ICAM-1和VCAM-1或阻止它們在內皮細胞上聚集,從而抑制淋巴細胞在腫瘤中浸潤[32]。
4.2 Ang2的免疫抑制 Ang2募集表達Tie2的單核細胞并通過與Tie2結合,刺激單核細胞分泌IL-10。IL-10可誘導調節T細胞在腫瘤中的浸潤,抑制T細胞活性。在膠質母細胞瘤的小鼠模型中,使用Ang2和VEGF的阻斷劑可增加腫瘤組織中T細胞的浸潤且減少腫瘤相關巨噬細胞的數量,逆轉免疫抑制狀態[33]。Ang2還可以誘導M2型巨噬細胞表達PD-L1,從而抑制CD8+T細胞的殺傷作用[34]。
Ang2能介導趨化因子CCL2的分泌,誘導巨噬細胞在腫瘤中的浸潤,促進腫瘤的轉移[35]。在使用Ang2阻斷劑后發現內皮細胞上VCAM-1表達增加,間接證明了Ang2誘導VCAM-1下調,以此來阻止免疫細胞的浸潤[36]。
4.3 HGF的免疫抑制 HGF作用于樹突狀細胞表面的c-MET,可以抑制樹突狀細胞的抗原呈遞功能,還可以誘導T細胞分化為調節T細胞,進而分泌IL-10抑制腫瘤的免疫反應。HGF雖然能促進樹突狀細胞向淋巴結的遷移,但誘導了T細胞上CTLA-4的表達,從而抑制CD8+T細胞的激活[37]。并且通過抑制CD8+T細胞分泌IFNγ、穿孔素1和顆粒酶B等,進一步影響CD8+T細胞的殺傷作用[38]。
HGF可上調血管內皮細胞上穩定素1的表達,優先介導調節T細胞的遷移。在使用封閉穩定素1的單克隆抗體后的黑色素瘤小鼠模型中觀察到,腫瘤組織中的調節T細胞、M2型腫瘤相關性巨噬細胞等免疫抑制細胞明顯減少,并伴隨著腫瘤生長受限和轉移能力減弱[39]。由此可推測HGF通路可能與免疫抑制細胞的選擇和腫瘤轉移有關。
4.4 PDGF的免疫抑制 已有研究表明PDGFAB同樣可抑制樹突狀細胞的成熟。PDGFAB還可以上調未成熟樹突狀細胞表面表達的CLEC2受體,該受體與T細胞表面配體結合后可誘導調節T細胞的生成[40]。PDGFBB被證實可促進腫瘤組織間充質干細胞的增殖[41],而間充質干細胞具有免疫抑制作用,進一步促進腫瘤的生長和免疫逃逸。
4.5 免疫反應對血管生成的影響 腫瘤的血管生成可引起微環境的免疫抑制,相應的腫瘤免疫對于腫瘤血管生成也有一定影響。在抗VEGFR2治療耐藥的胰腺癌和乳腺癌小鼠模型中,發現腫瘤組織表達的PD-L1水平異常增高[42]。進一步研究發現內皮細胞的PD-L1對于血管生成有一定的調節作用。在體外實驗中,VEGFR2表達的增加與PD-L1的減少有關。這表明血管生成可能受到血管生成因子以外的細胞因子調節,同時這些細胞因子還可能與抗血管生成藥物的耐藥有關。
活化的CD8+T細胞分泌IFNγ作用于腫瘤基質中的受體1(IFNγR1)所引起的抗血管生成作用,可能是CD8+T細胞介導腫瘤清除的機制之一。IFNγ可以直接作用于內皮細胞,也可引起腫瘤相關成纖維細胞分泌的VEGF減少,從而導致血管的正常化或退化[43]。
5 聯合治療的臨床應用
免疫細胞分泌的IFNγ促進血管正常化,正常化的血管又可在腫瘤中運輸更多的免疫細胞和抗腫瘤藥物,由此可推測,免疫治療聯合抗血管生成治療在抗腫瘤治療中具有增效作用。
關于抗血管生成治療聯合免疫治療的臨床應用探索越來越多。Reck等[44]一項隨機、開放的Ⅲ期臨床試驗將1 202例轉移性NSCLC患者按照1∶1∶1的比例分成3組,分別為在卡鉑/紫杉醇化療的基礎上聯合阿特珠單抗(ACP組,402例)、貝伐珠單抗(BCP組,400例)以及阿特珠單抗、貝伐珠單抗(ABCP組,400例),比較3種治療方案給患者帶來的臨床收益。結果顯示在無EGFR突變的野生型患者中,無論PD-L1是否高度表達,ABCP組在中位PFS(8.4個月比6.8個月;HR=0.59,95%CI:0.50~0.69)和中位 OS(19.8 個月比 14.9 個月;HR=0.76,95%CI:0.63~0.93)上均優于 BCP 組,而藥物不良反應發生率比較差異無統計學意義;在EGFR基因突變及肝轉移的亞組中,ABCP組中位生存時間仍明顯優于BCP組。這項試驗直接證明了免疫檢查點抑制劑聯合抗血管生成藥物在轉移性NSCLC中具有增效作用。
Rizvi等[45]選取了接受一線鉑類化療滿4周期后42d內腫瘤無進展的NSCLC患者,進一步研究納武利尤單抗聯合貝伐珠單抗、單用納武利尤單抗作為后續治療的臨床效果。患者被隨機分入接受納武利尤單抗(5mg/kg,3周/次)+貝伐珠單抗(15mg/kg,3周/次)治療組和單用納武利尤單抗(3mg/kg,2周/次)治療組,直至疾病進展或患者發生不可耐受的不良反應。結果顯示聯合治療組中位PFS為37.1周,明顯優于單藥治療組(鱗癌患者16周,非鱗癌患者21.4周)。雖然聯合用藥的藥物不良反應發生率(92%)較單藥治療(62%)有所增高,但均未發生4級及以上的嚴重不良反應。
目前,抗血管生成藥物聯合免疫檢查點抑制劑在NSCLC中的臨床試驗正在開展。以下為登記在Clinical Trail網站上的、近期針對該類藥物所開展的部分臨床試驗,見表1。
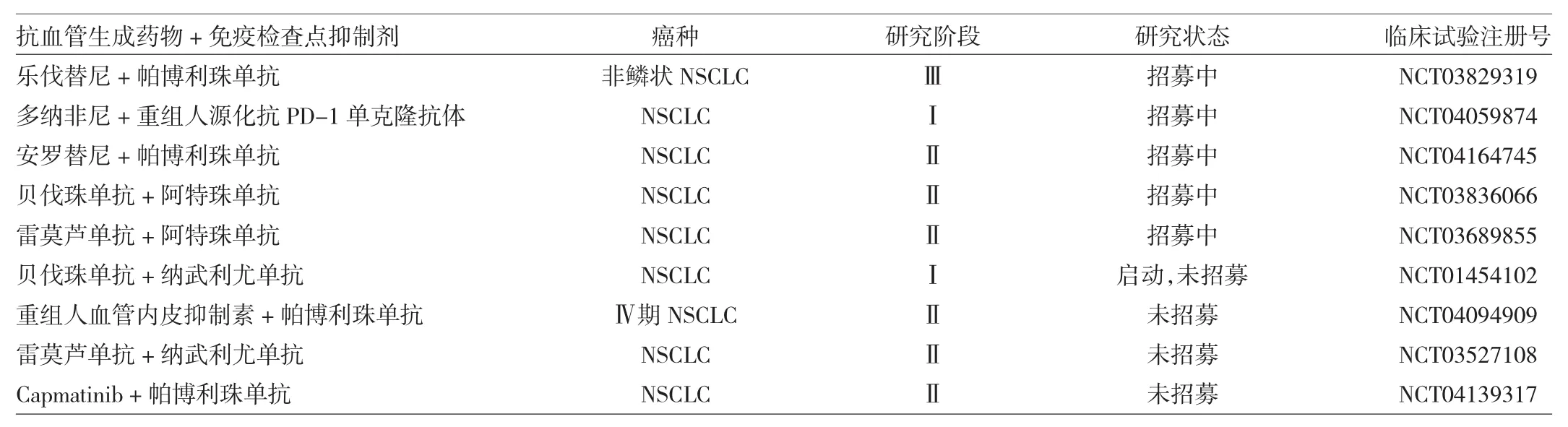
表1 近期針對抗血管生成藥物聯合免疫檢查點抑制劑開展的部分臨床試驗
6 展望
越來越多研究表明抗血管生成聯合免疫治療可以使NSCLC患者獲得更好的臨床受益,但目前對其相關機制的認識仍是冰山一角。如何選擇最佳的聯合治療藥物方案,如何選擇聯合治療的時間和最佳藥物劑量,如何篩選可能獲得最大受益的患者群體,如何選擇對預后有影響的評價指標和生物標志物等等,都需要更多研究加以探討。

