乙酰甲胺磷酸堿解離常數的測定
方倩囡,宋德安,孔凡玉
(中國農業科學院煙草研究所,山東青島 266101)
1972年,美國雪佛龍公司研究開發了一種新型有機磷農藥——乙酰甲胺磷(acephate),此后,乙酰甲胺磷在世界范圍內進行大規模的工業化量產,現已成為世界上銷售量最大的十種有機磷農藥之一[1]。作為高毒農藥甲胺磷的替代品,乙酰甲胺磷是一種高效、低毒、內吸性強的廣譜型殺蟲劑,能明顯抑制蚜科(煙草蚜蟲、小麥芽蟲)、鱗翅目(番茄斜紋夜蛾、棉花棉鈴蟲、茶樹茶尺蠖、玉米螟)、膜翅目(杜鵑三節葉蜂、黃連木種子小蜂)等害蟲對農作物的危害[2-3]。乙酰甲胺磷純品的大鼠急性經口半數致死量為823 mg/kg,工業品的大鼠急性經口半數致死量為945 mg/kg,其毒性僅為甲胺磷的1/50[4]。
酸堿解離常數(pKa)又稱解離平衡常數,定義為在一定溫度下弱電解質達到電離平衡狀態時,已解離的離子濃度的乘積與未解離分子濃度的比值。酸堿解離常數是與農藥溶解度和pH值密切相關的理化常數,也是探究農藥酸堿性等理化性質的重要信息[5-6],在評價其對環境和人體健康的影響方面具有十分重要的意義。測定化學物質解離常數的方法目前主要有以下幾種:①紫外分光光度法;②電泳法;③熒光法;④電導率法;⑤電位滴定法。紫外分光光度法操作簡單、方便快捷,精密度高且重現性好,后期數據處理方便,特別適用于弱酸(堿)性物質解離常數的測定。
本實驗根據紫外分光光度法測定解離常數(pKa)的原理,首次采用紫外分光光度法及A-pH曲線法結合Sigmoidal數理模型擬合分段測定了乙酰甲胺磷的pKa1和pKa2值,并從分子基團的角度解釋其水解特性,對指導乙酰甲胺磷的合理使用,評價其環境安全性以及減少對環境的負面效應具有重要意義。
1 材料與方法
1.1 實驗原理
水溶性農藥在水溶液體系中可以發生電離,以弱酸類農藥HZ為例,將HZ溶解到水中,形成HZ穩定水溶液,HZ在水中達到電離平衡狀態HZ=H++Z-,因此HZ在水溶液中解離常數,此等式兩邊同時取負對數,得到酸堿解離常數計算公式。

式中:HZ為共軛酸,Z-為共軛堿。
紫外分光光度法測定農藥的pKa具有一定條件要求:首先HZ和Z-均有紫外吸收,用紫外分光光度計可以測得具體數值;另外在同一酸堿條件下HZ和Z-的紫外吸收光譜呈現出明顯的差異性。實際測定時,配置一系列濃度相等的農藥水溶液,通過酸堿溶液KOH和HCl調節以上溶液體系的pH值:①將一部分農藥溶液pH值調節到7左右,讓溶液中的農藥以HZ和Z-兩種形式存在;②用HCl將另一部分農藥溶液pH值調節至酸性條件,此時水溶液中的農藥主要以HZ的形式存在;③用KOH將另一部分農藥溶液pH值調節至堿性條件,此時水溶液中的農藥主要以Z-的形式存在。設農藥的濃度為C,溶液中HZ的濃度為CHZ,Z-的濃度為CZ-。Abase是堿性條件下的吸光度,Aacid是酸性條件下的吸光度,Aobs是中性條件下的吸光度。如果HZ與Z-的紫外吸收均符合吸收定律,那么:


根據式(2)即可計算出農藥的pKa值[7]。
1.2 實驗試劑與儀器
SPECORD200型紫外分光光度計,德國耶拿分析儀器股份公司;PHS-3C酸度計,上海雷磁儀器廠,使用前在pH值4.00、6.86和9.18處校準;乙酰甲胺磷(純度99%);KOH、HCl和KCl均為分析純,北京國藥化學試劑有限公司;實驗用水為蒸餾水。
1.3 實驗方法
乙酰甲胺磷溶液的配制:稱取乙酰甲胺磷原藥0.018 3 g,置于100 mL容量瓶中,加入蒸餾水溶解并定容,即得到濃度為1 mmol/L的乙酰甲胺磷溶液。
緩沖溶液:0.1 mol/L HCl與0.1 mol/L NaOH溶液按不同的比例進行混合,制備成pH值為2.87~8.12的一系列溶液,加入乙酰甲胺磷溶液中,并加入2 mol/L KCl溶液0.25 mL控制離子強度。
分別將不同pH值的乙酰甲胺磷溶液置于1 cm吸收池中,以對應的pH值溶液做空白對照,在210~250 nm波長范圍內掃描,得到不同pH值的乙酰甲胺磷溶液的紫外吸收光譜。選擇合適波長處測定不同pH值的乙酰甲胺磷溶液的吸光度值,利用Origin 9.0軟件擬合曲線求出乙酰甲胺磷的解離常數[8]。
2 結果與分析
2.1 測定波長的選定
圖1為不同pH值條件下乙酰甲胺磷溶液的210~250 nm紫外吸收光譜圖,可以看出pH值為2.21~4.98的溶液的紫外吸收光譜基本重合,可以認為pH值在4.98以下,乙酰甲胺磷基本上以分子形式存在;pH值為9.61~12.13的緩沖溶液的紫外吸收光譜基本重合,可以認為pH值在9.61以上,乙酰甲胺磷基本上以離子形式存在;pH值為4.98~9.61,乙酰甲胺磷一部分以分子狀態存在,一部分以離子狀態存在。

圖1 乙酰甲胺磷在不同pH值的緩沖溶液中的紫外吸收光譜
乙酰甲胺磷在波長210 nm、217 nm和230 nm處隨pH值的變化,曲線呈現規律性變化,因此可以選擇這3個波長作為測定波長。
將210 nm、217 nm和230 nm波長處不同pH值下乙酰甲胺磷溶液的吸光度繪制成圖2,于210 nm和217 nm處可以觀測曲線有3個拐點,所以乙酰甲胺磷有2個pKa值。

圖2 3個波長下不同pH值的乙酰甲胺磷溶液的吸光度
2.2 乙酰甲胺磷一級解離常數(pKa1)的測定
由圖2可知,乙酰甲胺磷有2個pKa值。根據3個波長下不同pH值的乙酰甲胺磷溶液的吸光度,利用Origin 9.0軟件以pH值為橫坐標,以不同pH值對應的吸光度值為縱坐標,以Sigmoidal數理模型擬合曲線方程,求得pKa。
對于pKa1,擬合曲線方程:

其中,Abase、Aacid、x都在圖2中可知,將數據輸入擬合曲線方程中,利用Origin 9.0分析可得乙酰甲胺磷的解離常數pKa1。根據圖2,選擇3個波長處的pH值為2~12的吸光度值進行Sigmoidal數理模型擬合,得到圖3、圖4和圖5。
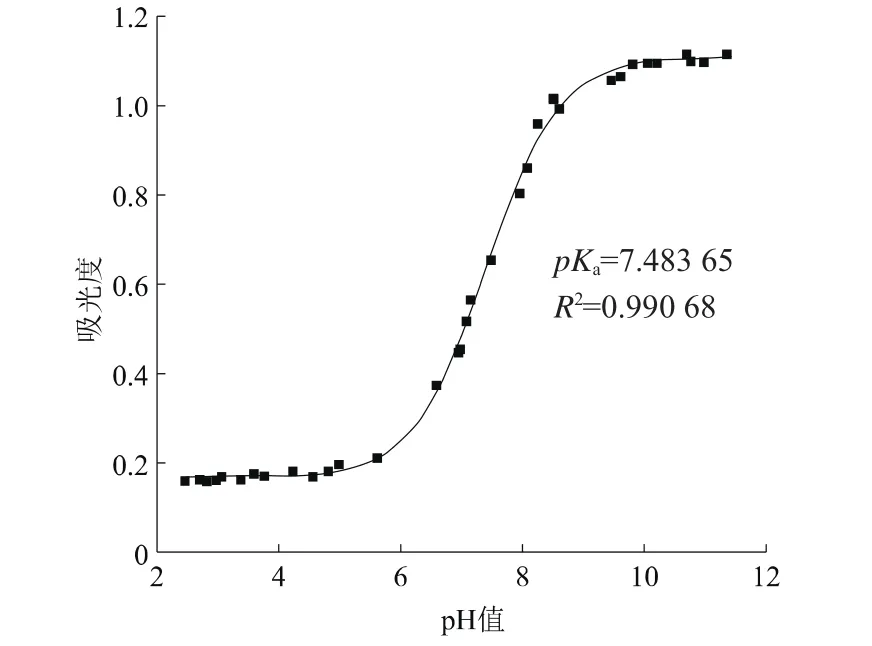
圖3 波長210 nm處Sigmoidal數理模型擬合A-pH曲線

圖4 波長217 nm處Sigmoidal數理模型擬合A-pH曲線

圖5 波長230 nm處Sigmoidal數理模型擬合A-pH曲線
由圖3、圖4和圖5模擬分析結果可得,當波長為210 nm時,pKa1值為7.483 65,相關系數為0.990 68;當波長為217 nm時,pKa1值為7.422 60,相關系數為0.992 07;波長為230 nm時,pKa1值為7.497 55,相關系數為0.973 93;所得的pKa1值比較可靠。求得乙酰甲胺磷解離常數的平均值pKa1為7.467 93。
2.3 乙酰甲胺磷二級解離常數(pKa2)的測定
對于pKa2,由于pH值大于12.5的數值難以在實驗條件下測得,所以曲線采用賦值測試的方法進行擬合。選取210 nm處pH值大于9.4的數據進行賦值擬合,設初始值Aacid=1,Abase=3,曲線擬合結果見圖6。

圖6 波長210nm處Sigmoidal數理模型擬合A-pH曲線
由圖6模擬分析結果可得,在pH值為9.5~12.5時,波長為210 nm時,pKa2值為12.778 3,相關系數為0.998 71。
2.4 理論分析乙酰甲胺磷解離常數的合理性
乙酰甲胺磷的水解位點見圖7。乙酰甲胺磷的分子結構中存在3個可能的水解位點,包括磷酸基、仲氨基、羰基。其中對于仲氨基來說,其具有較多的取代基,在誘導效應與位阻效應的雙重作用下,較難發生水解。因此,仲氨基的水解常數一般在10以上。這與本實驗中pKa2值為12.778 3的結果基本吻合,故可以推測乙酰甲胺磷的第2個水解常數應發生在仲氨基。比較而言,磷酸基較易發生水解反應,且一般在中性pH值附近,因此可將乙酰甲胺磷的第1個水解常數(pKa1值為7.467 93)歸因于磷酸基的水解過程[9]。而對于羰基,其孤對電子難以與質子發生結合,因此可以認為在本實驗的pH值范圍內不發生水解反應[10-11]。

圖7 乙酰甲胺磷的水解位點
3 結論
本研究采用紫外分光光度法及A-pH曲線法結合Sigmoidal數理模型擬合分段測定了乙酰甲胺磷的解離常數,測得乙酰甲胺磷的一級(pKa1)、二級(pKa2)解離常數分別為7.467 93、12.778 3。
本實驗選取了3個測定波長210 nm、217 nm和230 nm,分別計算在這3個波長下乙酰甲胺磷的解離常數。這3個波長下經繪圖軟件擬合的曲線相關系數均大于0.95,測定結果可靠。
乙酰甲胺磷的分子結構中存在3個可能的水解位點:磷酸基、仲氨基和羰基。仲氨基的水解常數在10以上,這與本實驗中的pKa2值為12.778 3的結果基本吻合,磷酸基較易在中性pH值附近發生水解反應,因此可與乙酰甲胺磷的一級解離常數(pKa1值為7.467 93)相對應。

