高頻超聲聯合螢火蟲成像技術診斷乳腺疾病良惡性的價值
呂永聰 李國瑞 朱智勇 詹 薇
(廣東省中西醫結合醫院超聲醫學科,佛山市 528200,電子郵箱:13702448139@163.com)
乳腺癌是臨床常見的女性惡性腫瘤,近年來發病率不斷上升,且發病年齡呈年輕化趨勢[1]。早期診斷與治療對乳腺癌患者十分關鍵,可以改善患者的預后和生活質量。高頻超聲與鉬靶檢查是臨床上診斷乳腺疾病的常用檢查方法,但單獨采用高頻超聲或鉬靶檢查均存在一定缺點,而聯合檢測可提高診斷效果。有研究結果顯示[2-3],乳腺超聲聯合鉬靶、超聲聯合MRI均可提高診斷乳腺疾病的準確度。螢火蟲成像技術是一項新的檢測技術,其能提高微小鈣化灶的檢出率[4],目前該技術已廣泛應用于乳腺、甲狀腺檢查。本研究分別采用高頻超聲、鉬靶和高頻超聲聯合螢火蟲成像技術對乳腺疾病患者進行檢查,旨在探討高頻超聲聯合螢火蟲成像技術在乳腺疾病檢查中的應用價值。現報告如下。
1 資料與方法
1.1 臨床資料 選取2015年7月至2018年10月間我院收治的90例乳腺疾病女性患者,年齡28~82(48.94±10.25)歲。納入標準:(1)均能夠接受高頻超聲檢查、鉬靶檢查及高頻超聲聯合螢火蟲成像技術檢查者;(2)心肺功能、肝腎功能無明顯異常者;(3)愿意接受手術以及病理檢查者。排除標準:(1)合并嚴重內外科疾病不能耐受手術者;(2)妊娠與哺乳期婦女;(3)不愿意接受治療者;(4)合并嚴重精神疾病者。
1.2 檢測方法 (1)高頻超聲檢查。所有患者均由高年資超聲醫生進行檢查。儀器為日本東芝APlio 400型彩色多普勒超聲診斷儀,使用頻率為7.5~12 MHz高頻線陣探頭。患者取仰臥位,在雙側乳腺各象限行縱切面、橫切面、斜切面掃描,認真觀察病灶大小、形態、回聲、邊界、邊緣、縱橫比、血供、病灶內鈣化及包膜有無情況等。(2)鉬靶檢查。儀器為日本富士FDR MS-2000鉬靶機。分別從雙側乳腺斜位、軸位進行攝片,必要時行側位攝片或者病灶局部放大,仔細對腫塊具體形態、大小、位置以及周圍情況進行觀察,判斷腫塊內是否出現鈣化灶,并對鈣化的分布情況、數量、形態等進行觀察;由同一高年資影像科醫師閱片并診斷。(3)高頻超聲聯合螢火蟲成像技術檢查。儀器為日本東芝APlio 500型彩色多普勒超聲診斷儀(內置螢火蟲成像技術的軟件系統)。由同一高年資超聲醫生先行乳腺超聲檢查,方法同前;然后啟動螢火蟲成像技術軟件檢查腺體內部及病灶內部有無微小鈣化,觀察鈣化的數目、形態、大小及其分布特點。
1.3 判斷標準 鉬靶檢查、高頻超聲檢查均根據2013年美國放射學會提出的乳腺影像報告和數據系統(Breast Imaging Reporting and Data System,BI-RADS)[5]中的相關診斷標準做出診斷。BI-RADS系統將病灶分為0~6類。高頻超聲聯合螢火蟲成像技術根據BI-RADS診斷標準對病變歸類:(1)如高頻超聲檢測提示病灶為BI-RADS 2類,則無須進行螢火蟲成像技術檢查。(2)如高頻超聲檢測提示病灶為BI-RADS 3類及4A類,則進行螢火蟲成像技術檢查,若病灶內部無微小鈣化灶則維持原診斷,有微小簇狀鈣化灶則診斷為BI-RADS 4B類。(3)如高頻超聲檢測提示病灶為BI-RADS 4B、4C或5類,并提示有鈣化灶,則無須進行螢火蟲成像技術檢查,維持原診斷;如高頻超聲檢測提示病灶為BI-RADS 4B、4C或5類,但未提示有鈣化灶,則進行螢火蟲成像技術檢查,若病灶無微小鈣化灶則維持原診斷,有微小簇狀鈣化灶則將BI-RADS 4B類升級為4C類、BI-RADS 4C類升級為5類,BI-RADS 5類維持不變。本研究將BI-RADS 2類、3類及4A類歸為良性,將BI-RADS 4B、4C及5類歸納為惡性。
1.4 統計學分析 采用SPSS 17.0軟件進行統計分析。以術后病理檢查為“金標準”,比較鉬靶檢查、高頻超聲檢查、高頻超聲檢查聯合超聲螢火蟲成像技術對乳腺病變良惡性的特異度、靈敏度、準確度。計數資料以例數(百分比)表示,組間比較采用配對χ2檢驗。以P<0.05為差異有統計學意義。
2 結 果
90例患者中術后病理檢查提示乳腺良性病變55例(乳腺腺病12例,乳腺纖維瘤41例,乳腺導管乳頭狀瘤1例,乳腺良性葉狀腫瘤1例),惡性病變35例(乳腺惡性葉狀腫瘤1例,乳腺導管癌34例)。高頻超聲聯合螢火蟲成像技術診斷乳腺疾病良惡性的準確度均優于高頻超聲檢查和鉬靶檢查,特異度優于高頻超聲檢查,靈敏度優于鉬靶檢查(均P<0.05)。見表1、表2。
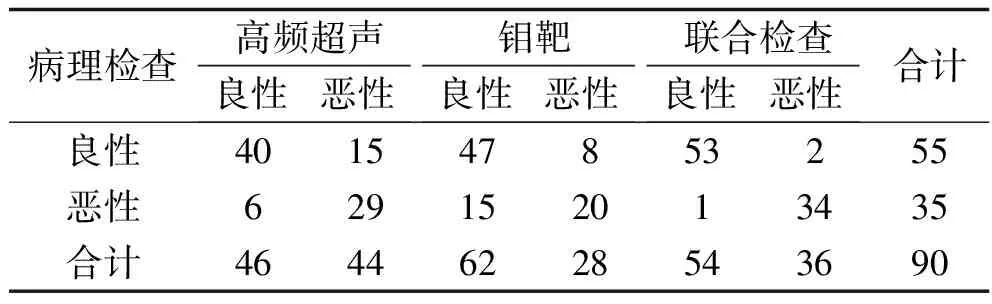
表1 3種檢測方法診斷乳腺疾病良惡性結果
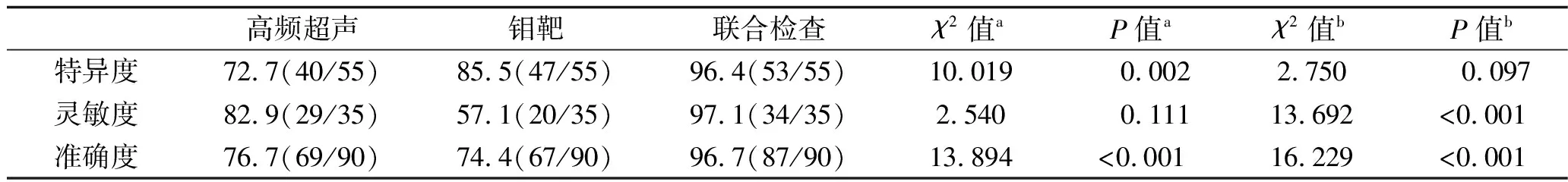
表2 3種檢測方法的特異度、靈敏度、準確度比較
注:a為高頻超聲與聯合診斷比較的統計學結果;b為鉬靶與聯合診斷比較的統計學結果。
3 討 論
早發現、早診斷、早治療可以提高乳腺癌患者的生存率,改善患者預后以及生存質量。但早期乳腺癌往往體積較小,觸診不易發現。國內學者針對體積小的乳腺癌提出微小乳腺癌概念,是指無論腫瘤大小的原位小葉癌或導管癌,以及直徑≤1 cm的浸潤性小葉癌或導管癌且不伴腋窩淋巴結轉移者[6]。目前乳腺檢查的常用方法有高頻超聲和鉬靶檢查,單一使用在診斷乳腺疾病方面均存在一定困難,容易出現漏診和誤診[7-8]。
高頻超聲可以準確發現乳腺病灶,并能觀察病灶大小、形態、回聲、邊界、邊緣、縱橫比、包膜等,但不易發現腺體內散在微小鈣化灶[8]。高頻超聲圖上典型乳腺癌腫塊具備以下特點:腫塊形態不規則,邊界不清,無包膜,邊緣呈毛刺狀或蟹足狀;內部呈不均勻低回聲,可見砂粒體樣微小鈣化點,多呈簇狀分布;腫塊后方回聲衰減明顯;縱橫比>1;內部及周邊血流信號豐富[6]。微小乳腺癌體積較小,往往不具備典型乳腺癌聲像,浸潤生長表現不明顯,邊界尚光整,無邊緣毛刺征,后方回聲無明顯衰減,即使內部出現微小鈣化點,也因高頻超聲對微小鈣化顯示率低而未能檢出,易導致誤診[8]。本研究中,采用高頻超聲檢查有6例惡性病例誤診為良性,原因均為腫塊較小,高頻超聲未能清晰顯示,未能發現微小鈣化灶。
既往研究發現,有4%~10%的乳腺癌診斷陽性的唯一依據是微小鈣化灶,且50%左右的隱性乳腺癌可單憑微小鈣化做出診斷[9]。高頻超聲對微小乳腺癌鈣化檢出率較低,而鉬靶檢查對于乳腺微小鈣化灶的敏感性高,特別是對于直徑<1 cm的微小乳腺癌鈣化灶的檢出率明顯優于高頻超聲[8]。但鉬靶檢查也存在一些不足之處[10]:對腫瘤內部解剖結構進行檢查時,鉬靶X線存在現象不清、圖像信息不夠全面等缺點;鉬靶對高致密乳腺組織穿透力差,常無法分辨乳腺腫物的囊性或實性,容易出現漏診;除此之外,X線有一定的輻射,患者檢查時可產生疼痛不適,一般不建議40歲以下女性進行鉬靶X線檢查。
隨著超聲技術的發展,針對現有方法顯示微小鈣化灶方面的缺陷,超聲螢火蟲成像技術應運而生,研究表明,該技術與鉬靶X線技術在乳腺惡性病灶微鈣化的檢出效果相似[11]。因此,本研究探討高頻超聲聯合螢火蟲成像技術應用于乳腺疾病良惡性的診斷效果,結果顯示,高頻超聲聯合螢火蟲成像技術檢查對乳腺疾病良惡性的診斷準確度為96.7%,優于單一使用高頻超聲檢查或鉬靶檢查,且其特異度優于高頻超聲檢查,靈敏度優于鉬靶檢查(均P<0.05)。在實際工作中,螢火蟲成像技術對于微小鈣化具有較高敏感性,可以觀察病灶內是否存在微小鈣化以及分布情況,甚至可以發現以微小鈣化為唯一特征的乳腺癌;而高頻超聲檢查可清晰觀察病灶的位置、形態、血供及深度等,圖像信息較全面。因此,將高頻超聲與螢火蟲成像技術兩者聯合應用,大大提高了對乳腺疾病良惡性診斷的準確度。
綜上所述,高頻超聲聯合螢火蟲成像技術診斷乳腺疾病良惡性具有較高的敏感性和準確性,相對于乳腺超聲和鉬靶檢查,具有方便、快捷、無創、實時、可反復檢查的優點,值得臨床推廣應用。

