分泌性中耳炎病灶組織中伴有Kazal基序富含半胱氨酸的逆轉(zhuǎn)誘導蛋白的表達及其與細胞外基質(zhì)重塑、骨破壞及細胞凋亡的相關(guān)性
姚 宜 張安瑩 韓 蓓
(三峽大學第一臨床醫(yī)學院暨湖北省宜昌市中心人民醫(yī)院耳鼻喉科,宜昌市 443003,電子郵箱:cnmd6032@163.com)
分泌性中耳炎是耳鼻咽喉科的常見疾病,部分患者的慢性炎癥遷延不愈,造成中耳炎局部組織的細胞外基質(zhì)發(fā)生重塑,嚴重者會出現(xiàn)鄰近骨破壞、角化細胞凋亡[1-2]。蛋白酶活性的改變是造成細胞外基質(zhì)異常水解、過度重塑的重要環(huán)節(jié)[3],但具體的調(diào)控機制仍未完全明確。伴有Kazal基序富含半胱氨酸的逆轉(zhuǎn)誘導蛋白(reversion-inducing cysteine-rich protein with Kazal motifs,RECK)是一類抑癌基因,通過抑制蛋白酶活性來促使細胞外基質(zhì)降解、骨基質(zhì)破壞、細胞凋亡[4]。本研究探討分泌性中耳炎病灶組織中RECK表達情況及其與細胞外基質(zhì)重塑、骨破壞及細胞凋亡的相關(guān)性。
1 資料及方法
1.1 臨床資料 選擇2015年3月至2017年4月在我院進行開放式乳突改良根治手術(shù)或完壁式乳突根治手術(shù)的58例分泌性中耳炎患者。納入標準:(1)符合中耳炎的診斷標準[5];(2)符合手術(shù)指征;(3)臨床資料完整;(4)手術(shù)切除的中耳炎病灶組織保留完整。排除標準(1)合并耳部其他病變者;(2)合并惡性腫瘤、全身性骨病者。其中男性31例、女性27例,年齡36~58(48.92±8.21)歲。另取同期因外傷在我院行外耳道成形術(shù)的患者44例,均無耳部其他病變及感染,其中男性24例、女性20例,年齡43~59(49.28±10.28)歲,手術(shù)后留取正常外耳道上皮組織。分泌性中耳炎患者和外耳道成形術(shù)患者的性別、年齡差異均無統(tǒng)計學意義(均P>0.05)。
1.2 方法
1.2.1 RNA的提取及反轉(zhuǎn)錄:取適量分泌性中耳炎病灶黏膜上皮組織和正常外耳道上皮組織,加入Trizol裂解液后充分研磨組織,研磨得到的組織液在離心機(賽默飛世爾科技有限公司,型號:micro21R)中以12 000 r/min的速度離心5 min,取上層澄清液體,按照RNA提取試劑盒(北京天根公司,批號:DP431)的說明書提取總RNA。分離得到RNA后,按照反轉(zhuǎn)錄試劑盒(北京天根公司,批號:KR118)的說明書合成cDNA。
1.2.2 mRNA表達量的檢測:檢測以下指標的mRNA表達量,包括RECK、基質(zhì)金屬蛋白酶(matrix metalloproteinase,MMP)2、轉(zhuǎn)化生長因子β1(transforming growth factor β1,TGF-β1)、Smad 2/3、基質(zhì)金屬蛋白酶組織抑制因子(tissue inhibitor of metalloproteinase,TIMP)1、TIMP 2、Runt相關(guān)轉(zhuǎn)錄因子2(Runt related transcription factor 2,RUNX 2)、骨保護素(osteoprotegerin,OPG)、核因子κB受體活化因子(receptor activator of nuclear factor-κ B,RANK)、RANK配體(RANK ligand,RANKL)、第10號染色體缺失的磷酸酶及張力蛋白同源的基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)、含半胱氨酸的天冬氨酸蛋白水解酶3(cysteine aspartic auc specific proteinase 3,Caspase-3)、Livin、細胞周期蛋白D1(Cyclin D1)、增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)。取cDNA樣本,按照PCR反應試劑盒(上海天根公司,批號:FP209)說明書配置PCR反應體系,包括cDNA 1 μL、試劑盒內(nèi)的反應混合液10 μL、上游引物0.4 μL、下游引物0.4 μL、去離子水補足至20 μL。PCR反應程序為95℃ 3 min,95℃ 15 s,各基因特異性退火溫度20 s,72℃ 25 s,40個循環(huán)。儀器為CFX96型實時熒光定量PCR儀(美國Bio-rad公司);在儀器自帶的軟件中自動生成循環(huán)曲線及循環(huán)閾值(Ct),以β-actin為內(nèi)參,按照公式2-△△Ct計算相應基因的mRNA表達量。引物由上海生工公司合成。
1.3 統(tǒng)計學分析 采用SPSS 23.0軟件進行統(tǒng)計學分析。計量資料以(x±s)表示,兩組間比較采用t檢驗;計數(shù)資料以例數(shù)或百分比表示,比較采用χ2檢驗,相關(guān)性分析采用Pearson相關(guān)性分析。以P<0.05為差異有統(tǒng)計學意義。
2 結(jié) 果
2.1 兩種組織中RECK mRNA的表達情況 分泌性中耳炎病灶組織中RECK的mRNA相對表達量為0.47±0.07,正常外耳道上皮組織中RECK的mRNA相對表達量為1.04±0.18。分泌性中耳炎病灶組織中RECK相對的mRNA表達量低于正常外耳道上皮組織(t=19.895,P<0.001)。
2.2 兩種組織中細胞外基質(zhì)重塑分子的mRNA表達情況 分泌性中耳炎病灶組織中MMP 2、TGF-β1、Smad 2/3的mRNA相對表達量均高于正常外耳道上皮組織,而TIMP 1、TIMP 2的mRNA相對表達量均低于正常外耳道上皮組織(均P<0.05),見表1。分泌性中耳炎病灶組織中RECK mRNA相對表達量與MMP 2、TGF-β1、Smad 2/3 mRNA相對表達量呈負相關(guān)(r=-0.324、-0.291、-0.236,P=0.008、0.013、0.022),與TIMP 1、TIMP 2 mRNA相對表達量呈正相關(guān)(r=0.288、0.382,P=0.014、0.001)
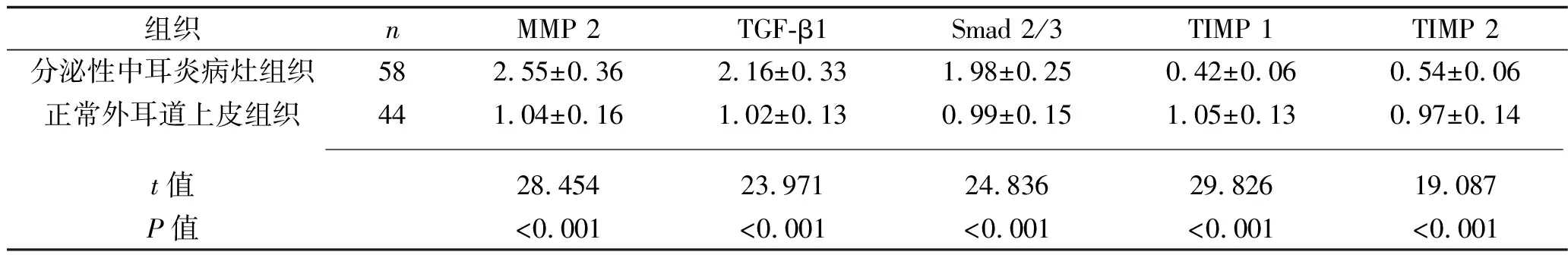
表1 兩種組織中細胞外基質(zhì)重塑分子mRNA相對表達量的比較(x±s)
2.3 兩種組織中骨破壞分子mRNA的表達情況 分泌性中耳炎病灶組織中RUNX 2、OPG的mRNA相對表達量均低于正常外耳道上皮組織,而RANK、RANKL的mRNA相對表達量均高于正常外耳道上皮組織(均P<0.05),見表2。分泌性中耳炎病灶組織中RECK的mRNA相對表達量與RUNX 2、OPG的mRNA相對表達量呈正相關(guān)(r=0.293、0.231,P=0.018、0.024),與RANK、RANKL的mRNA相對表達量呈負相關(guān)(r=-0.212、-0.308,P=0.030、0.011)。
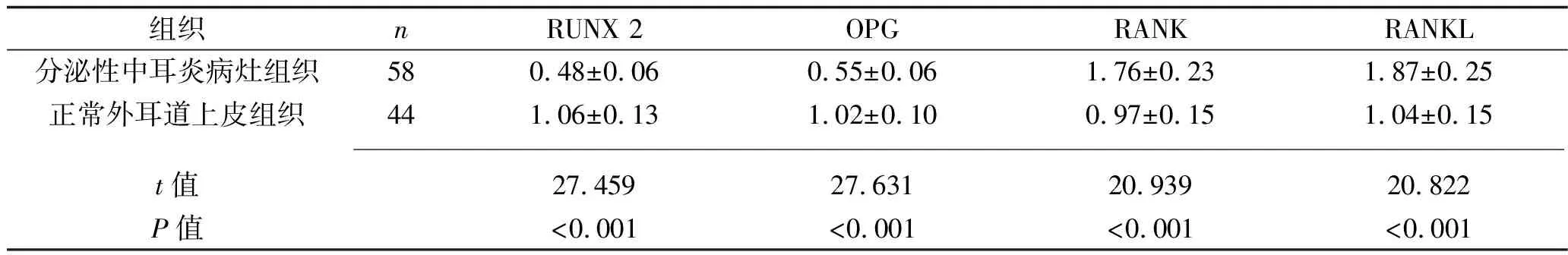
表2 兩種組織中骨破壞分子mRNA相對表達量的比較(x±s)
2.4 兩種組織中細胞凋亡基因mRNA的表達情況 分泌性中耳炎病灶組織中PTEN、Caspase-3的mRNA相對表達量均高于正常外耳道上皮組織,而Livin、Cyclin D1、PCNA的mRNA相對表達量均低于正常外耳道上皮組織(P<0.05),見表3。分泌性中耳炎病灶組織中RECK的mRNA相對表達量與PTEN、Caspase-3的mRNA相對表達量呈負相關(guān)(r=-0.393,P<0.001;r=-0.198,P=0.039),與Livin、Cyclin D1、PCNA的mRNA相對表達量呈正相關(guān)(r=0.282,P=0.018;r=0.341,P=0.002;r=0.387,P<0.001)。
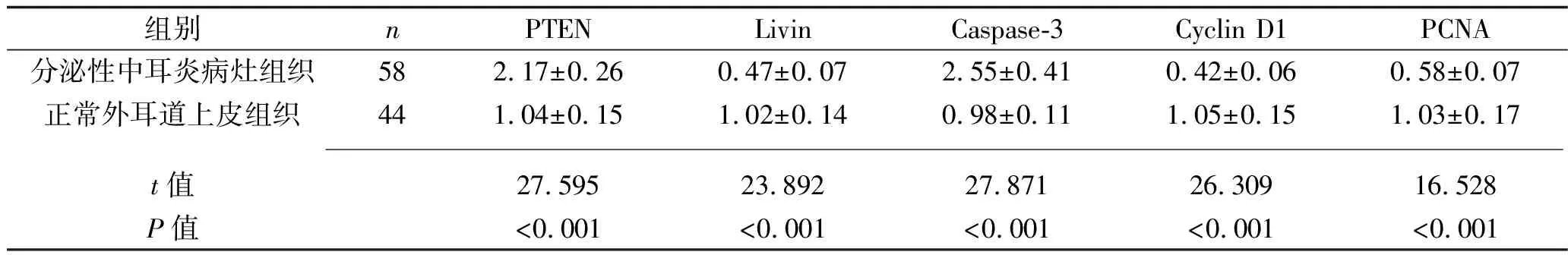
表3 兩種組織中細胞凋亡基因mRNA相對表達量的比較(x±s)
3 討 論
分泌性中耳炎遷延不愈為慢性疾病后會導致炎癥周圍組織發(fā)生細胞外基質(zhì)重塑,嚴重者會出現(xiàn)鄰近骨質(zhì)的破壞以及角化細胞的凋亡。其中,骨質(zhì)破壞不僅會影響聽骨鏈的功能并造成患者聽力損害,還會促進慢性炎癥對顱底骨質(zhì)的破壞,并增加顱內(nèi)感染等嚴重并發(fā)癥的發(fā)生概率;而角化細胞的凋亡則會造成中耳局部角化碎屑堆積并影響聽力[6-7]。蛋白酶活性的改變是造成細胞外基質(zhì)異常水解、過度重塑的重要病理環(huán)節(jié),也能對骨基質(zhì)進行水解并造成骨破壞[8]。目前,關(guān)于分泌性中耳炎局部組織中蛋白酶活性改變的調(diào)控機制仍未完全明確。RECK是近年來發(fā)現(xiàn)的蛋白酶抑制分子,其能夠直接降低蛋白酶的水解活性,同時也能阻礙蛋白酶在局部組織的錨定,并抑制蛋白酶的水解活性[9-10]。本研究結(jié)果顯示,分泌性中耳炎病灶組織中RECK mRNA的表達量低于正常外耳道上皮組織(P<0.05),這說明RECK的低表達與分泌性中耳炎的發(fā)生存在密切關(guān)系。結(jié)合RECK的生物學活性,我們推測RECK的低表達能夠使蛋白酶活性增加,進而促進中耳炎局部組織發(fā)生細胞外基質(zhì)重塑以及骨質(zhì)破壞。
分泌性中耳炎局部組織的重塑依賴于多種蛋白酶及細胞因子的生物學活性,其中MMP 2是具有強大水解作用的MMP,能夠使細胞間基質(zhì)內(nèi)的彈性蛋白、膠原蛋白、層粘連蛋白均發(fā)生過度水解,進而促進了組織重塑的過程[11];TIMP 1和TIMP 2則是MMP的特異性抑制分子,通過與MMP 2形成共價結(jié)合后降低其水解活性,進而對細胞外基質(zhì)的重塑過程產(chǎn)生抑制作用[12-13]。TGF-β1是介導細胞外基質(zhì)重塑關(guān)鍵的細胞因子,能夠通過Smad 2/3進行信號轉(zhuǎn)導,并促進細胞外基質(zhì)發(fā)生異常沉積,加劇了組織重塑[14]。本研究結(jié)果顯示,分泌性中耳炎病灶組織中MMP 2、TGF-β1、Smad 2/3 mRNA的表達量均高于正常外耳道上皮組織,而TIMP 1、TIMP 2 mRNA的表達量均低于正常外耳道上皮組織(均P<0.05)。這說明細胞外基質(zhì)重塑促進分子的高表達、抑制分子的低表達與分泌性中耳炎的發(fā)生密切相關(guān)。此外,分泌性中耳炎病灶組織中RECK mRNA的表達量與MMP 2、TGF-β1、Smad 2/3 mRNA的表達量呈負相關(guān),與TIMP 1、TIMP 2 mRNA的表達量呈正相關(guān)(均P<0.05)。這提示分泌性中耳炎患者局部組織中低表達的RECK能夠增強細胞外基質(zhì)重塑促進分子的活性,抑制細胞外基質(zhì)重塑抑制分子的活性,進而在分泌性中耳炎發(fā)展過程中促進局部組織的細胞外基質(zhì)重塑。
分泌性中耳炎局部組織發(fā)生細胞外基質(zhì)重塑會進一步造成炎癥擴散并引起骨質(zhì)破壞,蛋白酶水解活性的增加會直接破壞骨基質(zhì)內(nèi)的膠原成分,同時也會影響成骨細胞及破骨細胞的活性[15]。成骨細胞介導的骨形成以及破骨細胞介導的骨吸收,在骨質(zhì)完整性的調(diào)控中發(fā)揮了至關(guān)重要的作用:當破骨細胞活性超過成骨細胞時,骨吸收過程強于骨形成過程,從而造成了骨質(zhì)破壞。RUNX 2是調(diào)控成骨細胞分化成熟的關(guān)鍵轉(zhuǎn)錄因子,能夠調(diào)節(jié)多種成骨標志基因的表達并促進間充質(zhì)細胞向成骨細胞分化。OPG/RANKL/RANK是調(diào)控成骨/破骨平衡的通路,其中RANKL是破骨細胞表面受體RANK的配體,兩者結(jié)合后能夠通過下游信號轉(zhuǎn)導來增強破骨細胞的活性;OPG是成骨細胞分泌的活性蛋白,能夠與RANKL競爭性結(jié)合RANK并阻礙破骨細胞的活化[16-17]。本研究結(jié)果顯示,分泌性中耳炎病灶組織中RUNX 2、OPG mRNA的表達量低于正常外耳道上皮組織,而RANK、RANKL mRNA的表達量均高于正常外耳道上皮組織(均P<0.05)。這說明成骨細胞標志分子的低表達、破骨細胞標志分子的高表達與分泌性中耳炎的發(fā)生密切相關(guān)。此外,分泌性中耳炎病灶組織中RECK mRNA的表達量與RUNX 2、OPG mRNA的表達量呈正相關(guān),與RANK、RANKL的mRNA表達量呈負相關(guān)(均P<0.05)。這提示分泌性中耳炎局部組織中RECK的低表達能夠抑制成骨細胞活性、增強破骨細胞活性,進而促進了骨破壞。
在分泌性中耳炎的發(fā)展過程中,局部炎癥的擴散還會造成鄰近的角化細胞損傷及脫落,進而造成中耳腔內(nèi)大量角化鱗屑堆積。細胞凋亡是造成角化細胞損傷的重要病理環(huán)節(jié),該環(huán)節(jié)受到多種促凋亡基因及凋亡抑制基因的調(diào)控。PTEN是重要的促凋亡基因,具有磷酸酶活性,能夠使細胞外調(diào)節(jié)蛋白激酶通路、磷脂酰肌醇3-激酶/蛋白激酶B通路中的多種信號分子去磷酸化,進而降低信號通路的活性,并阻礙細胞增殖、促進細胞凋亡[18]。Livin是具有廣泛凋亡抑制活性的分子,能夠阻礙凋亡級聯(lián)激活通路中多種分子的激活,進而抑制Caspase-3的激活及其所介導的細胞凋亡。Cyclin D1和PCAN是在細胞增殖過程中發(fā)揮正性調(diào)控作用的分子,前者能夠加速細胞周期,而后者能夠加速DNA復制,兩者通過對細胞增殖的促進作用來實現(xiàn)對細胞凋亡的抑制。本研究結(jié)果顯示,分泌性中耳炎病灶組織中PTEN、Caspase-3 mRNA的表達量均高于正常外耳道上皮組織,而Livin、Cyclin D1、PCNA mRNA的表達量均低于正常外耳道上皮組織(均P<0.05)。這說明促凋亡基因的高表達、凋亡抑制基因的低表達與分泌性中耳炎的發(fā)生密切相關(guān)。此外,分泌性中耳炎病灶組織中RECK mRNA的表達量與PTEN、Caspase-3 mRNA的表達量呈負相關(guān),與Livin、Cyclin D1、PCNA mRNA的表達量呈正相關(guān)(均P<0.05)。表明分泌性中耳炎病灶組織中低表達的RECK能夠促進細胞凋亡。
綜上所述,分泌性中耳炎病灶組織中RECK呈低表達,而這或可促進細胞外基質(zhì)重塑、骨質(zhì)破壞及細胞凋亡的發(fā)生。

