白木香良種‘熱科2號’的芽接繁育①
王宇光 王 軍 段瑞軍 覃和業 梅文莉 戴好富
(中國熱帶農業科學院熱帶生物技術研究所/農業部熱帶作物生物學與遺傳資源利用重點實驗室/海南省黎藥資源天然產物研究與利用重點實驗室/海南省沉香工程技術研究中心 海南海口571101)
沉香藥用價值較高,被廣泛應用于消化、呼吸、心腦血管、風濕等疾病的治療[1-2]。沉香還是一種香料,在中東國家,沉香精油、香水備受推崇。此外,沉香的文化收藏價值也較高。世界沉香及產品每年的貿易額達200億元以上,且呈逐年增加之勢。
白 木 香 [Aquilariasinensis(Lour.)Spreng.]是中國生產沉香的唯一基源植物,人工規模栽培已有40 a歷史,但對其遺傳資源的系統評價和選育尚未開展,種苗培育所用種子大多來自栽培或野生成齡植株,種質參差不齊[3]。因此,研究沉香優良品種的選育和繁育技術具有重要的意義。種子后代為有性系,而通過組培、扦插和嫁接等方式生產的種苗為無性系,其性狀不會發生分離。白木香是較難生根植物,無論組培[4-6]還是扦插[7-8],生根率均較低,嫁接技術因可以克服生根困難,成為解決沉香種苗繁育的最佳途徑[9-10]。前人已篩選和鑒定了優良白木香母樹,通過嫁接可實現該母樹的無性系化,經多地區種植,利用GC-MS技術分析檢測所產沉香,發現嫁接無性系和母樹具有相同的優良特性,即所產沉香所含的沉香特征性成分相對百分含量較高,總色酮相對百分含量平均為81.50%,其中,2-(2-苯乙基)色酮、2-[2-(4-甲氧基苯)乙基]色酮、2-[2-(3-羥基-4-甲氧基苯)乙基]色酮和2-[2-(3-甲氧基-4-羥基苯)乙基]色酮的相對百分含量之和平均為77.00%,2-(2-苯乙基)色酮和2-[2-(4-甲氧基苯)乙基]色酮的相對百分含量之和平均為51.25%,比普通白木香所產沉香相關成分的相對百分含量顯著提高,具有‘奇楠’沉香的化學成分特征[11-13]。‘奇楠’沉香是業界公認的最優質沉香。因此,上述嫁接的無性系被認為是一種白木香優良無性系,將其命名為‘熱科2號’,2017年獲得海南省林木品種委員會認定(良種編號:瓊R-ETS-AS-003-2017)。為進一步推廣,開展白木香‘熱科2號’嫁接苗擴大生產的研究,驗證‘熱科2號’在遺傳上的獨立性及第一代嫁接苗和母樹在遺傳上的一致性,避免由于某些失誤導致種質間的混淆。同時,在采用第一代嫁接苗作為芽條進一步擴繁之前,采用基因組單堿基多態性 (single nucleotide polymorphisms, SNPs)技術[14-15]對‘熱科2號’進行基因分型。
前人多使用枝接(穗接)擴繁白木香,即直接從野外采集自然生長的土沉香穗來進行嫁接,成活率平均為15.00%[9]。人工種植白木香植株可通過砍枝促萌管理,用1 a生枝條進行嫁接,顯著提高白木香嫁接成活率,平均為56.80%(最高為84.00%)[10]。由此可見,優化砧木和芽條生長狀況可提高白木香嫁接成活率。目前,尚未見芽接應用在白木香嫁接苗擴繁,但該方法在橡膠樹等大規模產業化林木無性系生產上應用較為成熟,成活率也較高[16-17],因其具備諸多優勢,如對嫁接季節要求不嚴格,不浪費砧木,繁殖數量大,對推廣良種極為有利[18]。因此,有必要開展‘熱科2號’的芽接擴繁技術的研究。
1 材料與方法
1.1 材料
‘熱科2號’嫁接苗繁育試驗地點:海南省文昌市邁號鎮中國熱帶農業科學院基地。該地為熱帶氣候,每年最低溫高于3℃,不出現明顯霜凍。
‘熱科2號’第一代嫁接苗由中國熱帶農業科學院熱帶生物技術研究所2013年擴繁所得。
砧木為白木香種子苗,包括來自廣東化州地區、海南中部地區(瓊中)和海南南部地區(保亭)的白木香種子苗,用塑料營養袋培育,營養袋規格為17 cm×19 cm。
白木香基因組的單堿基多態性(SNP)分析由北京百邁客生物科技有限公司協助完成。
1.2 方法
1.2.1 白木香‘熱科2號’SNP基因分型
參考Sun等[19]方法,通過開發白木香全基因組SNP標記,應用于白木香的分型。從廣東白木香種群A取27個樣本(A1,A3,A4,A7,A11,A12,A19, A20, A26, A28, A29, A30, A32, A34,A35, A37, A40, A42, A48, A51, A54, A56,A59,A60, A100, A101,A102);海南白木香種群C取11個樣本(C1~C11);‘熱科2號’母樹和第一代嫁接無性系樣本B取5個樣本(B2,B3,B4,B5,B6),其中B6為‘熱科2號’母樹,B2、B3、B4、B5為‘熱科2號’嫁接苗。另外,B7、B1為砧木,作為對照。樣本分別為各植株葉片,置離心管于液氮中保存。樣品總基因組DNA采用試劑盒(SolarBio)提取,每樣品的DNA總量為1.5μg,濃度≥20ng/μL,純度OD 260/280為 1.8~2.2。采用RsaI+HaeIII對45個樣品DNA分別酶切[20],于 37 ℃用 Klenow fragment (3→5'exo-)(NEB)和dATP對酶切片段進行加A處理。用T4連接酶對帶有A尾的酶切片段連接測序接頭[21]。以連接測序接頭后的DNA片段為模板,用引物(5'-AATGATACGGCGACCACCGA-3',5'-CAAGCAGAAGACGGCATACG-3')進行PCR擴增,瓊脂糖凝膠電泳后切下長度在364~414 bp片段,純化得到SLAF標簽庫[19]。上機測序,分別得到各自讀段[22]。根據讀段序列的相似度,進行聚類,聚類到一起的讀段來源于一個SLAF F標簽。一個SLAF在不同樣品間序列可能完全相同(沒有多態性),也可能相互之間有變異(包括插入/缺失變異、單堿基變異),稱為多態性SLAF序列。單堿基變異造成的SLAF多態性即為SNP。以每個SLAF標簽中測序深度最高的序列類型作為參考序列,利用bwa[23]將各個樣品測序得到的讀段比對到參考基因組(Aquilaria agallochum基因組)(下載地址:https://www.ncbi.nlm.nih.gov/genome/32033?genomeassembly id=202302) 上,并使用 GATK[24]和 samtools[25]2種方法開發SNP,以2種方法得到的SNP標記交集作為最終SNP標記數據集。
白木香種群的分型和進化關系:對所有的SNP根據完整度>0.5,MAF>0.05過濾。運用數學統計學方法,對45份白木香完成群體進化樹分析,從基因組水平揭示不同群體之間的遺傳分化關系[26]。
1.2.2‘熱科2號’嫁接苗生產
‘熱科2號’第一代嫁接苗按2 m×2 m行距種植在黃壤土(pH6.5)。每周采用塑料噴灌帶給水1次,保持土壤濕度。每株種植時施有機肥4 kg。后續每月補施復合肥1次,10 g/株。每2個月分別用80%的代森錳鋅可濕性粉劑稀釋700倍液噴灑整個植株預防炭疽病,用90%的敵百蟲稀釋1 000倍液噴灑葉片控制黃野螟、青蟲、卷葉蟲等蟲害。
‘熱科2號’母樹第一代嫁接苗于2014年6月基地種植后,2016年5月主干生長至約1.8 m高,去頂。2017年6月取1 a生枝條進行嫁接,修剪植株。新長出的枝條在較好的肥水和病蟲害管理下,次年春天隨著溫度升高(平均溫度25℃以上)進入良好的生長狀態,5月后可再次用于嫁接。以后每年取芽條嫁接時對植株進行相同的修剪。
嫁接前4個月,將2.5 a生樹體健壯、無病蟲害的白木香種子容器苗(塑料營養袋規格為17 cm×19 cm,地徑≥1.5 cm,苗高≥110 cm)移植在苗床上,株行距20 cm×20 cm,每2行留40 cm寬行道作為嫁接操作所用,并用紅壤土將營養袋覆蓋。每0.5個月施復合肥1次,7 g/株。經過4個月生長,可用于嫁接。
5~10月,選擇1.0~1.5 a生芽條,切下包含有效芽點的芽片,去除木質部,剪成“盾形”。在砧木距地面7 cm處地徑一面切成“U”,撥除砧木皮層,插入芽片,用塑料帶綁緊。30 d后將綁縛解除。65 d后將嫁接成活苗的砧木鋸頂,催芽。
1.2.3 對照芽條植株和砧木的培養
作為對照,部分‘熱科2號’植株和海南中部地區的白木香種子苗在嫁接前6個月自然生長,即不人工給水和施肥、不使用農藥。由于試驗區比較干旱,所用土壤為深挖紅壤土,較貧瘠,因此,芽條和砧木植株基本生長在脅迫型的環境中。
1.2.4 不同處理對嫁接成活率的影響
分別取海南瓊中產的白木香種子苗3 000株(I組)、廣東化州產白木香種子苗900株(II組)和海南保亭產的白木香種子苗3 000株(III組)為砧木,以‘熱科2號’嫁接苗植株1.0~1.5 a生枝條為芽條,分別于2017年6月、2018年6月和2018年9月進行嫁接,I組和III組每次嫁接1 000株,II組每次嫁接300株。同時取1.2.3條件下生長的砧木和芽條分3次進行嫁接(IV組),每次砧木200株,作為對照。嫁接30 d后去除薄膜,檢查嫁接的芽片是否保持綠色,如為綠色,即認定為成活。
采用Excel和SPSS 11.5統計分析軟件對不同處理獲得的芽片嫁接成活率進行差異顯著性分析。
砧木鋸頂后設置3組試驗。A組:將苗床上的全部砧木植株做鋸頂處理。保持土壤濕潤,繼續培養4個月,計算芽片的抽芽率;B組:將苗床部分嫁接成活芽片的砧木植株做鋸頂處理;C組:取芽接成活的砧木植株做鋸頂處理,并從營養袋底下斷根,移植空地苗床,并用紅壤土將營養袋覆蓋。使用遮光率45%的遮陽網遮蔭培養1個月后拆掉遮陽網。為了避免鋸頂處理造成砧木死亡,以上鋸頂的方法是從砧木苗高的35%~40%位置鋸斷,并用油漆涂布切口,其后通過抹掉不定芽的方式誘導嫁接成活芽片抽芽。每組處理重復3次,分別于2017年10月15日(每組100株)、2018年10月20日(每組400株)和2018年11月5日(每組400株)進行。
2 結果與分析
2.1 白木香‘熱科2號’的基因分型
通過 SLAF-seq(specific-locus amplified fragment sequencing)技術共開發了328 377個SLAF標簽,共得到585 503個群體SNP。通過MEGA6[26]軟件,構建樣品的群體進化樹,如圖1所示。
由圖1可知,通過SNP標記,A、B、C 3個白木香種群能很好地分開,而且A種群27個個體被分為4個亞群,表現出豐富的多樣性。B種群為白木香‘熱科2號’第一代嫁接苗和母樹,被集聚在同一特異分支上,很好地與其它種群(A、C種群)分開,說明是一個群體遺傳上相對獨立的品系。B1、B7為砧木,作為對照,也能與白木香優良嫁接無性系‘熱科2號’很好地分開,從而說明利用SNP分型的準確性。比較A、B、C3個白木香種群不同個體間的遺傳距離,發現B種群個體間的遺傳距離最短。A、C種群的不同個體為同一家系或自然群體樣品,遺傳距離比作為嫁接無性系的B種群個體間的遺傳距離長,反映了樣品的實際情況。
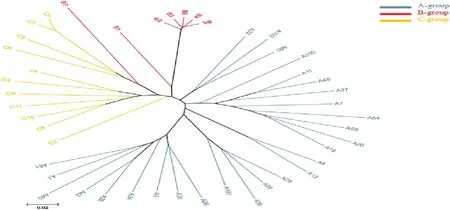
圖1 白木香‘熱科2號’系統進化樹
2.2 不同方法培養的芽條和砧木對芽片嫁接成活率的影響
由表1可知,I、II、III組芽片嫁接成活率比較高,平均達90.31%,IV組芽片嫁接成活率比較低,平均為25.50%。I、II、III組和IV組間的芽片嫁接成活率差異顯著,可見芽條和砧木的培養方法對芽接成活率有重要影響。可能是由于I、II、III組芽條和砧木在良好的水肥及充足的光照條件,嚴格的病蟲害控制下培養,處在良好的生長狀態,形成層較厚,易剝開,纖維化程度低,白中帶綠,水分充足,因此,有利于芽接成活。反之,IV組芽條和砧木于脅迫型環境條件下生長,形成層較薄,不易剝開,纖維化程度高,缺乏水分,因而不利于芽接成活。
由表1可知,不同地域的白木香種子苗作為砧木,對芽接成活率無顯著性差異。雖然來自廣東化州的砧木和來自海南的砧木在SNP基因分型中(圖1)被聚類在不相同的分支,為不同地域白木香種群,但遺傳差異沒有顯著影響芽接成活率。

表1 不同方法培養的芽條和砧木對芽片嫁接成活率的影響
2.3 砧木鋸頂后不同生長條件對嫁接成活芽片抽芽率的影響
由表2可知,不同處理間芽片發芽率存在較大差異。A組被鋸頂的植株得到充分光照,同時不被傷根,平均出芽率最高,為80.00%;B組由于被大量的其他未鋸頂植株遮陰,被鋸頂的植株光照嚴重不足,出芽率僅10.25%,C組通過移植方式保證被鋸頂的植株得到充分光照,獲得較高的出芽率,為69.17%,但移植傷根在一定程度上降低芽片發芽率。因此,提高芽片發芽率可在砧木預培養時擴大間距,一次性全部嫁接芽片。由于芽片嫁接成活率較高,可全部一次鋸頂。同時可將少部分未嫁接成活植株移植其它苗床,保證被鋸頂的植株得到充分的光照,提高芽片發芽率。
表2 砧木鋸頂后不同生長條件對嫁接成活芽片的抽芽率的影響
3 討論
白木香良種‘熱科2號’在形態上和普通白木香無明顯差異,但白木香SNP分型結果能區分‘熱科2號’和來自海南和廣東的白木香種群。‘熱科2號’所產沉香的化學成份特征突出,品質優良,說明‘熱科2號’是一個獨特的優良品種,有必要擴大嫁接無性系生產。此外,SNP分型結果證實了‘熱科2號’第一代嫁接苗和母樹之間的關系,為選擇第一代嫁接苗作為‘熱科2號’嫁接苗生產的芽條植株提供了分子依據。
提高嫁接成活率直接影響生產的效率和成本。影響嫁接成活率的因素主要包括[10,27-28]:(1) 嫁接方法;(2)不同品系的砧木;(3)氣候因子(溫度、濕度等);(4)砧木和芽條生長狀況。通過試驗發現不同白木香品系的砧木對嫁接成活率無顯著影響,但砧木和芽條生長狀況卻有顯著影響。
嫁接芽片需經歷幾個階段才能夠成活:(1)前期,芽片在薄膜密封的環境中,避免失水;(2)芽片和砧木之間逐漸形成維管束橋[29];(3)芽片和砧木之間形成愈傷組織[30-32];(4)嫁接口愈傷組織逐漸木質化,形成維管束[31-33];(5)芽片上腋芽萌發。芽片和砧木之間形成維管束橋之前,由于缺乏物質交換的通道,芽片無法從砧木汲取養分,此時芽片形成愈傷組織所要求的養分全部由自身提供[34],因此,芽片原有營養積累對嫁接成活有著重要作用。此外,有助于芽片和砧木間形成愈傷組織的其它因子(如植物激素)也影響嫁接成活率。
有研究表明,干旱脅迫對蘋果砧木葉片葉綠體超微結構和抗氧化系統有顯著影響,抑制通過光合作用合成碳水化合物[35]。碳水化合物是愈傷組織形成的能量基礎[36]。在優化條件下生長的白木香植株光合效率較高,積累的碳水化合物等養分較為豐富。相反,在干旱等脅迫條件下生長的白木香植株光合效率降低,積累的碳水化合物等養分較為貧乏。這可能是導致不同條件下培養的白木香芽條和砧木嫁接成活率有顯著差異的原因之一。
外源生長素(auxin,IAA)能提高嫁接口處維管束橋形成的速率及數目,促進愈傷組織的形成[37-39]。IAA能夠促進黃瓜/番茄嫁接嫁接口形成層的活動,從而產生大量愈傷組織,形成維管束橋,提高嫁接苗成活率[39]。說明芽條和砧木內源IAA也有利于提高嫁接成活率。植物激素主要包括脫落酸(abscisic acid,ABA)、赤霉素(gibberellin,GA)和生長素(IAA)。在干旱脅迫下,植物激素響應一般是上調ABA相對含量,下調IAA相對含量,總體上IAA/ABA下降,而ABA/IAA上升[40-41],不利于嫁接口愈傷組織的形成。這可能是干旱等脅迫條件生長的白木香芽條和砧木用于嫁接的成活率不高的另一原因。
金花茶頂芽從營養生長向生殖生長轉換過程中,ABA/GAs、ZRs/GAs和ABA/IAA逐漸提高,而IAA/ABA下降[42]。其它植物枝條在從營養生長向生殖生長轉換過程,IAA/ABA會發生類似變化,分配到生殖構件中的生物量逐漸增多[43-44],從而消耗積累的養分。因此,開花結果的白木香枝條作為芽條,嫁接成活率會降低,白木香優良無性系枝條生長2 a后易轉化為生殖狀態,傾向于開花結果。因此,應采用1.0~1.5 a生的白木香枝條作為芽條進行嫁接。作為砧木的白木香種子苗可以是多年生的,但用于嫁接前,要作斷根移植處理,再復壯4個月,從而使其處于良好的非生殖生長狀態。
優化砧木和芽條生長狀況,芽片的嫁接成活率可達90%以上,但嫁接成活芽片的發芽率卻有較大變化。嫁接后芽片上的芽在一定程度上處于休眠的狀態,砧木鋸頂后雖解除了頂端生長優勢對其萌發的抑制,但其萌發還受多種因素影響。因此,取芽片過程中需避免芽點被破壞。研究表明,充足的光照通過改變內源激素GA、IAA和ABA的含量及比例[45-46],啟動芽的萌發[47-48]。同時,充分光照可提高溫度,加強芽萌發后的光合作用,促進生長。因此,砧木鋸頂后在充足的光照條件下生長,有利于芽片的抽芽。
在試驗過程中發現,砧木鋸頂后死亡是造成成活率降低的另一重要原因。影響砧木鋸頂后死亡的主要因子是鋸頂高度、環境溫度和水分。較低鋸頂的高度(離嫁接口25cm),可有效解除頂端生長優勢,加快芽片的抽芽,但容易使鋸頂砧木死亡;相反,鋸頂的高度越高,這種致死的效果越小,但芽片發芽需要更長的時間。為此,可采用“二次鋸頂”方法。第一次先在苗高的35%~40%位置鋸頂,并通過抹掉不定芽的方式誘導嫁接成活芽片抽芽,待其萌發芽生長穩定后再次鋸頂。
鋸頂后環境溫度過高(35℃以上),水分供應不足,易使砧木快速失水死亡。海南夏季常出現極端性高溫,因此,需避開高溫季節,使用合適透光率的遮陽網遮蔭,同時保證充足水分,有利于提高成活率。
總之,優化各種培養條件可提高芽片的嫁接成活率和發芽率,有助于提高‘熱科2號’嫁接苗的繁殖效率。

