不同腹膜透析置管術對腹部手術或感染史慢性腎衰竭患者的療效分析
楊 文,沈建偉,錢寶鑫,薛茵茵,鄭羽飄,師軍華△
(1.北京大學濱海醫院/天津市第五中心醫院腎內科,天津 300450;2.天津市第三中心醫院消化肝病科,天津 300170;3.南開大學藥學院,天津 300073;4.天津醫科大學三中心臨床學院,天津 300070)
腹膜透析(PD)對血流動力學影響小,設備簡單,居家操作,已成為腎臟替代療法的重要組成部分。傳統術式采用局部麻醉開腹術式,經腹壁小切口所觀察的視野有限,導管末端不能精確定位。對于既往有腹部手術史或慢性腹腔感染的患者而言,腹腔內組織粘連等情況對精確置管的不利影響進一步限制了腹膜透析在這類患者中的應用[1]。筆者發現,在這部分患者中,腹腔鏡的使用尤其具有優勢。本研究目的在于對兩種術式進行對比觀察,為臨床工作提供依據。
1 資料與方法
1.1 一般資料 選擇2011年8月2017年6月在天津市第五中心醫院腎內科住院的符合慢性腎臟病5期(CKD5期)診斷標準的33例慢性腎衰竭患者,且均具有既往腹部手術史。腹腔感染史,其中男18例,女15例,年齡24~68歲。根據患者意愿選擇手術方式,13例行局麻下開腹腹膜透析置管術(A組),20例行全身麻醉(全麻)腹腔鏡下腹膜透析置管術(B組)。該33例患者中,既往剖宮產術后10例(其中1例合并子宮內膜異位癥術后),子宮肌瘤切除術后1例,子宮附件切除術后1例,卵巢囊腫切除術后1例,腎囊腫切除術后1例,肝右葉切除術后1例,膽囊術后病史2例,腹部外傷術后1例,闌尾炎術后10例,闌尾炎保守治療后未發作病史4例,盆腔炎病史1例。B組術中可見不同程度及部位腹腔粘連14例。
1.2 儀器 本研究所使用的腹膜透析導管均為美國Covidien公司Tenckhoff直管,導管全長41 cm,其上固定有2個滌綸卡夫。全套德國STORZ公司腹腔鏡設備,11 mm穿刺套管1個,5 mm穿刺套管1個,腹透管專用隧道針1根。
1.3 方法 由主管醫師詳細告知開腹及腔鏡兩種手術方式的利弊,患者自愿選擇術式并簽署知情同意書。
開腹行腹透管置入的手術方法:患者取仰臥位,取前正中線右側1.5 cm,臍下2 cm處為手術切口,常規消毒鋪巾,利多卡因逐層麻醉,手術刀切開皮膚,鈍性分離皮下組織至腹直肌前鞘,縱向剪開腹直肌前鞘,鈍性分離腹直肌,暴露出腹直肌后鞘及腹膜,于腹膜上剪開直徑約0.5 cm小口行荷包縫合,將腹透管置入腹腔內,在內卡夫下緣收緊荷包并結扎,向腹透管內注入腹透液觀察注入流出是否順利,引流液呈線狀,關閉前鞘,沿前鞘向右旁約5 cm建立皮下隧道,導出腹透管,依次縫合皮下組織、皮膚,碘伏再次消毒,無菌敷料覆蓋切口。腹膜透析管與專用鈦接頭連接,再與延長導管連接,碘伏帽封閉導管出口。
經腹腔鏡行腹透管置入的手術方法:丙泊酚全麻成功后,置患者于平臥位,常規消毒鋪巾,于臍沿下(臍下0.5 cm)做弧形小切口,長約10 mm,氣腹針由此穿刺進腹腔,拔出針芯,建立二氧化碳氣腹,設定腹內壓12 mm Hg,臍沿下(臍下0.5 cm)置入10 mm Trocar(A孔)作為觀察孔,于腹直肌右側外緣臍下3 cm處做5 mm切口,置入5 mm Trocar(B孔)作為操作孔,進鏡后探查腹盆腔內情況及有無腹腔積液,對于有腹腔粘連者酌情行粘連松解術(7例),對于腹盆腔大網膜過長者行大網膜修剪術(1例)。將腹膜透析管經B孔置入腹腔,在腹腔鏡下將透析導管(帶孔端)置入膀胱直腸窩或子宮直腸窩,另一端經B孔穿出,內卡夫位于腹膜外側腹直肌中,以隧道針牽引腹膜透析導管向右上5cm穿出建立皮下隧道,檢查確定液體引流通暢后,連接腹膜透析外接短管。確定術野無活動性出血,徹底放氣,拔出各穿刺器,縫合切口皮膚。
術后24 h行腹部平片檢查并證實腹膜透析導管位置良好。A組患者術后第2天開始給予500 mL 1.5%低鈣腹透液腹腔沖洗連續3 d,術后第5天開始行腹膜透析治療,腹透液從小劑量開始逐漸加量。B組患者均依據國際指南建議,于置管后2周開始行腹膜透析治療[2-3]。等待腹膜透析期間,每周予1 000 mL 1.5%低鈣腹透液腹腔沖洗1次。
1.4 觀察指標 記錄手術時間、術中出血量、術后24 h疼痛程度,術中出血量計量根據術中紗布浸潤面積,一塊腹腔鏡用小紗布浸滿的血量為5 mL,開腹手術一塊方塊紗布浸滿的血量為20 mL。疼痛采用數字評價量表(NRS)[4]進行評估。對導管末端移位、導管引流不暢、腹透液滲漏、腹腔及隧道出口感染等術后導管相關并發癥進行12個月的連續隨訪。采用尿素、血肌酐、肌酐清除率(CCr)、血鈉、血糖、血壓、血鈉等指標進行兩組患者腎功能基線水平及腹透效果的對比[5]。

表1 兩組患者術前臨床指標的比較

2 結 果
2.1 術前臨床指標的比較 兩組患者的性別構成、年齡、Ccr、血鈉、血糖、血壓均差異無統計學意義(P>0.05);A組患者的尿素和血肌酐水平高于B組,差異有統計學意義(P<0.05)。見表1。
2.2 手術時間、術中出血量及術后疼痛等級的比較 B組與A組相比,手術時間更短,術中出血量更少,尤其術后24 h疼痛程度下降,差異有統計學意義(P<0.05)。見表2。
2.3 術后導管相關并發癥發生情況及臨床指標的比較 如表3所示,利用Fisher確切概率法對兩組之間并發癥進行檢驗,B組與A組相比,12月內導管引流不暢及導管移位發生率降低,差異有統計學意義(P<0.05)。在腹透液滲漏方面B組的發生率較A組略高,但差異無統計學意義(P>0.05)。兩組間腹壁疝的發生率、腹腔內和導管出口感染的發生率差異無統計學意義(P>0.05)。此外,腹透6個月及12個月后,均未發現兩種置管方式的腹透效果差異統計學意義(P>0.05)。見表4、5。

表2 兩組患者手術時間、術中出血量及術后 24 h疼痛程度的比較
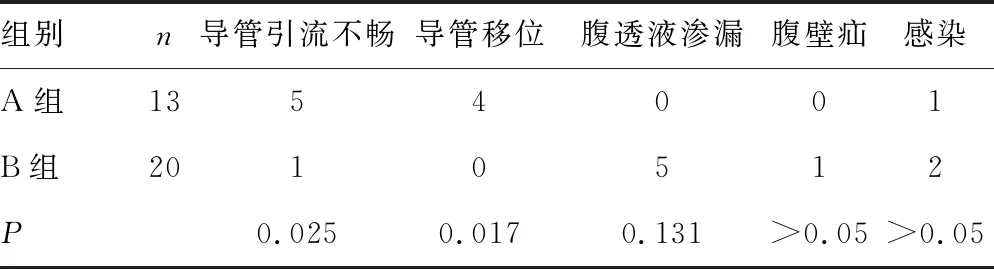
表3 兩組患者導管相關并發癥發生情況的比較(n)

表4 兩組患者術后6個月臨床指標的比較

表5 兩組患者術后12個月臨床指標的比較
3 討 論
腹膜透析是慢性腎衰竭患者重要的腎臟替代療法之一,能更好地保護患者殘余腎功能,對血流動力學影響小,不影響腎移植配型,較血液透析顯示出更好的早期生存率[6-8],但也存在著導管引流不暢及腹透液滲漏等并發癥的可能。
傳統腹透置管一般采用局麻開放手術,主要憑借術者經驗和患者感覺來輔助定位,如果存在腹腔內粘連等復雜情況則容易導致導管置入位置不佳,國外學者曾報道傳統開腹置管腹透液流出不暢的發生率可達10%~22%[9]。
腹腔鏡在腹膜透析置管手術中的應用已日趨成熟[10]。傳統開腹手術和腔鏡置管間的臨床對比也屢見不鮮[11-13],但腔鏡手術費用較高,需要全麻,終末期腎臟病患者麻醉風險較大,普通慢性腎衰竭患者尚不主張常規選擇腹腔鏡置管[14-15]。
但對于有腹部復雜情況的CDK5期患者,腹腔鏡手術可以觀察到整個腹腔內情況,包括是否存在廣泛性粘連或腹膜纖維化等腹膜透析的絕對禁忌證,必要時可以腹腔鏡下分離粘連后,在直視下將腹膜透析導管置入到膀胱直腸窩或子宮直腸窩[16]。本研究中B組的20例患者中7例行腹腔粘連松解術,可能是導管引流不暢率降低的主要因素。有的醫師利用腹腔鏡手術解除起初因為開腹置管而出現的腹腔粘連和大網膜包裹導致的導管引流不暢和移位,也得到了很好的臨床效果[17]。
本研究中,A組患者的尿素和血肌酐水平高于B組,差異有統計學意義(P<0.05)。考慮與患者經濟狀況及依從性有關,經濟條件差的患者依從性差,往往會在腎功能指標更加惡化時才聽從醫師建議進行透析治療,而且更傾向于選擇傳統開腹置管手術方式。
既往有研究顯示腔鏡置管的腹透液滲漏率升高,陳芳等[18]研究發現:腹腔鏡組管周滲漏發生率較開腹手術組高,但這11.1%的患者均術后當天即進行了腹膜透析。本研究中A組沒有滲漏發生,B組出現了5例遠期腹透管周滲漏的情況,其中4名患者體質量指數小于20 kg/m2,提示過于消瘦的患者腹壁薄弱,腹腔鏡手術中難以固定內卡夫,需靠其與組織自行粘連,更易發生管周滲漏。可進行如下改進:(1)借助一次性腹腔鏡縫合器對導管內卡夫周圍腹膜及后鞘進行縫合結扎;(2)手術過程中采用低氣腹壓力,在保證手術所需操作空間的前提下,盡可能將氣腹壓力控制在10 mm Hg以下;(3)術后盡量延長等待時間,至1~2周開始腹透治療,如因病情需要盡早開始治療的,可選擇自動化腹膜透析機進行小劑量腹透治療。
本研究結果顯示,對于有腹部特殊情況的患者而言,除了縮短手術時間、減少術中出血,減輕術后疼痛方面的優點以外,腔鏡置管有其特殊的優勢:可以明顯減少腹透管移位和引流不暢這兩個開腹置管最容易出現的遠期導管相關并發癥。腹部手術史曾被列為腹膜透析的相對禁忌證,腹腔鏡置管的推廣應用有利于打破這一限制,使原本不得不進行血透的患者有了可以選擇腹透的機會,大大降低遠期醫療成本。

