AAV6-hNGFβ轉染對大鼠腦缺血再灌注損傷的保護作用與PI3K/Akt信號通路的關系
羅 荔 張 潔 張 麗 李曉嵐
臨床上缺血性腦損傷(cerebral ischemia injury)較常見,包括動脈粥樣硬化引發的局灶性腦缺血、心跳驟停引發的全腦缺血等,腦卒中具有高發生率和高復發率,已成為世界第2常見死亡原因和主要致殘原因[1]。神經生長因子(nerve growth factor, NGF)是一種非常重要的活性因子,近年來有研究發現,在腦缺血再灌注動物模型中,內源性NGF mRNA表達會顯著增加,從而產生神經保護和修復作用,減輕腦缺血再灌注損傷[2]。在細胞的分化、增殖和凋亡等生命周期活動中,PI3K/Akt信號通路可以發揮調節作用,是一條十分重要的細胞通路[3]。PI3K/Akt信號通路中蛋白激酶B(Akt)磷酸化后處于活化狀態,可以激活許多細胞保護調節機制[4]。本研究基于腦缺血再灌注大鼠模型,通過轉染AAV6-hNGFβ后檢測NGF、Akt、p-Akt、Bcl-2和Bax等蛋白及mRNA水平改變,探討轉染AAV6-hNGFβ減輕大鼠心肌缺血再灌注損傷作用與PI3K/Akt信號通路的關系,為腦缺血再灌注的治療提供分子生物學依據。
材料與方法
1.實驗動物及分組: 12周齡雄性SD大鼠72只,體質量250~300g,由新疆醫科大學實驗動物中心提供,實驗動物許可證號:XJMU201700314。實驗期間動物飼養于新疆醫科大學動物房,每日光照約12h,自由飲食和飲水。為避免實驗環境的改變對大鼠的影響,所有大鼠飼養2周后進入實驗。72只SD大鼠隨機方法分為4組(n=18),即假手術(sham)組、腦缺血再灌注(I/R)模型組、hNGFβ(I/R模型組+AAV6-hNGFβ-EGFP)組和陰性對照(I/R模型組+AAV6-EGFP)組,腦缺血再灌注模型成模后,模型組大鼠經股靜脈注射0.3ml 0.9%氯化鈉注射液,hNGFβ組大鼠股靜脈單次注射0.3ml攜帶hNGFβ-EGFP基因的腺相關病毒(2×1010TU/ml),陰性對照組大鼠股靜脈單次注射0.3ml攜帶EGFP(綠色熒光蛋白)基因的腺相關病毒(2×1010TU/ml),各組注射1周后取材進行腦組織熒光顯色。
2.材料: hNGFβ過表達腺相關病毒AAV6-hNGFβ(中國上海吉瑪制藥技術有限公司),水合氯醛、多聚甲醛(中國成都科龍化工試劑廠),Akt、p-Akt、NGF、Bcl-2和Bax抗體(美國CST公司),TUNEL 凋亡檢測試劑盒、反轉錄酶和熒光定量PCR試劑(中國上海生工生物工程有限公司)。
3.腦缺血再灌注模型的建立: 參照Longa法復制大鼠局灶性腦缺血再灌注動物模型[5]。大鼠用10%水合氯醛麻醉后,分離右側頸總動脈、頸外動脈和頸內動脈,將制備好的線栓插入頸總動脈,推進約18~20mm,遇到阻力即可停止,阻斷2h后,緩慢撥出線栓,扎緊動脈殘端,逐層縫合組織和皮膚,缺血再灌注損傷模型制備成功。假手術組除不插線栓外,其余步驟同上。術后按照改良的神經功能缺損評分(modified neuro-logical severity scores,mNSS)進行評價,對動物進行運動實驗、感覺實驗(視覺、觸覺和本體感覺等)、橫桿平衡實驗和反射檢查,正常為0分,最高分為18分,分值越高神經系統損傷越嚴重。
4.腦梗死面積測定: 分別在1、2、4周對各組大鼠進行腦梗死面積的測定,每組6只,經水合氯醛麻醉后,迅速開胸進行心臟灌流,灌流后快速斷頭取腦,洗凈后將腦組織在-20℃冰箱里冷凍20min,以2mm間距冠狀切成5~6片,用2%的TTC磷酸鹽緩沖液37℃避光染色30min,然后進行4%多聚甲醛固定24h,采用醫用計算機彩色圖像分析系統計算梗死體積。
5.免疫組化和TUNEL凋亡細胞檢測: 用免疫組化方法檢測NGF、Bcl-2、Bax和p-Akt的表達。石蠟切片常規二甲苯,乙醇脫蠟至水,水洗后分別滴加相應一抗,4℃靜置過夜,HRP標記的二抗孵育30min,DAB顯色后蘇木精復染,常規脫水、透明、樹脂封片,鏡下觀察,細胞核呈紫藍色,陽性產物呈棕黃色或黃色。使用TUNEL 凋亡試劑盒進行凋亡細胞檢測,按說明書中鏈霉抗生物素蛋白(SABC)步驟染色,石蠟切片經常規脫蠟,至水,蛋白酶K消化,TdT酶和DIG-dUTP混合液孵育2h,生物素偶聯抗地高辛抗體孵育2h,SABC孵育2h,DAB顯色,蘇木精復染,脫水,封片,細胞核出現棕黃色顆粒為凋亡細胞。
6.Western blot法檢測: 收集各實驗組大鼠腦組織,勻漿處理后抽提總蛋白,BCA法測定蛋白濃度,取蛋白樣品進行SDS-PAGE電泳,電轉到硝酸纖維素膜,5%脫脂奶粉封閉,加入一抗后4℃孵育過夜,然后加入二抗室溫孵育1h后顯色曝光。采用圖像分析軟件Image J分析目的條帶,分別計算目的條帶與內參的灰度值,用兩者比值表示目的蛋白的相對表達強度。
7.反轉錄-聚合酶鏈反應(RT-PCR)檢測: 收集各實驗組大鼠腦組織,總RNA 的提取及熒光定量PCR參照試劑說明書進行實驗。
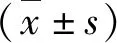
結 果
1.轉染效率觀察及腦缺血再灌注后神經功能評分比較: 大鼠腦缺血/再灌注術造模成功,治療組和陰性對照組分別注射AAV6-hNGFβ-EGFP和AAV6-EGFP 1周后,熒光顯微鏡下觀察腦組織神經元細胞中開始有綠色熒光表達,轉染效率較高,其余各組則無熒光(圖1)。治療組開始注射AAV6-hNGFβ-EGFP后1、2和4周,神經功能評分同模型組及陰性對照組(模型組+AAV6-EGFP)比較,均出現明顯降低(P<0.05,P<0.01),結果見表1。

圖1 大鼠腦組織神經元綠色熒光表達(×200)A.陰性對照組; B.hNGFβ組

表1 各組大鼠神經功能評分比較
與假手術組比較,*P<0.01;與模型組比較,#P<0.05;與陰性對照組比較,△P<0.01
2.各組大鼠腦梗死體積比較:圖2的TTC染色結果顯示腦缺血再灌注損傷4周后腦梗死情況,除假手術組外其余各組均可見白色梗死部分。與假手術組比較,模型組大鼠的腦梗死體積明顯增加,差異有統計學意義(P<0.01);與模型組及陰性對照組比較,hNGFβ組腦梗死體積明顯減少,差異有統計學意義(P<0.05)。模型組與陰性對照組比較,腦梗死體積差異無統計學意義(P>0.05,圖3)。

圖2 各組大鼠腦組織TTC染色A.假手術組; B.模型組; C.陰性對照組; D.hNGFβ組
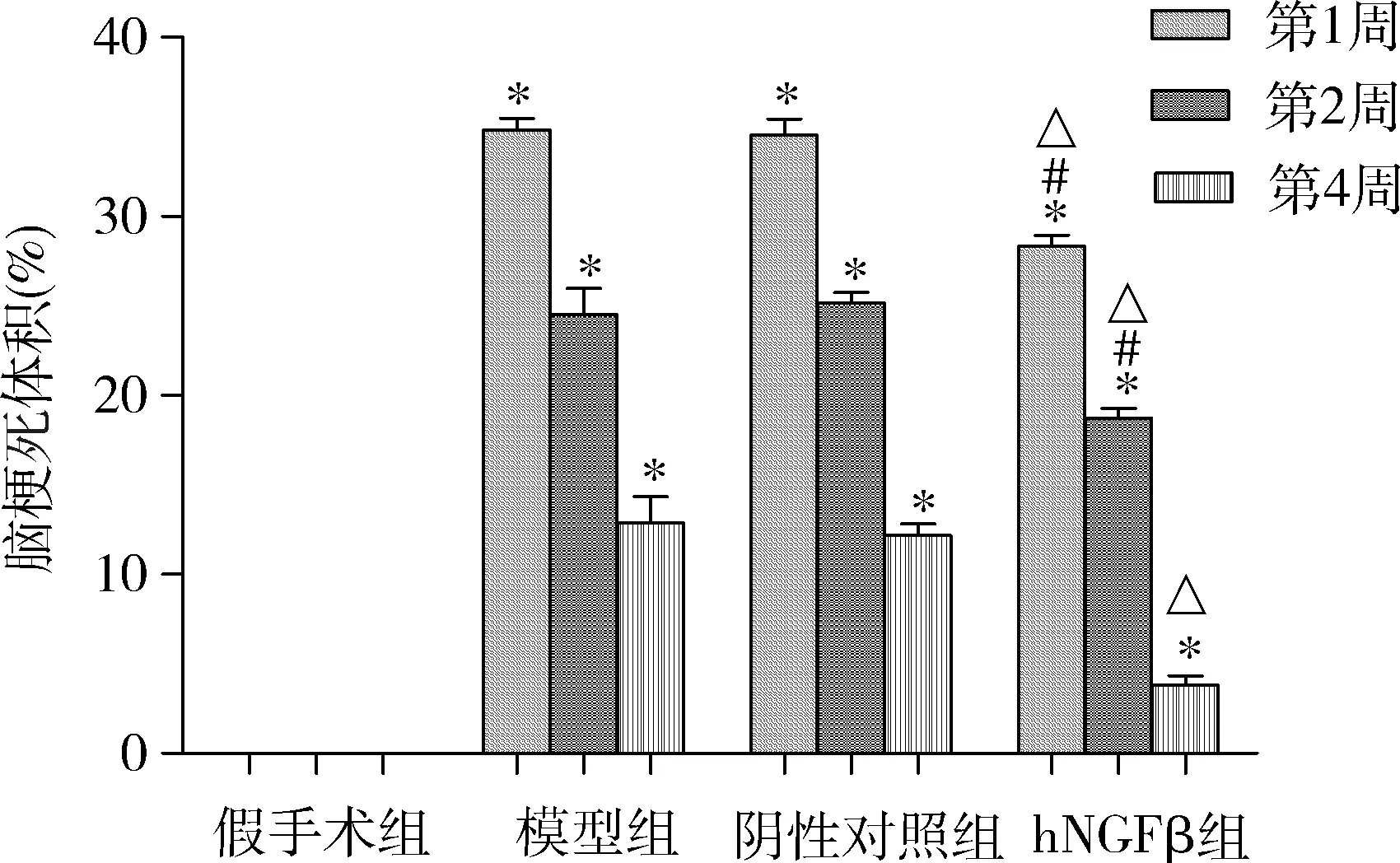
圖3 各組大鼠腦梗死體積比較與假手術組比較,*P<0.01;與模型組比較,#P<0.05;與陰性對照組比較,△P<0.01
3.免疫組化檢測NGF、p-Akt、Bcl-2和Bax表達變化: 假手術組大鼠腦組織皮質區NGF表達較多,p-Akt表達較少;造模成功后4周,與假手術組比較,模型組和陰性對照組皮質區NGF表達減少,p-Akt表達增加;hNGFβ組轉染AAV6-hNGFβ-EGFP 4周后,與模型組和陰性對照組比較,大鼠腦組織皮質區NGF表達顯著升高,p-Akt表達也明顯增加(圖3),Akt的磷酸化水平增強。另一方面,與假手術組比較,模型組大鼠皮質區Bcl-2蛋白表達顯著減少,Bax表達明顯增強;hNGFβ組轉染AAV6-hNGFβ-EGFP 4周后,與模型組和陰性對照組比較, Bcl-2表達顯著增加,Bax表達明顯減少。
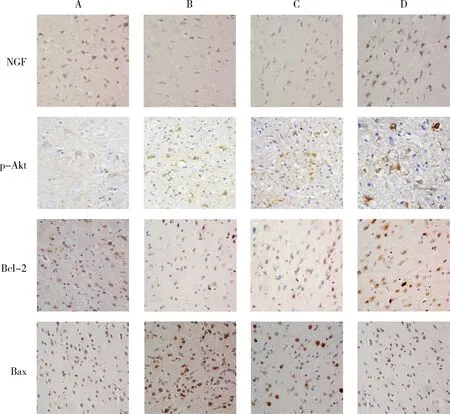
圖4 大鼠腦皮質區NGF、p-Akt、Bcl-2和Bax免疫組化染色(×200)A.假手術組; B.模型組; C.陰性對照組; D.hNGFβ組
4.TUNEL凋亡細胞檢測: 與假手術組比較,模型組大鼠的腦組織內神經元細胞出現棕褐色顆粒,不規則形態的凋亡神經元數量明顯增加;與模型組及陰性對照組比較,hNGFβ組神經元細胞核染色變淺,凋亡細胞明顯減少。模型組與陰性對照組比較,凋亡神經元數量接近(圖5)。
5.轉染AAV6-hNGFβ-EGFP對大鼠腦缺血再灌注后Akt磷酸化水平的影響: 收集各組大鼠腦組織,采用qPCR法和Western blot法檢測腦組織皮質區不同病程(1、2、4周)NGF、Akt和p-Akt的mRNA和蛋白表達水平。與假手術組比較,腦缺血再灌注損傷發生后,模型組和陰性對照組大鼠腦組織NGF的mRNA和蛋白表達明顯減少,Akt的mRNA表達水平顯著升高,p-Akt蛋白表達顯著增強,Akt磷酸化水平(p-Akt/Akt)明顯升高(P<0.01,圖6)。hNGFβ組轉染AAV6-hNGFβ-EGFP后,與模型組和陰性對照組比較,大鼠腦組織NGF的mRNA和蛋白表達顯著增強,Akt的mRNA表達顯著升高,p-Akt表達也明顯增加,Akt的磷酸化水平顯著提升(P<0.01),見圖6。
圖5 TUNEL檢測凋亡細胞(×400)A.假手術組; B.模型組; C.陰性對照組; D.hNGFβ組
6.轉染AAV6-hNGFβ-EGFP對大鼠腦缺血再灌注后Bcl-2和Bax表達影響: 收集各組大鼠腦組織,采用qPCR和Western blot法檢測腦組織皮質區不同病程(1、2、4周)Bcl-2和Bax的表達水平。Bcl-2和Bax的qPCR和Western blot法檢測結果如圖6所示,與假手術組比較,模型組Bcl-2的mRNA和蛋白表達顯著減少(P<0.01),Bax的mRNA和蛋白表達顯著升高(P<0.01),模型組和陰性對照組中,Bcl-2和Bax的mRNA及蛋白表達差異無統計學意義(P>0.05);與模型組比較,hNGFβ組Bcl-2的mRNA和蛋白表達表達顯著升高(P<0.01),Bax的mRNA和蛋白表達顯著減少(P<0.01)。
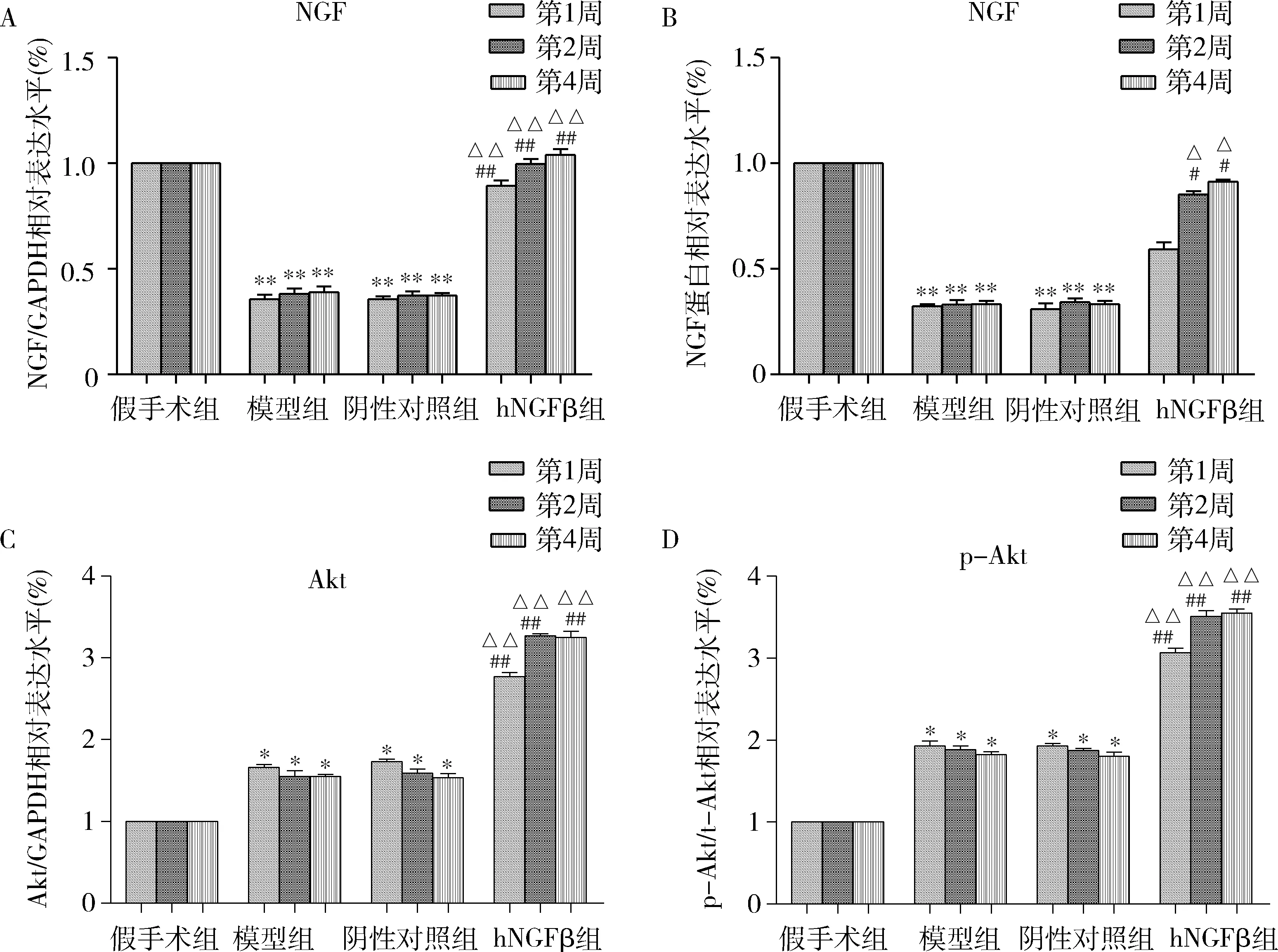
圖6 大鼠腦皮質區NGF、Akt和p-Akt的mRNA和蛋白表達變化A.NGF mRNA變化; B.NGF蛋白變化; C.Akt mRNA變化; D.p-Akt蛋白變化; 與假手術組比較, *P<0.01,**P=0.000;與模型組比較,#P<0.05,##P<0.01;與陰性對照組比較,△P<0.05,△△P<0.01
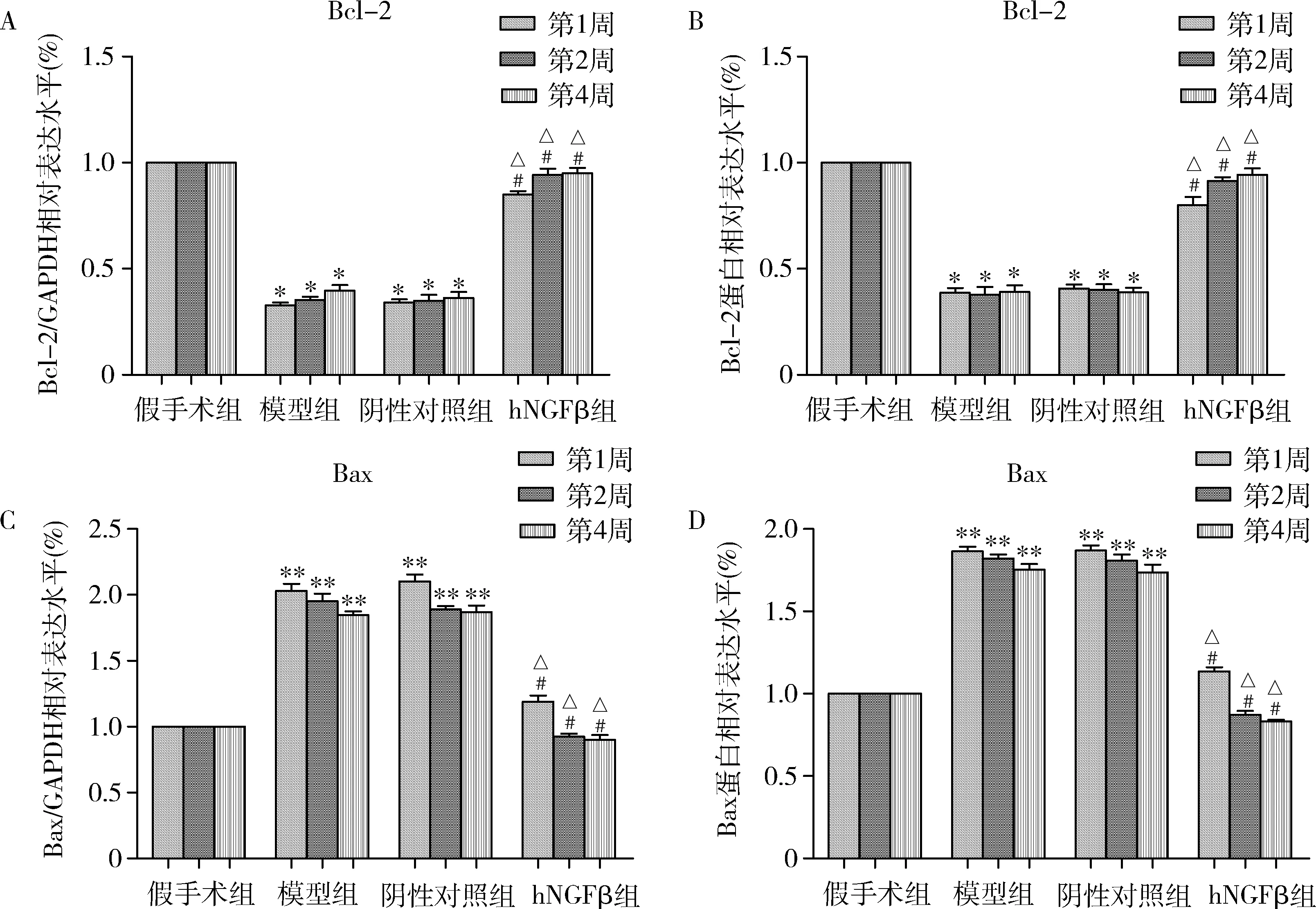
圖7 大鼠腦皮質區Bcl-2和Bax的mRNA和蛋白表達變化A.Bcl-2 mRNA變化; B.Bcl-2蛋白變化; C.Bax mRNA變化; D.Bax蛋白變化; 與假手術組比較, *P<0.01,**P=0.000;與模型組比較,#P<0.01;與陰性對照組比較,△P<0.01
討 論
大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)模型不需開顱,對腦損傷較小,腦病變范圍與人體相近,部位恒定,梗死率高,是最常用的局灶性腦缺血動物模型[5]。模型制備完成后,可通過改良神經功能缺損評分和腦梗死體積對模型進行評價。本研究在腦缺血再灌注損傷大鼠體內注射AAV6-hNGFβ-EGFP,進行基因治療,使合成產物 hNGFβ得到高表達,從而減輕大鼠腦缺血再灌注損傷。實驗結果表明,治療組開始注射AAV6-hNGFβ-EGFP后,神經功能評分同模型組與陰性對照組比較,均出現明顯降低。此外,大鼠的腦梗死體積計算結果也表明,轉染AAV6-hNGFβ-EGFP可以減少大鼠腦缺血再灌注損傷后的腦梗死體積。目前以改變細胞遺傳物質為基礎的基因治療已得到廣泛應用,席聰等[6]在I/R大鼠中注射rAAV-PR39-ADM過表達抗菌肽(PR39)和腎上腺髓質素(ADM)后,可改善大鼠腦缺血再灌注后局部供血,促進血管再生,保護神經元,減輕腦缺血再灌注損傷。
腦缺血再灌注損傷機制較復雜,包括細胞內鈣超載、自由基生成及高能磷酸化合物缺乏等[7~9]。在腦缺血再灌注程中,能保護神經細胞的因子減少,損害神經細胞的因子增多(如氧自由基、炎性和凋亡因子等),從而嚴重影響腦缺血性腦卒中患者的愈后,而保護神經元細胞并減少其凋亡,可以防止腦卒中引起的神經功能障礙[10~12]。作為神經營養因子家族(NTFs)中一種非常重要的活性因子,NGF在腦內主要來源于神經元和膠質細胞。腦缺血性損傷發生后,NGF不僅可以保護和減少神經元損傷,還可以促進神經元的修復,提高神經元存活率。腦缺血損傷發生早期,NGF會出現短時反應性表達,發揮神經元保護作用,但表達水平和時間有限,難以發揮全面持久的神經元保護作用。
對于腦缺血后神經損傷的保護而言,能持續增強NGF表達的治療方法,具有十分重要的意義。在細胞的分化、增殖和凋亡等生命周期活動中,PI3K/Akt信號通路可以發揮調節作用,該通路由許多靶點組成,其中蛋白激酶B(Akt)是最關鍵的一個,因為Akt磷酸化后處于活化狀態,通過激活可作用于下游的B細胞淋巴瘤/白血病2(Bcl-2)家族等靶點,可降低下游Bax蛋白的表達,抑制凋亡,從而起到神經保護作用[13]。本研究結果表明,與假手術組比較,NGF表達顯著下降,PI3K/Akt通路受到抑制,Bcl-2蛋白表達顯著降低,Bax蛋白表達明顯增加,差異有統計學意義(P<0.05);與模型組和陰性對照組比較,hNGFβ組NGF表達顯著升高,PI3K/Akt通路得到激活,Bcl-2蛋白表達也顯著升高,Bax蛋白表達明顯降低,差異有統計學意義(P<0.05)。轉染AAV6-hNGFβ-EGFP可提高NGF表達,激活大鼠PI3K/Akt通路,提高Bcl-2蛋白表達,抑制Bax蛋白增加,對大鼠腦缺血再灌注損傷起到保護作用。
在腦缺血再灌注動物模型中,提高NGF的表達,可激活PI3K/Akt通路的多個靶點,調控下游相關蛋白表達,發揮對腦缺血再灌注損傷的保護作用。Saito等[14]研究發現腦缺血損傷后,由于PI3K與NGF受到抑制,磷酸化PRAS(pPRAS)的表達出現下調,而加入NGF可以提高小鼠中pPRAS的表達,從而增強神經保護作用。遠端缺血后處理可以通過上調內皮型一氧化氮合酶(eNOS),激活PI3K/Akt途徑而產生神經保護作用,減輕全腦缺血再灌注損傷[15]。此外,NGF還可通過激活PI3K/Akt途徑,減少內質網應激導致的心肌細胞凋亡,對心肌缺血再灌注損傷進行保護[16]。另一方面,NGF還可通過多種途徑保護神經元損傷,如抵消興奮性氨基酸毒性、調節神經元胞質內Ca2+水平和促進自由基的清除等。Rami等[17]研究發現,β2腎上腺素受體激動劑克倫特羅具有神經保護作用,其保護機制與上調NGF表達有關,NGF上調可增強鈣蛋白酶抑制蛋白的表達而產生神經保護效應。
Zhang等[18]研究發現,在腦卒中早期阻斷TRPV2表達后,可以通過MAPK/JNK途徑誘導NGF分泌,促進星形膠質細胞的增殖而產生神經保護作用。NGF的神經元保護作用還與轉錄因子AP-1的激活有關,Shashoua等[19]設計了一種NGF的模擬短肽,可以通過激活轉錄因子AP-1來進行腦卒中的治療。
綜上所述,本研究基于腦缺血再灌注大鼠模型,通過神經行為學、梗死體積、免疫組化和分子生物學等方法,發現轉染AAV6-hNGFβ可增強大鼠腦組織NGF表達,進而激活PI3K/Akt通路,提高Bcl-2蛋白表達,降低Bax蛋白合成,抑制凋亡,對大鼠腦缺血再灌注損傷起到保護作用,為腦卒中的臨床治療提供依據。

