內鏡下黏膜剝離術與黏膜切除術治療早期胃癌的臨床對照研究
呂培標 李興華 王志發 李祥興 劉 潔 李 俊
1.中山大學附屬第三醫院粵東醫院普通外科,廣東梅州 514000;2.中山大學附屬第三醫院粵東醫院消化內科,廣東梅州 514000
內鏡下黏膜剝離術(ES D)是建立在內鏡下黏膜切除術(EMR)基礎上的[1-2]。EMR 起源于1973年,Dyhie 等采用黏膜下生理鹽水切除結腸無蒂息肉,隨著技術不斷發展,1984 年多田正弘將此項技術診治早期胃癌,1994 年Takekoshi 等將陶瓷絕緣頭的新型電刀應用于臨床,1999 年日本Gotoda 等將陶瓷絕緣頭的新型電刀應用于病變切除,發展成為ESD[3-4]。我國2006 年復旦大學附屬中山醫院首次將ESD 引入臨床,目前鮮有ESD 在梅州地區早期胃癌患者應用的報道[5-6]。筆者通過分析2016年4 月~2018 年4 月我院收治的早期胃癌患者臨床資料,擬探討ESD 與EMR 治療早期胃癌(EGC)的效果差異,現報道如下。
1 資料與方法
1.1 一般資料
選 取2016 年4 月~2018 年4 月 我 院 收 治的60 例早期胃癌患者臨床資料進行回顧性分析,依據手術方式不同進行分組,內鏡下黏膜切除術(EMR)組30 例,男17 例,女13 例,年齡33 ~75歲,平均(55.4±10.6)歲,腫瘤位置:胃竇15 例,賁門胃底10 例,胃角部5 例,腫瘤大小11 ~34mm,平均(19.5±8.4)mm,內鏡下黏膜剝離術(ESD)組30 例,男16 例,女14 例,年 齡34 ~76 歲,平均(56.8±11.2)歲,腫瘤位置:胃竇14 例,賁門胃底9 例,胃角部7 例,腫瘤大小12 ~33mm,平均(19.0±8.0)mm,納入標準:(1)通過內鏡檢查結合組織病理學檢查,確診為早期胃癌患者[7-8];排除標準:(1)排除其他類型惡性腫瘤患者;(2)排除凝血功能障礙者;(3)排除嚴重心、肝、腎功能障礙者。本研究在我院倫理委員會批準下進行,兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。
1.2 方法
EMR:(1)做好標記:通過內鏡觀察病變部位,確認病灶侵犯位置,如病灶只是侵犯黏膜層,在病灶周圍5mm 位置,通過凝固電流多點黏膜電灼,以電灼白點作為標志;(2)黏膜下注射液體:確認病灶范圍,黏膜下注射下液體,如腎上腺素混合美藍、生理鹽水,每個標記位置注射液體2mL,以病變位置粘膜呈現均勻隆起為止;(3)切除術治療:透明帽輔助黏膜切除術適用于廣基息肉或者是平坦類型病灶,將病灶黏膜吸附在透明帽內,通過收緊圈套器套住病灶黏膜,將套住的病變黏膜,從透明帽推出,給予高頻電流將病變切除。圈套器切除可以治療表面隆起病灶,等到高頻電流圈套器釋放,將隆起的病灶套住,收緊圈套器,進行電凝切割;(4)做好創面處理:如病變位置有出血或者病變殘留,采用熱活檢鉗進行凝固治療;(5)進行標本固定,送檢病理科[9-10]。
ESD:(1)確定病灶范圍、性質、浸潤深度:對病變范圍和深度進行常規性內鏡檢查,主要觀察病灶所在位置、大小、形態,并且結合染色結果,對病灶局部放大,對病灶具體特點進行確定。(2)標記病灶:在距離病灶邊緣3 ~5mm 的位置進行電凝標記。(3)黏膜下方的注射:病灶邊緣標記的位置外側,做多點黏膜下注射,注射液體可以采用生理鹽水、甘油果糖、透明質酸鈉。抬起病灶,和肌層分離,這樣可以更加完整的將病灶切除,避免固有肌層的損傷,降低穿孔、出血的發生率[11-12]。(4)切開病灶周圍黏膜:沿著標記位置外側緣逐步切開病灶周圍部分黏膜,將黏膜下層深入切開,將周圍全部黏膜切開。切開的位置在病變遠側端,如果切除過程中有困難,采用翻轉內鏡法。如果發生出血,注意做好電凝止血。(5)黏膜下剝離:進行黏膜剝離前,對病灶特點進行判定。隨著時間推移,黏膜下注射的液體逐步吸收,如果有必要,采用黏膜下注射,保持病灶充分抬舉,按照病灶特點,選擇適宜的內鏡和附件。(6)保持術野清晰:對術野進行剝離過程中,如果病灶很難暴露,術野不清晰,采用透明帽將黏膜下層結締組織推開,充分的顯露術野。根據病變部位,選擇合適的手術器械,做好黏膜下剝離,剝離過程中,注意沿著拉鏡或旋鏡沿病變基底切線方向,做好剝離。根據患者自身需要,變換患者體位,對病變組織進行牽引垂掛,利于病灶切開和剝離。(7)做好創面處理:病灶剝離之后,對創面上的血管進行預防性止血處理。如果有滲血部位,采用止血鉗、氬離子血漿凝固術(APC)進行處理,對局部剝離較深、肌層有裂隙者,采用金屬夾夾閉。(8)做好并發癥處理:較小的黏膜下層血管,采用直接電凝,較粗的血管,止血鉗鉗夾后電凝止血。黏膜剝離過程中,如果出血,先采用冰生理鹽水沖洗創面,可用APC 或止血鉗鉗夾進行電凝止血。如果上述止血處理不成功,可以采用金屬夾夾閉出血點,注意減少后續黏膜下剝離操作。如果手術過程中出現穿孔,線對裂口進行縫合,然后再進行剝離,也可以先進行剝離,然后再縫合裂口。手術操作時間長,患者可能有大量氣體積聚,壓力相對較高,較小肌層裂傷可能造成穿孔,要注意對腔內氣體進行抽吸。
1.3 觀察指標
觀察兩組患者創面直徑、手術時間、胃腸道恢復時間、住院時間情況;觀察兩組患者病變整塊切除率、完整切除率情況;觀察兩組患者并發癥情況主要包括術后出血、術后穿孔、術后6 個月復發率、術后殘留率情況,對于術后出血、術后穿孔患者給予補充外科手術治療。術后6 個月進行患者隨訪,觀察復發率。殘留手術結束后采集縱向切緣或者橫向切緣周圍組織病理結果,進行殘留率評價。
表1 兩組患者創面直徑、手術時間、胃腸道恢復時間、住院時間比較
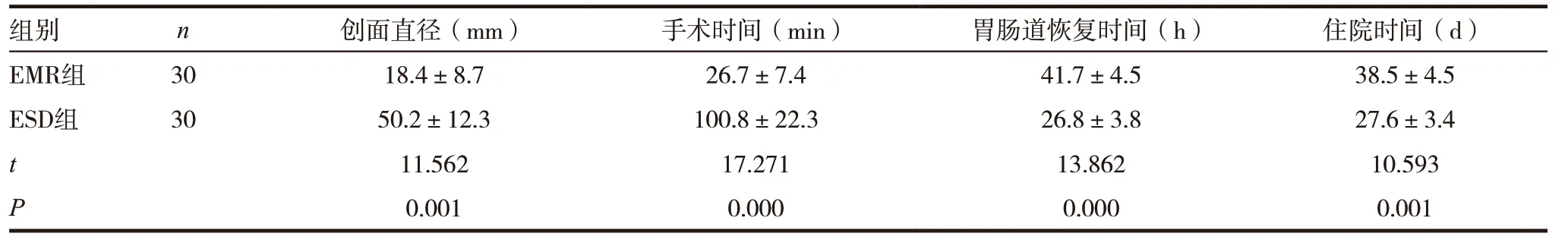
表1 兩組患者創面直徑、手術時間、胃腸道恢復時間、住院時間比較
組別 n 創面直徑(mm) 手術時間(min) 胃腸道恢復時間(h) 住院時間(d)EMR組 30 18.4±8.7 26.7±7.4 41.7±4.5 38.5±4.5 ESD組 30 50.2±12.3 100.8±22.3 26.8±3.8 27.6±3.4 t 11.562 17.271 13.862 10.593 P 0.001 0.000 0.000 0.001
1.4 統計學處理
采用統計學軟件SPSS20.0 建立數據庫,計量資料采用t檢驗,計數資料采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者創面直徑、手術時間、胃腸道恢復時間、住院時間比較
ESD 組患者創面直徑、手術時間高于EMR 組,胃腸道恢復時間、住院時間均低于EMR 組,差異有統計學意義(P<0.05)。見表1。
2.2 兩組患者病變整塊切除率、完整切除率情況比較
ESD 組患者病變整塊切除率、完整切除率均高于EMR 組,差異有統計學意義(P<0.05)。見表2。
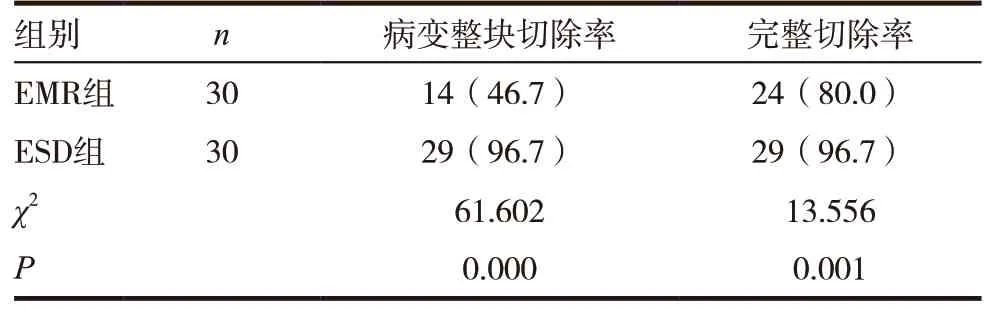
表2 兩組患者病變整塊切除率、完整切除率情況比較[n(%)]
2.3 兩組患者并發癥情況比較
兩組患者出血、穿孔發生率比較,差異無統計學意義(P>0.05),ESD 組患者復發率、殘留率低于EMR 組,差異有統計學意義(P<0.05)。見表3。

表3 兩組患者并發癥情況[n(%)]
3 討論
ESD 是建立在EMR 基礎上逐步發展的手術方式,其可以依據病灶不同位置、大小、浸潤深度情況,選擇有效的電切刀,在內鏡觀察下,逐步將黏膜層與固有肌層之間的組織進行分離,最后逐步將病變黏膜和黏膜下層進行完整的剝離[13-14]。ESD 手術過程中,可以反復性在黏膜下注射液體,從而維持病灶的充分性抬舉,如果術野不是十分清晰,采用透明帽,根據病灶具體特點,選擇適宜性的內鏡和附件。如術中出血,采用各類切開刀、熱活檢鉗及止血夾進行治療[15-16]。如切割過程中,要對裸露血管進行觀察,并且及時給與預防性止血措施,避免出血的發生。一些潰瘍面要在腫瘤切除時,也一并完整切除,做好潰瘍面周圍血管預防性止血處理。
本研究結果表明,ESD 組患者創面直徑、手術時間高于EMR 組,胃腸道恢復時間、住院時間均低于EMR 組,提示筆者根據早期胃癌患者臨床特點,根據病灶部位、大小等特點,給予ESD 手術治療,其創面直徑、手術時間雖然稍高于EMR,但是胃腸道恢復時間、住院時間低于EMR,最大限度的保留了正常組織和功能,促進患者術后盡快恢復,利于患者耐受。ESD 組患者病變整塊切除率、完整切除率均高于EMR 組,ESD 組患者復發率、殘留率低于EMR 組,提示ESD 可以提供完整的組織標本,明確了腫瘤的浸潤、分化情況,可以將大面積、形態不規則腫瘤,一次性從固有肌層剝離下來,進而提高了病變整塊切除率、完整切除率,這在一定程度上也降低了病灶的復發率和殘留率。
綜上所述,ESD 治療早期胃癌患者,病灶切除徹底,預后良好,優于EMR,值得臨床推廣應用。

