西部遵義(非省會城市)首次開展肺移植術在終末期肺部良性疾病中的應用
郭 強,陳 成,宋永祥,李 劍,湯 陽,瞿文棟,陳安平,韓 旭,左杰斌,徐 剛
(遵義醫科大學附屬醫院 胸外科,貴州 遵義 563099)
從20世紀80年代早期,肺移植(Lung transplantation,LT)從最開始的實驗性治療迅速發展成為終末期肺病患者的最終治療模式[1]。近年來我國東部沿海發達省份LT發展迅速,但因西部省份的經濟發展、交通基礎設施與其存在較大的差距,尤其是西部非省會城市開展肺移植受多方面因素的制約。現通過分析2017年以來遵義醫科大學附屬醫院開展的7例肺移植術患者的臨床資料,總結在西部非省會城市開展肺移植術的經驗。
1 資料與方法
1.1 供受體的一般資料 收集遵義醫科大學附屬醫院2017年至今7例肺移植供受體的臨床資料。2例DBD供體來源于貴州省外,5例DBD供體來源于貴州省內。受體全部為男性患者,年齡(51±15)歲。受體的基礎疾病包括肺塵埃沉著病(塵肺病)4 例,慢性阻塞性肺疾病2 例,間質性肺病1例。3例受體行序貫式雙肺移植,余4例受體行單肺移植。7例肺移植受體中2例經評估后采用體外膜肺氧合(Extraco-rporeal membrane oxygenation,ECMO)建立體外循環。
1.2 方法
1.2.1 供體肺獲取及轉運 獲取供體肺步驟參照文獻[2-3]。待供體心肺器官離體后,經肺靜脈逆行灌注肺組織,觀察肺動脈回流液基本澄清后,4℃ RLPD液保存。省外供體肺冷缺血時間約7 h,我院供體肺冷缺血時間低于1 h。
1.2.2 受體術式 氣管插管,氣囊漂浮導管術中監測肺動脈壓,根據肺動脈壓、氧飽和度、二氧化碳潴留等指標,評定是否予以ECMO建立體外循環及行序貫式雙肺移植的先后順序。側臥位,切口為第5肋間腋下切口,供肺吻合順序:支氣管-肺動脈-心房袖。開放肺動脈排氣后再打結肺靜脈吻合口處最后一針縫線以防止氣體栓塞。吻合完畢后,徹底止血留置胸管后關胸。
1.2.3 術后管理 肺移植術后2例受體繼續使用ECMO。7例受體術后均在ICU內帶有氣管插管,給予呼吸支持治療、廣譜抗生素泰能抗感染、更昔洛韋抗病毒感染、卡泊分抗真菌感染、免疫抑制、液體輸入量管理、呼吸道管理等綜合治療,未經免疫誘導治療。均在24 h內脫離有創呼吸機,常規使用纖支鏡清理呼吸道分泌物,使用他克莫司+驍悉+糖皮質激素抗排斥。
1.2.4 觀察指標 評估供體肺的質量,觀察轉運時間、冷缺血時間。統計受體手術時間、冷缺血時間、ICU停留時間、ECMO使用時間、入量(液體入量和胃腸入量)及出量(尿量和引流量)、動脈血氧分壓(arterial oxygen partial pressure,PaO2)、二氧化碳分壓(arterial carbon dioxide pressure,PaCO2)、住院時間、以及術后隨訪情況(并發癥及預后)。

2 結果
2.1 供受體圍術期指標 外省供體肺冷缺血時間為6~7 h,我院(省內)供體肺冷缺血時間小于1 h。7例受體手術時間為(44±64)min。4例單肺移植冷缺血時間為(75±45)min,3例雙肺移植冷缺血時間為(140±20)min。ICU停留時間為14(5~23)d,術中有2例受體使用ECMO,術后12 h停用。住院時間為53(33~73)d。7例肺移植受體術中液體入量為4 500(3 200~6 920)mL,出血量為675(0~1 800)mL,輸血量為850(0~2 100)mL。
7例肺移植受體術后3d 內入量和出量的比較見圖1,術后3d中每日的出量均大于入量,差異均有統計學意義(P< 0.05)。7例受體術前PaO2為(80±10)mmHg,術后3d中的PaO2均大于術前,差異均有統計學意義(P< 0.05,見圖2)。7例受體術前術后PaCO2變化不明顯,差異不具有統計學意義。
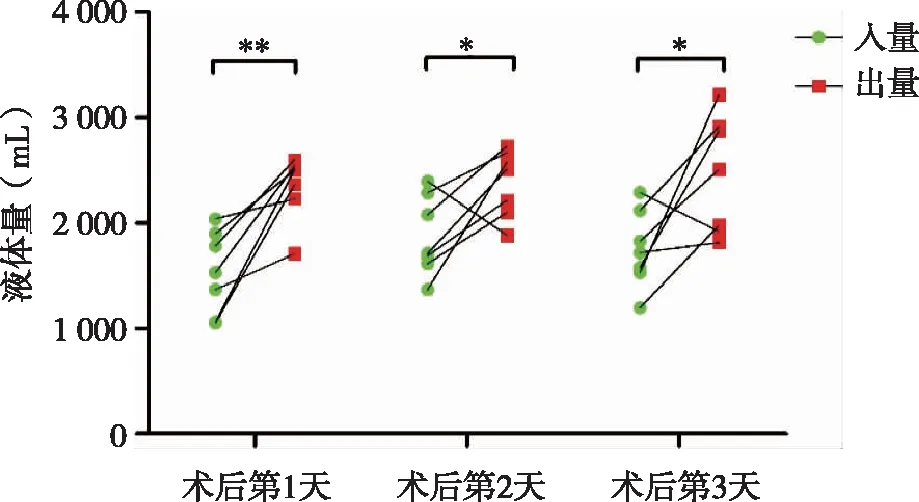
* :P < 0.05; ** :P < 0.01。圖1 7例肺移植受體術后3d入量與出量比較
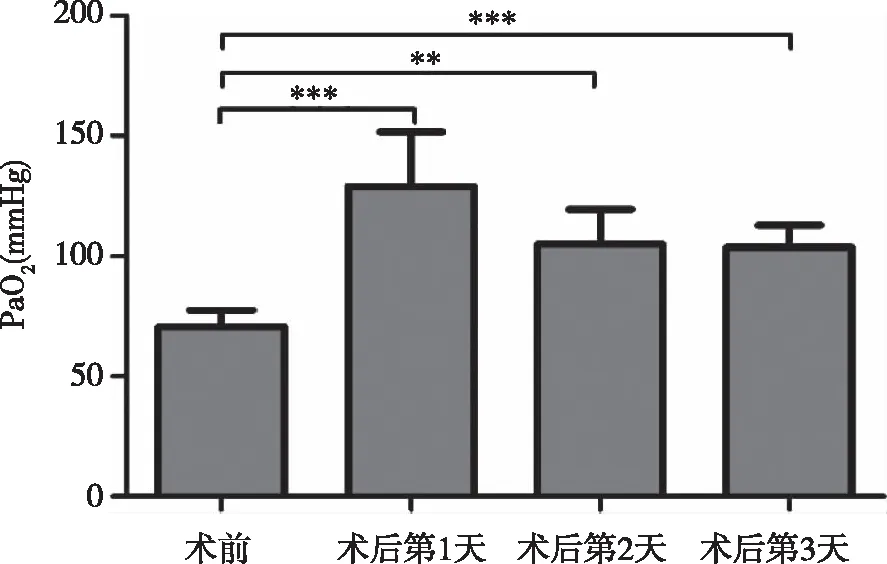
** :P < 0.01; *** :P < 0.001。圖2 7例肺移植受體術后和術前PaO2比較
2.2 肺移植受體預后情況 1例受體術后出現氣道吻合口狹窄,經纖維鏡吻合口氣管清除支氣管肉芽+球囊擴張+覆膜支架植入術治療后痊愈。1例受體術后發生急性排斥反應,2例受體術后出現慢性排斥反應。移植術后有6例受體存在肺部細菌感染,其中1例省外供體來源的受體合并有真菌感染,在術后20d時因肺部感染死亡,其余受體均痊愈出院,肺功能明顯改善,隨訪至今恢復良好。
3 討論
近十幾年里,肺移植術在終末期良性肺疾病中的應用已在東部沿海地區廣泛開展,如無錫[4]、上海[5]、廣州[6]、杭州[7]。而我省處于我國西南部,交通和經濟發展不如沿海發達省份。我院是貴州省首次開展肺移植手術的醫院,在非省會城市開展肺移植已遠遠落后于我國東部沿海城市。部分患者因終末期肺疾病需要行肺移植術挽救其生命,但因經濟原因無法接受肺移植治療,而導致肺移植開展存在困難。另外,我國器官自愿捐獻數量遠遠不及西歐國家,許多潛在供體肺無法得到合理的維護,或標準供體肺不足和邊緣供肺應用于臨床終末期良性肺疾病的治療,不利于肺移植術的發展。我院在開展肺移植術過程中因供體肺存在冷缺血時間較長和邊緣供肺的應用等因素可能增加了其受體死亡的風險。
供體的選擇及保存是肺移植成功的關鍵因素之一。我們選擇供體肺標準參照文獻[8]。供肺獲取前需要常規利尿、吸痰、抗感染等以維護好供體肺[2,8-9],獲取時采用順逆行兩種灌注法,4℃ RLPD液保存。選擇肺移植受體時,關鍵在于移植能使受體獲益,延長生存期或提高生存質量。肺移植術后使用他克莫司+驍悉+糖皮質激素+廣譜抗生素+抗真菌+抗病毒藥物預防手術相關并發癥、氣道并發癥、排斥反應等的發生。
我國早期開展肺移植術的單位報道了3例終末期肺氣腫患者行單肺移植治療,其中1例術后肺功能明顯改善;1例術后15d死于急性4級重癥排斥反應;1例術后因對側肺急性過度膨脹,而行胸腔鏡下對側肺減容術糾正,術后第71天出院 ,肺功能明顯改善[10]。胡春曉等報道2002年9月至2004年12月為11例終末期肺病患者成功進行了肺移植,其中1例于術后15 d死于急性排斥反應;1例于術后30d死于全身臟器功能衰竭;1例術后死于自身肺和移植肺感染[11]。而我院是貴州省最早開展肺移植的單位,開展之初在經驗豐富的肺移植中心的指導及協助下完成肺移植術,累計肺移植例數居貴州省第一。7例受體術后未出現外科技術相關并發癥,無支氣管胸膜瘺、胸腔出血、肺動靜脈狹窄等。因此,西部非省會城市在開展肺移植初期時應在經驗豐富的移植中心的指導及協助下完成肺移植手術,能有效的減少外科技術并發癥,以使受體獲益。
移植后受體肺部感染是常見的肺移植并發癥和死亡原因之一[12],致病菌多為細菌[13-14]。在抗感染治療方面,未發現致病菌時常經驗性用藥,多數肺部感染者治愈,但對于多重耐藥菌來說,經驗性用藥存在極大的局限,并不能有效的殺死耐藥菌,尤其是對嚴重感染合并其它疾病的患者。移植術后應盡早得到藥敏結果,根據藥敏結果合理用藥。本組1例受體術后因肺部感染死亡。痰培養發現痰液中存在鮑曼不動桿菌,與供者痰培養結果相同。因此,本例受體死亡考慮與肺移植感染有關。此外,還考慮與真菌感染、多種高危因素及供體肺質量缺陷有關。因此,在開展肺移植的單位早期應做好供受體嚴格的選擇和圍術期的規范管理,以減少移植受體因肺部感染死亡率。
目前,多數人認為氣道吻合口狹窄(Airway complications,AC)發生率10%~15%[15-17],而氣道吻合口狹窄是肺移植術后最常見的AC[16,18],其狹窄最主要的原因為吻合口處的供血不足導致愈合不良。江賢亮等回顧性分析安徽省立醫院8 例肺移植病例的臨床資料,術后5例出現氣道狹窄[19]。本組1例患者術后2月時發現氣道吻合口狹窄嚴重,經纖維支氣管鏡吻合口氣管清除支氣管肉芽+球囊擴張+覆膜支架植入術治療后患者呼吸困難立刻得到改善,效果顯著。
綜上所述,肺移植(LT)已成為終末期肺病患者的最終治療模式[1],但西部非省會城市開展肺移植術存在交通局限性,供體轉運時間過長的弊端會一定程度上影響受體術后的康復,因此如果能就近維護及利用省內的潛在供體,縮短冷缺血時間,是保證術后順利恢復的重要因素。其次,在受體的選擇上,在初期開展肺移植術的單位,應謹慎選擇合適的受體,做好圍手術期各項準備,包括合理的HLA配型、針對受體個體化的呼吸道管理、嚴格控制院內感染的發生。早期通過經驗更豐富的肺移植中心的指導及協助下,逐步建立好規范化流程,做好供受體嚴格的選擇,圍術期的規范管理,在西部非省會城市開展肺移植術也是切實可行的,通過總結我院初探經驗,也對于在全國范圍內推廣及普及肺移植術提供一定的參考價值。

