下調(diào)PKC-α基因?qū)Υ笫蟾鼓ね肝龀瑸V衰竭的影響研究*
李玲麟,畢丹青,楊艷萍,何 杰,袁紅伶
(昆明醫(yī)科大學(xué)第一附屬醫(yī)院,昆明 650032)
腹膜透析是治療終末期腎病(ESRD)的一種有效的替代療法[1]。ESRD若不能得到及時(shí)診治,腎單位會(huì)進(jìn)行性破壞,機(jī)體也會(huì)因代謝產(chǎn)物無(wú)法排出而破壞內(nèi)環(huán)境的穩(wěn)定。20世紀(jì)60年代首次引入腹膜透析作為腎臟替代療法,全球約11%的腎臟替代治療患者接受腹膜透析[2]。與血液透析相比,腹膜透析具有操作簡(jiǎn)便、早期生存率較高、殘腎功能保護(hù)作用良好等優(yōu)點(diǎn)[3]。然而,近40%的患者接受3年腹膜透析后會(huì)發(fā)生超濾衰竭,這是長(zhǎng)期腹膜透析患者終止治療的主要原因[4]。以往的研究表明,小分子RNA、蛋白激酶、細(xì)胞因子等因素均與超濾衰竭有關(guān)[5-7]。
蛋白激酶C(PKC)屬于絲/蘇氨酸蛋白激酶家族,在細(xì)胞增殖、分化和凋亡等過(guò)程中發(fā)揮重要作用,目前至少有12種同工酶亞型[8]。PKC-α是經(jīng)典PKC家族成員之一,負(fù)責(zé)維持細(xì)胞增殖與凋亡之間的平衡。PKC-α在包括癌癥在內(nèi)的幾種主要疾病的發(fā)生、發(fā)展中起著重要作用[9]。研究發(fā)現(xiàn)PKC-α與腫瘤多藥耐藥有關(guān),用siRNA干擾PKC-α基因可部分逆轉(zhuǎn)腫瘤細(xì)胞耐藥性[10]。另外有研究指出PKC-α可誘導(dǎo)血管內(nèi)皮生長(zhǎng)因子(VEGF)的表達(dá)從而促進(jìn)人內(nèi)皮細(xì)胞的血管生成[11]。高糖腹膜透析液及尿毒癥環(huán)境是誘發(fā)VEGF表達(dá)增加的關(guān)鍵因素,可導(dǎo)致血管新生最終導(dǎo)致腹膜超濾衰竭[12]。然而,有關(guān)超濾量與PKC-α基因之間的關(guān)系研究較少。因此,本文擬研究下調(diào)PKC-α基因?qū)Υ笫蟾鼓ね肝鲞^(guò)程中超濾衰竭的影響。
1 材料與方法
1.1細(xì)胞培養(yǎng)及轉(zhuǎn)染 設(shè)計(jì)3組siRNA序列(廣州Ribuo Biotech公司)見(jiàn)表1,分別退火后連接到pLK0.1 TRC克隆載體上構(gòu)建shRNA;以質(zhì)粒shRNA∶psPAX2∶pMD2G=4∶3∶1的比例轉(zhuǎn)染293T細(xì)胞包被shRNA慢病毒,慢病毒感染NRK-52E細(xì)胞(美國(guó)ATCC公司)后提取RNA。real-time RT-PCR檢測(cè)PKC-α基因的下調(diào)情況和VEGF基因的表達(dá)情況。
1.2實(shí)驗(yàn)材料及分組 7周齡雄性SD大鼠56只購(gòu)于河南省實(shí)驗(yàn)動(dòng)物中心,體質(zhì)量190~210 g。按實(shí)驗(yàn)大鼠飼養(yǎng)規(guī)范飼養(yǎng),分為7組,每組8只。正常對(duì)照組無(wú)處理;假手術(shù)組行雙側(cè)腎臟包膜剔除術(shù),左右腎相隔1周;尿毒癥組行5/6腎臟切除術(shù);腹膜透析2周組(PD2組)行5/6腎臟切除術(shù)后,腹膜透析2周;腹膜透析4周組(PD4組)行5/6腎臟切除術(shù)后,腹膜透析4周;腹膜透析4周后腹腔注射空質(zhì)粒組(NC組)行5/6腎臟切除術(shù)后,膜透透析4周,并于第3、4周腹腔注射0.1 mg/kg空質(zhì)粒;腹膜透析4周后腹腔注射PKC-α siRNA組(PKC-α siRNA組)行5/6腎臟切除術(shù)后,腹膜透析4周,并于第3、4周腹腔注射0.1 mg/kg PKC-α siRNA(廣州Ribuo Biotech公司),除NC組外其余組于相同時(shí)間腹腔注射等體積生理鹽水。PKC-α siRNA正義鏈5′-GGC GUC CUG UUG UAU GAA ADA DT-3′,反義鏈3′-DTD ACC GCA GGA CAA CAU ACU UU-5′[13]。
1.3方法
1.3.1構(gòu)建模型 尿毒癥組與PD組均行5/6腎臟切除術(shù)。左腎2/3切除,10%水合氯醛0.3 mL/100 g麻醉后俯臥位固定大鼠,取脊柱旁約0.5 cm與左肋下1 cm交界處為手術(shù)切口,游離左腎并剔除左腎包膜,梯形切除腎臟組織上、下極各1/3,稱(chēng)量腎組織,明膠海綿按壓切口止血后縫合切口。1周后行右腎全切術(shù),術(shù)后均需青霉素抗感染3 d。6周后大鼠摘眼球取血1~2 mL,檢測(cè)血尿素(BUN)和血肌酐(Scr)評(píng)價(jià)其腎功能,確認(rèn)模型是否構(gòu)建成功。將大鼠麻醉后仰臥位固定,于肋下2 cm處植入腹透管經(jīng)皮下隧道于頭頸部背側(cè)兩耳連線中點(diǎn)下處引出腹透管,注入生理鹽水,液體流出通暢視置管成功。青霉素抗感染,每日肝素50 U經(jīng)透析管腹腔注入,1周后經(jīng)腹膜透析管進(jìn)行4.25%雙聯(lián)腹膜透析液透析,每日3 mL/100 g大鼠體質(zhì)量。透析后稱(chēng)重,檢測(cè)Scr評(píng)價(jià)大鼠腎功能,確認(rèn)模型是否構(gòu)建成功。
1.3.2腹膜平衡試驗(yàn)(PET) 大鼠腹膜透析2 d后,進(jìn)行PET,測(cè)定各組大鼠的超濾量和葡萄糖轉(zhuǎn)運(yùn)量,評(píng)價(jià)各組大鼠腹膜運(yùn)轉(zhuǎn)功能。向大鼠腹腔內(nèi)灌注25 mL透析液,于0 h和4 h分別采集1 mL透出液,留取靜脈血。4 h后開(kāi)腹,用紗布吸干腹腔液體后稱(chēng)重。檢測(cè)葡萄糖(Glu)、Scr、BUN水平。
1.3.3免疫組織化學(xué)染色 兔抗鼠PKC-α單克隆抗體 (1∶1 000,ab32376,Abcam)和生物素標(biāo)記的山羊抗兔IgG (1∶1 000,ab6789,Abcam) 二抗進(jìn)行免疫組織化學(xué)制片。每張切片隨機(jī)選取高倍鏡(×200)下5個(gè)視野,每個(gè)視野計(jì)數(shù)100細(xì)胞,計(jì)算陽(yáng)性細(xì)胞百分比。切片中0~10%細(xì)胞質(zhì)染色棕黃色為陰性(—),10%以上為陽(yáng)性(+)[14]。
1.3.4Masson染色 壁層腹膜行經(jīng)典Masson染色,觀察腹膜間皮細(xì)胞形態(tài)學(xué)變化,測(cè)定腹膜厚度。
1.3.5CD34染色 CD34抗體標(biāo)記內(nèi)皮細(xì)胞,對(duì)大網(wǎng)膜進(jìn)行染色并計(jì)數(shù)[15]。血管密度最高區(qū)隨機(jī)觀察5個(gè)高倍視野(×200),每個(gè)視野計(jì)數(shù)血管平均值為微血管密度 (MVD)。單個(gè)內(nèi)皮細(xì)胞或內(nèi)皮細(xì)胞簇不論是否有血管腔均計(jì)數(shù)為1個(gè)血管,分辨不清或染色模糊的細(xì)胞及管腔面積大于 8個(gè)血紅細(xì)胞直徑的血管不計(jì)數(shù)在內(nèi)。

表1 siRNA序列

表2 引物序列
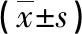
表3 大鼠造模前后體質(zhì)量及腎功能情況
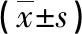
表4 大鼠透析前后體質(zhì)量及腎功能情況
1.3.6real-time RT-PCR檢測(cè) 提取RNA,根據(jù)Genebank中PKC-α核苷酸序列設(shè)計(jì)引物,見(jiàn)表2。引物由Invitrogen公司合成。real-time RT-PCR采用北京全式金公司的反應(yīng)體系,β-actin為內(nèi)參對(duì)照,按照2-△△Ct進(jìn)行半定量分析。
1.3.7Western blot檢測(cè) 提取總蛋白,經(jīng)蛋白樣本處理,每孔上樣40 μg電泳分離蛋白后轉(zhuǎn)膜。PKC-α一抗(1∶1 000,Cell Signal),β-actin一抗(1∶1 000,Cell Signal Technology) 4 ℃孵育過(guò)夜,清洗一抗后二抗室溫孵育,Bio-rad Gel Dol EZ成像儀顯影。目的條帶采用Image J軟件進(jìn)行灰度分析,β-actin設(shè)為內(nèi)參。
2 結(jié) 果
2.1下調(diào)PKC-α基因?qū)EGF基因的影響 siPKCα-1、siPKCα-2、siPKCα-3分別在NRK-52E細(xì)胞中對(duì)PKC-α基因進(jìn)行下調(diào),3組中PKC-α基因與正常對(duì)照組相比明顯降低(P<0.01),VEGF基因也明顯降低(P<0.01),見(jiàn)圖1。
2.2尿毒癥大鼠模型鑒定 正常對(duì)照組與假手術(shù)組大鼠生長(zhǎng)情況良好,飲食正常,活動(dòng)較多,體質(zhì)量穩(wěn)定增加,存活率100%。尿毒癥組大鼠活動(dòng)較少,飲食差,體質(zhì)量減輕,存活率88.9%,術(shù)后死亡大鼠考慮為失血性休克死亡,每組選取8只進(jìn)行后續(xù)實(shí)驗(yàn)。與正常對(duì)照組相比,假手術(shù)組大鼠腎功能無(wú)明顯變化(P>0.05),尿毒癥組大鼠BUN和Scr水平明顯升高(P<0.05),建模成功,見(jiàn)表3。

圖1 細(xì)胞水平檢測(cè)下調(diào)PKC-α對(duì)VEGF的影響

A:正常對(duì)照組;B:假手術(shù)組;C:尿毒癥組;D:PD2組;E:PD4組;F:NC組;G:PKC-α siRNA組
圖2各組大鼠腹膜組織免疫組化染色情況(×200)
2.3尿毒癥腹膜透析大鼠模型鑒定 與正常對(duì)照組相比,假手術(shù)組大鼠體質(zhì)量和腎功能無(wú)明顯變化(P>0.05),尿毒癥組大鼠體質(zhì)量明顯降低(P<0.05),Scr水平明顯升高(P<0.05)。與尿毒癥組相比,PD組大鼠體質(zhì)量明顯升高(P<0.05),Scr水平降低,建模成功,見(jiàn)表4。
2.4各組大鼠腹膜功能情況 與正常對(duì)照組相比,PKC-α siRNA、NC、PD2組和PD4組大鼠超濾量均降低,葡萄糖轉(zhuǎn)運(yùn)量(MTG)均升高(P<0.05)。NC、PD4周組和PD2周組相比,超濾量降低,MTG升高(P<0.05)。與PD4組和NC組相比,PKC-α siRNA組大鼠超濾量明顯升高,MTG明顯降低 (P<0.05),見(jiàn)表5。
2.5各組大鼠PKC-α表達(dá)陽(yáng)性率 在正常腎組織中,PKC-α主要表達(dá)于腎小管上皮細(xì)胞,少量表達(dá)于腎小管系膜細(xì)胞。與正常對(duì)照組相比,假手術(shù)組無(wú)明顯變化(P>0.05),其余5組PKC-α表達(dá)均上升(P<0.05);與尿毒癥組相比,PD2、PD4和NC組大鼠腹膜組織PKC-α表達(dá)均升高,其中PD4、NC組比PD2組變化更明顯(P<0.05)。與PD4和NC組相比,PKC-α siRNA組大鼠腹膜組織PKC-α表達(dá)明顯降低 (P<0.05),見(jiàn)圖2、3。

1:正常對(duì)照組;2:假手術(shù)組;3:尿毒癥組;4:PD2組;5:PD4組;6:NC組;7:PKC-α siRNA組
圖3各組PKC-α表達(dá)情況

A:正常對(duì)照組;B:假手術(shù)組;C:尿毒癥組;D:PD2組;E:PD4組;F:NC組;G:PKC-α siRNA組
圖4各組大鼠腹膜組織Masson染色結(jié)果(×200)

A:正常對(duì)照組;B:假手術(shù)組;C:尿毒癥組;D:PD2組;E:PD4組;F:NC組;G:PKC-α siRNA組
圖5各組大鼠腹膜組織CD34染色情況
2.6各組大鼠腹膜組織形態(tài)學(xué)變化 與正常對(duì)照組相比,假手術(shù)組腹膜組織形態(tài)學(xué)無(wú)明顯變化(P>0.05),其余5組大鼠壁層腹膜可見(jiàn)大量膠原纖維的沉積,致密層、腹膜明顯增厚(P<0.05)。與尿毒癥組相比,PD2、PD4組和NC組腹膜明顯增厚(P<0.05),其中PD4、NC組比PD2組變化更明顯(P<0.05)。與PD4組和NC組相比,PKC-α siRNA組腹膜明顯變薄(P<0.05),見(jiàn)圖4。
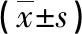
表5 各組大鼠腹膜功能比較

1:正常對(duì)照組;2:假手術(shù)組;3:尿毒癥組;4:PD2組;5:PD4組;6:NC組;7:PKC-α siRNA組
圖6各組大鼠腹膜組織MVD計(jì)數(shù)情況
2.7各組大鼠腹膜組織MVD情況 正常對(duì)照組、假手術(shù)組大鼠腹膜組織上基本無(wú)微血管,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),其余5組壁層腹膜組織MVD明顯增大(P<0.05)。與尿毒癥組相比,PD2組、PD4組和NC組大鼠腹膜組織MVD均明顯增大,其中PD4組、NC組比PD2組變化更明顯(P<0.05)。與PD4組和NC組相比,PKC-α siRNA組腹膜組織MVD明顯減小(P<0.05),見(jiàn)圖5、6。

A:各組大鼠腹膜組織中PKC-α mRNA表達(dá)情況;B:各組大鼠腹膜組織中PKC-α 蛋白表達(dá)情況;C:各組大鼠腹膜組織中PKC-α 蛋白表達(dá)情況;1:正常對(duì)照組;2:假手術(shù)組;3:尿毒癥組;4:PD2組;5:PD4組;6:NC組;7:PKC-α siRNA組
圖7各組大鼠腹膜組織中PKC-αmRNA與蛋白表達(dá)情況
2.8各組大鼠腹膜組織中PKC-α mRNA及蛋白表達(dá)情況 與正常對(duì)照組相比,假手術(shù)組大鼠腹膜組織中PKC-α mRNA及蛋白表達(dá)差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),其余5組大鼠腹膜組織中PKC-α mRNA及蛋白表達(dá)明顯升高(P<0.05)。與尿毒癥組相比,PD2、PD4組和NC組大鼠腹膜組織中PKC-α mRNA及蛋白表達(dá)均升高,其中PD4、NC組變化更明顯(P<0.05)。與PD4組和NC組相比,PKC-α siRNA組大鼠腹膜組織中PKC-α mRNA及蛋白表達(dá)明顯下降 (P<0.05),見(jiàn)圖7。
3 討 論
超濾衰竭使患者的治療效果下降,甚至危及患者生命[16]。GAO等[17]研究指出血管表皮生長(zhǎng)因子、堿性纖維生長(zhǎng)因子等分泌性因子與超濾衰竭的產(chǎn)生密切相關(guān),為腹膜血管新生依據(jù)。本實(shí)驗(yàn)旨在分析尿毒癥大鼠模型中PKC-α的表達(dá)與超濾衰竭發(fā)生之間的聯(lián)系。研究證實(shí),BUN、Scr可作為評(píng)價(jià)尿毒癥大鼠模型腹膜透析功能的指標(biāo)[18]。有報(bào)道顯示,二者在腎臟疾病中扮演了重要的角色,并且與患者的生存預(yù)后及疾病的進(jìn)展存在相關(guān)性[19-20]。
本實(shí)驗(yàn)結(jié)果顯示尿毒癥腹膜透析大鼠的超濾量降低,并伴隨著MTG升高。MTG升高會(huì)使跨腹膜滲透壓梯度難以維持,從而影響水通道中蛋白含量,最終導(dǎo)致腹膜超濾功能衰竭[21]。筆者發(fā)現(xiàn)尿毒癥大鼠腹膜透析4周相比腹膜透析2周的超濾量下降更為明顯,提示在長(zhǎng)期腹膜透析過(guò)程中超濾衰竭會(huì)加重,這與LOPES等[22]學(xué)者的觀點(diǎn)一致,然而降低PKC-α表達(dá)可以明顯緩解腹膜超濾衰竭情況。血管新生中發(fā)揮重要作用的VEGF,參與葡萄糖吸收,從而導(dǎo)致血管超濾量下降[23-24]。在細(xì)胞中下調(diào)PKC-α?xí)r,VEGF基因的表達(dá)量也下降。另外,除正常對(duì)照組和假手術(shù)組外,其余5組大鼠壁層腹膜可見(jiàn)大量膠原纖維沉積,腹膜明顯增厚。腹膜纖維化也會(huì)造成新生血管生成,溶質(zhì)轉(zhuǎn)移逐漸增加,甚至出現(xiàn)超濾衰竭[25]。
有研究表明,高糖腹膜透析液及尿毒癥環(huán)境是誘發(fā)VEGF表達(dá)增加的關(guān)鍵因素,可致血管新生最終導(dǎo)致腹膜超濾衰竭[12]。WANG等[5]研究證實(shí)腹膜透析的大鼠腹膜組織中,超濾量與VEGF表達(dá)呈負(fù)相關(guān),VEGF表達(dá)量與MTG及MVD呈正相關(guān),VEGF表達(dá)上升可誘發(fā)血管新生。研究發(fā)現(xiàn),PKC-α基因在腹膜透析液所致腹膜膜功能障礙的病理生理過(guò)程中起著至關(guān)重要的作用,PKC-α表達(dá)增強(qiáng)可進(jìn)一步導(dǎo)致腹膜膜纖維化、新生血管生成,同時(shí)降低超濾量[6]。
CHANG等[26]研究發(fā)現(xiàn)親水性α-生育酚衍生物,2,2,5,7,8-五甲基-6-羥基色曼 (PMC)可抑制PKC-α易位,阻斷血管平滑肌細(xì)胞(VSMCs)的G2/M期進(jìn)展,抑制增殖。和本文研究結(jié)果一致,抑制PKC-α表達(dá)可進(jìn)一步抑制腹膜血管新生,從而改善腹膜功能,最終達(dá)到緩解超濾衰竭的目的。
綜上所述,本研究發(fā)現(xiàn)PKC-α在尿毒癥腹膜透析大鼠模型中高表達(dá),通過(guò)siRNA下調(diào)能延緩大鼠超濾衰竭進(jìn)程。分子機(jī)制有可能是通過(guò)下調(diào)VEGF基因的表達(dá)量,延緩超濾衰竭進(jìn)程。通過(guò)改善透析液生物相容性、藥物治療或基因轉(zhuǎn)染,以期減少細(xì)胞因子對(duì)治療的影響,這將為超濾衰竭的臨床預(yù)防和治療提供理論基礎(chǔ)。

