不同吻合技術應用于低位直腸癌手術的療效及安全性
丁博文 權紅光 王 雋
直腸癌是一種常見惡性腫瘤,目前其發生率及死亡率均不斷上升[1]。在我國,直腸癌的發病率逐年升高,其中中下段直腸癌發生占直腸癌的85%,稱為低位直腸癌[2]。手術治療是低位直腸癌的主要方法[3]。傳統手術方法為Miles手術[4],隨著手術技巧的不斷完善及手術器械的不斷改進,DST雙吻合技術及支撐吻合技術已逐漸應用于低位直腸癌中[5],但目前2種技術應用于低位結腸癌手術的研究較少。因此,本文回顧性分析了2種吻合方式應用于低位結腸癌手術的療效及安全性,現報告如下。
1 資料與方法
1.1 一般資料
選擇我院2011年1月至2015年12月收治的79例低位結腸癌患者,所有患者均要求行保肛手術,其中男性49例,女性30例,年齡范圍為45~72歲,平均年齡為(59.2±5.8)歲;病程范圍為1~7年,平均病程為(4.2±1.0)年;體重范圍為47.8~87.3 kg,平均體重為(64.3±5.9)kg;術前病理分型:乳頭狀腺癌共16例,管狀腺癌51例,黏液腺癌6例,印戒細胞癌6例。根據隨機數字表法,將所有患者分為觀察組及對照組,2組患者的性別、年齡、病程、體重、病理分型等資料對比,差異無統計學意義(P>0.05),見表1。本研究所有患者知情同意,且經醫院倫理委員會批準同意。

表1 2組患者的一般資料對比
1.2 方法
觀察組患者給予支撐吻合技術,先將腫瘤及直腸肛管進行游離,在距離腫瘤下緣2~4 cm處用直角鉗,并采用2%碘伏棉球經肛管進行消毒、沖洗,之后在直角鉗的下緣將近側腸管切斷,在游離拖下近側的結腸內8 cm處,置入支撐吻合管,采用雙7號線結扎1次,再用單7號線進行縫扎固定。待充分擴肛后,在骶前置入2根引流管。在遠側肛管及直腸殘端0.5~1.0 cm處,采用7號線連續荷包縫合1周,再經肛將近側結腸及支撐吻合管經盆腔肛管拖出,之后將荷包線收緊、打結;外固定支撐吻合管,術后10 d左右,將外固定線拆除,肛門支撐吻合管脫落。術后14 d,對吻合口情況進行檢查。
對照組患者采用DST雙吻合技術,線將乙結腸游離至盆底并超越尾尖,在腫瘤下2~4 cm處,用腸道弧形切割閉合器將直腸閉合,在近側切斷直腸,將腫瘤段的直乙結腸進行切除,在近端結腸給予荷包縫合,置入腸道管狀吻合器。待充分擴肛后,經患者肛門置入一管狀吻合器,使其頭端將直腸閉合段頂住,將吻合器桿身尾端螺栓逆時針旋轉,使錐形導頭從直腸盲段的釘合部中央的后方刺出后套入抵釘座內,將吻合器桿身尾端螺栓進行順時針旋轉,將直腸斷端與結腸進行靠攏,當桿身紅色標記進入綠色區時,表明完成對合。之后打開保險,握緊手柄,用力進行擊發,聽到咔嚓聲時,表明結腸直腸吻合完成;之后將吻合器退出,經肛門注氣,對吻合口的嚴密性進行檢查,若漏氣則立即加強縫合。
2組術后均給予靜脈抗感染、禁飲禁食,止血、營養支持等治療,術后14 d觀察患者的吻合口情況。
1.3 觀察指標
(1)根據《結腸癌診療規范》中的相關標準[6],對比2組患者的治療效果,經治療后患者臨床癥狀、傷口愈合及腫塊消失為顯效;治療后患者臨床癥狀及體征均改善為好轉;治療后患者臨床癥狀或體征無改善甚至加重為無效;(2)對比2組患者的腫瘤情況(腫瘤下緣跟底部距肛緣的長度、腫瘤下界距斷端的最短距離)、住院時間及住院費用;(3)對比2組患者治療期間的不良反應及術后3年的局部復發率。
1.4 統計學方法
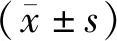
2 結果
2.1 2組患者的治療效果對比
觀察組的總有效率為97.4%,對照組為70.0%,觀察組總有效率明顯高于對照組(χ2=10.872,P=0.001),見表2。

表2 2組患者的治療效果對比/例
2.2 對比2組患者的腫瘤情況、住院時間及住院費用
2組的腫瘤下緣跟底部距肛緣的長度及住院時間對比,差異無統計學意義;觀察組的腫瘤下界距斷端的最短距離明顯長于對照組,住院費用明顯少于對照組,見表3。
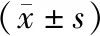
表3 對比2組患者的腫瘤情況、住院時間及住院費用
2.3 2組患者術后3年的局部復發率及治療期間并發癥對比
觀察組的并發癥發生率為0.0%,對照組預防性造瘺3例、吻合口瘺3例,并發癥總發生率為15.0%(6/40),觀察組明顯低于對照組(χ2=6.331,P=0.026)。觀察組術后3年無局部復發,復發率明顯低于對照組的12.5%(5/40),差異有統計學意義(χ2=0.023,P=0.048)。
3 討論
低位直腸癌是一種常見的惡性腫瘤,多是因不良的生活習慣造成的[7-8]。直腸癌發生率位于癌癥的第2位,且在直腸癌中,約有60%患者為低位結腸癌[9]。目前,有越來越多的患者存在低位結腸癌[10]。目前,隨著結腸癌治療技術的不斷進步及人們對生活質量要求的提高,低位結腸癌手術已逐漸改為在徹底切除腫瘤的前提下,盡量將肛門的排便、控制功能進行保留[11]。在低位結腸癌的治療中,即可使用DST雙吻合技術,又可使用支撐吻合技術,目前,二者在低位結腸癌的治療中研究較少,因此本文分析了二者用于低位直腸癌患者的療效及安全性。
本文結果表明,觀察組的總有效率明顯高于對照組,表明支撐吻合技術用于低位結腸癌的療效優于DST雙吻合技術,主要是由于支撐吻合技術可對DST技術殘端進行有效補救,當吻合器不能將遠端腸管閉合時,可改為經肛行荷包縫合遠端腸管殘端,在吻合過程中充分利用支撐管[12];觀察組的腫瘤下界距斷端的最短距離明顯長于對照組,主要是由于應用支撐吻合技術時,可在直視下縫合肛門。此外,支撐吻合技術的縫合線距離腸管斷端為0.2~0.3 cm,對遠端腸管的游離長度較DST吻合器短,其腫瘤下界距斷端的最短距離較對照組長。觀察組的住院費用明顯少于對照組,主要是由于支撐吻合技術的材料成本低于10元,價格低廉,材料費用較DST雙吻合器低1萬元,從而降低了住院的費用[13]。觀察組的并發癥發生率明顯低于對照組,主要是由于支撐吻合法可擴張、擠壓吻合口周圍組織,減少盆腔空腔,有利于肉芽的填充。此外,支撐腸管的內鏡為3 cm時,有利于腸內容物的充分引流,從而避免了由于引流不暢導致的吻合口漏[14];同時支撐吻合技術在出現吻合口漏時,有利于引流及吻合口漏的愈合;而對遠端直腸進行處理時,DST吻合器需消耗0.7 cm的遠端腸管,且在患者存在肌肉強度大、肥胖、殘端距離齒狀線低于1 cm或盆腔太窄時,需反復性吻合操作,其會加重局部損傷,從而增加了吻合口漏的發生率,同時對于嚴重的腫瘤梗阻,不能對患者行清潔灌腸時,會有糞便在近端的腸腔殘存,而使用支撐吻合技術時,在保肛的基礎上,可以降低預防性造口瘺的發生[15]。觀察組術后3年局部復發率明顯低于對照組,主要是由于支撐吻合技術的手術適應范圍較大,可徹底切除腫瘤,從而降低低位結腸癌術后3年的腫瘤復發情況。
綜上所述,與DST雙吻合技術相比,支撐吻合技術可提高低位直腸癌手術的療效,降低患者并發癥的發生率及術后3年腫瘤的局部復發率。本研究病例資料較少,有待進一步擴大樣本量,進行下一步研究。

