香葉木素通過抑制破骨細胞分化治療早期骨關節炎的可行性研究
丁洪志,穆 培,許志興,丁 歡,陸雄偉
0 引言
骨關節炎(Osteoarthritis,OA)是當今骨科最常見的慢性疾病之一,隨著預期壽命的增加,骨關節炎的患病率和發病率均上升,最終導致患者的關節功能下降,生活質量下降,并帶來醫療成本及社會成本的浪費。該病的發病機制較為復雜,目前相關研究顯示,其病理改變涉及關節軟骨、軟骨下骨、滑膜組織以及關節周圍肌腱韌帶等,其中以關節軟骨、軟骨下骨最受關注[1-2]。影響OA發展的危險因素包括衰老、環境因素、關節發育不良和損傷、先天遺傳改變等[3]。
OA治療指南包括非藥物治療、藥物治療和手術方法[4]。對于早期OA,推薦的治療方法是非藥物治療,如減肥、有氧運動、物理治療等[5]。OA藥物包括非甾體抗炎藥(NSAIDs)、曲馬多、對乙酰氨基酚和阿片類藥物,可以緩解癥狀,但由于其預防疾病進展能力的報道有限,因此可能無法減少手術需求[6]。此外,目前還沒有批準用于治療OA的有效藥物。
近10年研究顯示,軟骨下骨在OA中起著重要作用[7-11]。因此,破骨細胞作為骨吸收的主要細胞,最近成為治療溶骨性疾病的新靶點[9,11-12]。
香葉木素(Diosmetin)是天然黃酮類化合物的一種,存在于菊花、留蘭香、蜘蛛香等天然藥物和檸檬、柑橘、花生等果實中,具有多重生物活性,如抗炎抑菌、抗氧化、抗腫瘤等,可以用來治療肝、肺、腎、眼、神經系統疾病。近期相關報道已經證實其具有抑制破骨細胞分化功能[12],然而,其在骨關節炎治療方面的研究尚未見報道。
筆者首先在人體及小鼠體內驗證骨關節炎軟骨下骨改變與破骨細胞的相關性,然后通過細胞實驗,驗證香葉木素對于破骨細胞生成的抑制作用,進而提出合理推測,即香葉木素可以通過抑制軟骨下骨中的破骨細胞活化,治療早期骨關節炎,延緩骨關節炎發展。
1 材料與方法
1.1 材料與試劑 香葉木素(美國Selleck Chemicals中國分公司,純度≥98%);α-MEM培養基、胰蛋白酶及胎牛血清均購自美國Sigma-Aldrich公司;CCK-8試劑盒購自日本Dojindo Laboratories公司;巨噬細胞集落刺激因子(MSCF)與受體激活核因子(NF)κB配體(RANKL)均購自美國R & D Systems公司;逆轉錄及PCR試劑盒均購自TaKaRa中國分公司;所有引物均購自生工生物工程(上海)股份有限公司。
1.2 儀器 Infinite M200型多功能酶標儀(瑞士Tecan公司);1300 SERIES A2型超凈臺(美國Thermo公司);STERI-CYCLE型細胞培養箱(美國Thermo公司);7500 Real Time PCR System(美國應用生物系統公司)。
1.3 細胞培養 通過骨髓沖洗從4周齡雄性C57BL/6小鼠中提取骨髓來源的單核巨噬細胞(BMM),并在添加有10%FBS、1%青霉素/鏈霉素和30 ng/ml M-CSF的α-MEM培養基(稱為完全α-MEM培養基)中培養5~7 d,待細胞長滿至90%左右時用PBS清洗后加入胰酶消化,顯微鏡下觀察,待細胞變圓后加入培養基終止消化,重懸后計數板計數細胞濃度。
1.4 細胞增殖檢測 重懸液計數后以1×104個/孔接種于96孔板中,待24 h后細胞貼壁,更換含有不同濃度的香葉木素的完全α-MEM培養液,分別于1、3、5 d后吸去舊培養基,加入含有10% CCK-8試劑的培養基,孵育2 h后用酶標儀檢測450 nm波長下OD值,實驗重復3次。
1.5 人體及動物組織獲取 從上海市第九人民醫院(北部)骨科收集骨關節炎晚期行全膝關節置換患者的脛骨平臺標本,共分析人體標本6個;從上海市第九人民醫院動物房購買8周齡C57BL/6雄性小鼠共20只,分為ACLT(前交叉韌帶切除)手術組(12只)與假手術組(8只),術后1、2個月安樂死后取膝關節標本。組織標本多聚甲醛固定48 h后流水過夜,更換酒精保存,外送技術公司行組織病理切片及染色。顯微鏡下拍照,Image J軟件計數,統計計數結果。
1.6 細胞TRAP染色檢測分化情況 重懸液計數后以1×104個/孔接種于96孔板中,待24 h后細胞貼壁,吸去舊培養基,更換為含有100 ng/ml的RANKL及不同濃度的香葉木素的完全α-MEM培養液,隔日換液1次,培養至7~9 d,待BMMs融合后,PBS清洗2~3次,4%多聚甲醛固定20~30 min后使用TRAP染色試劑盒染色。顯微鏡下拍照,Image J軟件計數,統計計數結果。
1.7 RT-PCR檢測破骨細胞生成相關基因表達情況 重懸液計數后以30×104個/孔接種于6孔板中,待24 h后細胞貼壁,吸去舊培養基,更換為含有100 ng/ml的RANKL及不同濃度的香葉木素的完全α-MEM培養液,隔日換液1次,培養至破骨細胞生成后2 d。Trizol法提取RNA,離心收集各組BMMs細胞,用反轉錄試劑盒將RNA反轉成cDNA。根據NCBI上提交TRAP、CTSK的cDNA序列設計引物。TRAP:上游引物F:5′-CCTCTTCCCAACTCGTGCAG-3′,下游引物R:5′-TGAATCCATCTTGGCGGTGG-3′;CTSK:上游引物F:5′-GCGGGATCGTTATGCCTACA-3′,下游引物R:5′-GACGGCTCTTTCTGCTGCTA-3′;GAPDH:上游引物F:5′-GGAGAGTGTTTCCTCGTCCC-3′,下游引物R:5′-ACTGTGCCGTTGAATTTGCC-3′,進行qRT-PCR,以GAPDH為內參。PCR的反應體系:SYBR 5 μl,上游引物F 0.2 μl,下游引物R 0.2 μl,ROXⅡ0.2 μl,cDNA 1.1 μl,ddH2O 3.3 μl;PCR的反應條件:預變性95 ℃ 5 min,變性95 ℃ 30 s,延伸60 ℃ 40 s (TRAP、CTSK、GAPDH),40個循環,延伸時讀取光密度(D)值。采用最大二階導數法(2-△△Ct)對數據進行統計。△△Ct=(實驗組目的基因Ct平均值-實驗組內參基因Ct平均值)-(對照組目的基因Ct平均值-對照組內參基因Ct平均值)。
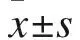
2 結果
2.1 骨關節炎患者患側與健側脛骨平臺軟骨下骨的破骨細胞數量存在差異 骨關節炎患者的膝關節組織染色(HE染色,翻紅O-固綠染色)結果顯示,兩側軟骨的病變程度明顯不同(圖1、圖2)。同時,兩側的軟骨下骨的破骨細胞數量明顯不同,如圖1、圖2所示,TRAP染色陽性的破骨細胞計數結果顯示,患側軟骨下骨的破骨細胞數量少于健側(P<0.05)。
2.2 小鼠骨關節炎模型中手術組軟骨下骨中的破骨細胞數量明顯增多,呈現骨質疏松表現 分別對ACLT術后1、2個月的小鼠膝關節組織進行TRAP染色,如圖3所示。術后小鼠膝關節TRAP染色陽性破骨細胞計數結果如圖3所示,術后1個月手術組軟骨下骨破骨細胞數量明顯多于假手術組(P<0.05),這一差異在2個月后消失。另外,我們對小鼠膝關節軟骨下骨的顯微結構進行了micro CT掃描,分析了骨顯微結構相關數據,結果如圖4、圖5所示,術后小鼠膝關節明顯呈現骨質疏松表現,相對骨體積(%)、骨小梁數量(/mm)、骨密度(g/cc)、連接密度(1/mm3)明顯減少(P<0.05),骨小梁連接數(1/mm)明顯增加(P<0.05)。
2.3 香葉木素的細胞毒性檢測 通過CCK-8試劑盒檢測香葉木素的細胞毒性,如圖6所示。加入不同濃度香葉木素后,第1、3、5天分別檢測OD值以反映細胞活性,結果顯示,與對照組相比,20、40 μmol/L香葉木素組顯示出明顯的細胞毒性,其OD值在加入香葉木素后第1、3、5天明顯降低(P<0.05),而在第5天時,1.25 μmol/L香葉木素組細胞活性高于對照組(P<0.05)。

圖1 人膝關節組織HE、TRAP、翻紅O-固綠染色結果

圖2 人膝關節組織OARSI評分、破骨細胞計數統計結果

圖3 手術組與假手術組術后1、2個月膝關節組織TRAP染色結果及破骨細胞計數比較
2.4 香葉木素對破骨細胞形成的影響 如圖7、圖8所示,與正常對照組相比,濃度為5 μmol/L及以上的香葉木素處理組TRAP染色陽性的破骨細胞數量明顯減少,差異有統計學意義(P<0.05)。同時,與對照組比較,加入2.5 μmol/L及以上的香葉木素后,破骨細胞形成相關基因TRAP、CTSK表達水平明顯下降,差異有統計學意義(P<0.05)。見圖9。

圖4 小鼠術后1個月膝關節顯微CT掃描結果

圖5 小鼠術后2個月膝關節顯微CT掃描結果

圖6 香葉木素刺激1、3、5 d后不同藥物濃度組OD值檢測結果
3 討論
目前,OA的藥物治療可以減輕癥狀,但無法減少手術的需要[6]。大部分關節軟骨和關節軟骨下骨逐漸退化,在OA的發展過程中可能存在一些潛在的相互作用[13-14]。因此,通過抑制破骨細胞生成,有望減少軟骨下骨的丟失,減少關節軟骨的病變,發揮治療骨關節炎的作用。香葉木素是天然黃酮類化合物的一種,在自然界中分布廣泛,目前相關研究證實其具有抗炎抑菌、抗氧化、抗癌作用[15]。香葉木素是香葉木素苷即地奧思明(Diosmin)在人體內腸道菌群降解作用下去除糖苷鍵后的代謝產物之一,可被人體吸收并降解[16]。地奧思明作為黃酮類靜脈活性藥物,通過增加靜脈張力,促進淋巴液回流,促進微循環,對痔瘡以及靜脈功能不全發揮治療作用[17]。
研究表明,軟骨下骨的變化也在OA的發病機制中起重要作用[18-19]。通常認為軟骨下骨硬化與OA中的軟骨退化密切相關[20-21]。然而,除了這種肥大性OA之外,還提出了另一種OA表型,即骨質疏松性OA,其特征在于軟骨下骨密度顯著降低和重塑增加[22-23]。據報道,軟骨下骨重建和骨形態變化水平顯著升高與骨質疏松癥患者[24]和動物模型中卵巢切除術引起的骨質疏松癥更嚴重的軟骨退變有關[25-26]。軟骨下骨的改變主要由破骨細胞及骨細胞的平衡決定,破骨細胞數量相對增多或者活化會導致軟骨下骨的骨丟失,呈現骨質疏松表現。

圖7 不同藥物濃度組經MCSF 30 ng/ml+RANKL 100 ng/ml誘導7 d后破骨細胞TRAP染色結果

圖8 不同藥物濃度組經MCSF 30 ng/ml+RANKL 100 ng/ml誘導7 d后破骨細胞計數結果
注:與對照組比較,*P<0.05,**P<0.01

圖9 不同藥物濃度組經MCSF 30 ng/ml+RANKL 100 ng/ml誘導9 d后TRAP、CTSK基因表達水平結果
注:與對照組比較,*P<0.05,**P<0.01
首先,OA患者人體標本以及小鼠OA模型標本的組織染色中,顯微CT掃描結果表明了破骨細胞與軟骨下骨病變嚴重程度的相關性。在小鼠OA早期(術后1個月)的軟骨下骨結構呈現骨質疏松表現(見圖2),盡管在術后2個月的小鼠軟骨下骨CT分析中仍呈現骨質疏松表現,但是破骨細胞數量已經較假手術組沒有明顯差異。人體標本中證實,在OA晚期,軟骨病變嚴重側的軟骨下骨破骨細胞數量明顯少于健側(圖1A、圖1B);因此,我們推測OA早期的軟骨下骨丟失與破骨細胞數量增多相關,而晚期的軟骨下骨破骨細胞數量降低,并最終導致軟骨下骨向早期骨關節炎相反的方向發展。因人體膝關節生理結構原因,膝關節內側受力較外側大,因此本研究中人體標本數據顯示內側為患側,外側為健側。
軟骨下骨是保證軟骨完整的必要條件,任何單純為了治療軟骨損傷而忽視軟骨下骨完整性的治療大多以失敗告終[27]。因此,針對軟骨下骨破骨細胞治療OA的新途徑逐漸得到關注。在細胞水平,香葉木素在未產生細胞毒性的濃度對破骨細胞生成具有抑制作用,基因水平檢測也證實了其可以抑制破骨細胞形成相關基因(如TRAP、CTSK)的表達。香葉木素的細胞毒性實驗證實,高濃度香葉木素對BMMs具有一定細胞毒性(圖3A),但是在尚未顯示出細胞毒性的濃度,香葉木素就已經對破骨細胞生成產生抑制作用(圖3A、圖3D)。近期研究證實,香葉木素可以通過抑制MAPK信號通路活化,抑制破骨細胞生成[12]。
總之,本研究表明,破骨細胞的活化與OA早期軟骨下骨改變相關,香葉木素能夠抑制破骨細胞的生成,因此,香葉木素具有減少軟骨下骨丟失的潛能,并有望通過抑制軟骨下骨改變,治療早期OA,延緩OA進程。

