胃癌術后化療患者肝功能異常因素分析
朱聚龍 翟景明 范永剛
胃癌是世界上常見的惡性腫瘤之一,也是病死率較高的腫瘤之一[1]。我國是胃癌的高發地區,且近年來發生率增長較快,這與我國近年來經濟快速發展、環境污染較重及飲食安全問題等密切相關[2]。胃癌術后的輔助化療仍然是目前我國胃癌患者術后的主要治療方法,目前有關指南及專家共識認為胃癌患者根治性切除術后行輔助化療是有益的,可以提高5年生存率[3]。然而化療藥物引起的肝功能異常可導致化療周期的推遲,甚至終止化療,從而影響胃癌術后治療的效果及生活質量,甚者導致胃癌術后化療患者肝臟功能衰竭而危及生命[4]。因此,在臨床工作中,應該盡可能的早期發現、早期糾正胃癌術后化療患者的肝功能異常,使胃癌術后患者的化療能夠規范、順利地進行。
對象與方法
1.研究對象:選擇2015年6月~2018年6月期間在河南科技大學第一附屬醫院住院接受胃癌根治性手術,且Zubrod-ECOG-WHO(ZPS)評分(表1)在0~2級,身體狀況能夠耐受術后化療的胃癌患者。化療前肝功能檢查正常,而且既往未進行過化療或距末次化療的時間>1年。符合上述標準的患者共371例,其中,男性224例,女性147例,患者年齡為28~75歲,平均年齡60.05±9.56歲。根據化療后肝功能檢查情況分為肝功能異常組115例,肝功能正常組256例。

表1 美國東部腫瘤協作組(ECOG)Zubrod-ECOG-WHO評分
2.研究方法:腫瘤分期根據 AJCC 第7版標準。肝功能不良反應分級根據 NCI.CTC 4.0 診斷標準(表2)[5]。根據中華醫學會于2015年發布的《藥物性肝損傷防治指南》,根據上述指南中的診斷流程,記錄胃癌術后患者化療出現肝功能異常的分級及首次出現肝功能異常的時間,對納入肝功能異常組的研究對象,進一步按照國際醫學組織理事會(Council for International Organization of Medical Sciences,CIMOS)肝損傷分型標準,將其劃分為肝細胞損傷型、膽汁淤積型及混合型(表3)[6]。CIMOS對“肝損傷”的定義即ALT或DBIL≥兩倍正常值上限,或ALT、AST及TBIL升高,且其中至少一項≥兩倍正常值上限。以上指標增高不超過正常值上限兩倍的,稱為肝功能異常[7]。
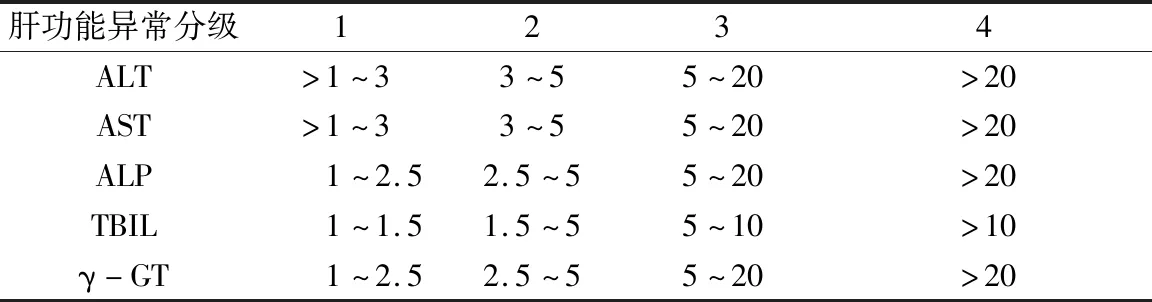
表2 NCI.CTC 4.0肝功能不良分級診斷標準(ULN)
ULN為正常值上限
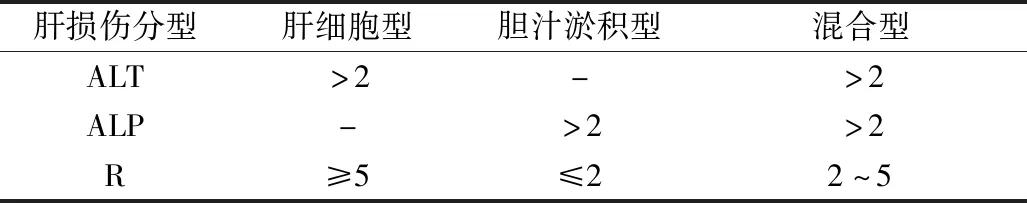
表3 CIMOS肝損傷分型標準 (ULN)
3.統計學方法:應用SPSS 22.0統計學軟件對數據進行分析,將患者的自身因素、肝臟情況、胃癌術后分期、治療因素等可能的影響因素與肝功能異常是否發生進行單因素分析,計數、計量資料比較分別采用χ2及t檢驗,篩選出相關因素后進行多因素Logistic模型回歸分析,以上檢驗均為雙側檢驗,以P<0.05為差異有統計學意義。
結 果
1.胃癌術后化療患者出現肝功能異常情況:371例胃癌術后化療患者中共115例患者出現肝功能異常,發生率為30.99%。其中1級肝功能異常患者98例,發生率為26.42%,2級肝功能異常患者12例,發生率為10.45%,3級肝功能異常患者5例,發生率為1.35%,無4級肝功能異常發生,詳見表4。全部371例胃癌術后化療患者共進行規范化療2210個周期,平均5.96個化療周期,其中358例患者完成6期化療,10例患者完成5期化療,僅3例患者因在第4個化療周期后出現3級以上肝損傷,未繼續化療。其中第1周期發現3例(2.61%),第2周期發現6例(6.09%),第3周期發現13例(11.30%),第4周期發現47例(40.87%),第5周期發現29例(25.22%),第6周期發現17例(14.78%)。上述肝功能異常的胃癌術后化療患者中符合肝損傷診斷的共21例(5.66%),進一步根據CIMOS的肝損傷分型標準,肝細胞損傷型肝損傷患者15例(3.23%),膽汁淤積型肝損傷患者5例(1.35%),混合型肝損傷患者1例(0.27%)。

表4 各項肝功能指標異常所占的比例[n(%)]
2.胃癌術后化療出現肝功能異常的相關因素分析:單因素分析表明長期飲酒、合并乙型病毒性肝炎、化療過程中出現2級以上消化道反應及預防性應用保肝藥物與胃癌術后化療肝功能異常有關(P均<0.05),詳見表5。將上述相關因素進一步進行多因素Logistic模型回歸分析,結果發現長期飲酒、合并乙型病毒性肝炎、化療過程中出現2級以上消化道反應是胃癌術后化療患者出現肝功能異常的危險因素(OR=2.662,5.559,1.841,P均<0.05),預防性應用保肝藥物則是一個保護因素(OR=0.442,P<0.05),詳見表6。

表5 胃癌術后化療肝功能異常的單因素分析[n(%)]
3.胃癌術后患者化療后出現肝功能異常的處理:115例出現肝功能異常的患者中有68例患者未予以保肝藥物治療,在完成當前化療周期后1個月內肝功能指標自行恢復正常,35例患者予以異甘草酸鎂注射液保肝治療,12例患者予以異甘草酸鎂注射液聯合還原性谷胱甘肽保肝治療,經積極保肝治療后,上述患者的肝功能指標均恢復正常,未出現肝衰竭等嚴重不良事件。
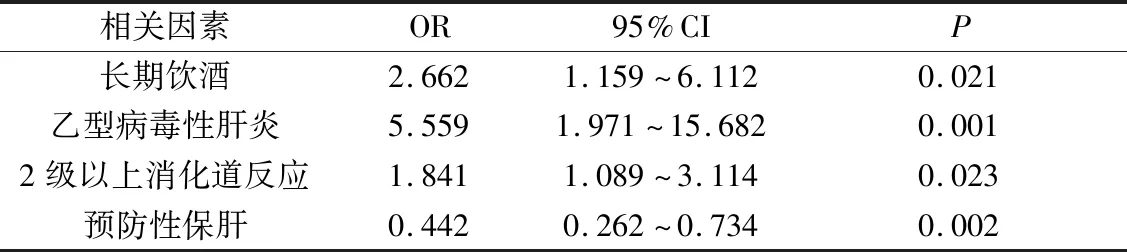
表6 胃癌術后化療肝功能異常的多因素Logistic模型回歸分析
討 論
本研究納入的371例胃癌術后化療患者中共115例出現肝功能異常,發生率30.99%,低于杜娟等[7]及田琦[8]關于胃腸道惡性腫瘤化療肝功能異常發生率(58.00%,55.25%)的研究,可能與目前胃癌術后輔助化療中預防性應用保肝藥物的比例較高有關,這與陳喆等[9]有關結直腸癌化療性肝功能異常的研究中的發生率相符(29.30%)。在前4個化療周期中,肝功能異常的發生率呈逐漸增高趨勢,這符合化療藥物對肝臟細胞毒性的累積作用,但是后兩個化療周期肝功能異常的發生率卻呈現出下降趨勢,考慮與部分患者出現化療不良反應后調整化療藥物劑量及改變化療方案有關。
本研究相關因素分析顯示長期飲酒、合并乙型病毒性肝炎、化療過程中出現2級以上消化道反應是胃癌術后化療出現肝功能異常的獨立危險因素。長期攝入酒精可以引起體內蛋白質及脂類代謝紊亂,直接損傷肝臟細胞,引起酒精性肝病,甚至導致酒精性肝硬化,長期飲酒的胃癌術后化療患者更容易出現肝功能異常可能與此有關。隨著改革開放以來我國經濟的快速發展,飲酒人群呈增多趨勢,導致我國目前的酒精性肝病發生率呈現出一定的上升趨勢[10]。在臨床工作中對長期飲酒的胃癌術后化療患者應當引起重視,適當調整化療方案或減少化療藥物劑量,預防性使用保肝藥物治療,避免出現嚴重的化療性肝功能異常。
本研究發現合并乙型病毒性肝炎的胃癌術后化療患者,化療后肝功能異常的發生率明顯高于沒有合并乙型病毒性肝炎的患者,這與Yeo等[11]的研究中乙型肝炎病毒陽性的惡性腫瘤患者,化療后肝功能異常的發生率明顯高于非乙型肝炎病毒攜帶者的觀點一致。相關研究也已經證實了乙型病毒性肝炎合并乳腺癌、淋巴瘤、直腸癌、肺癌等化療后肝損傷與乙型肝炎病毒再激活相關性有關,逐步明確了乙型肝炎病毒再激活是乙型病毒性肝炎患者化療后肝損傷的直接機制之一[12~14]。因此,臨床工作中對于合并乙型病毒性肝炎的胃癌術后化療患者,可在化療前后適當的給予抗病毒治療,以減少化療性肝功能異常的發生[15]。
本研究還發現化療過程中出現2級以上消化道反應也與胃癌術后化療患者出現肝功能異常有關,考慮與嚴重的惡心、嘔吐、腹瀉等導致的消化道功能紊亂,影響膽汁正常的分泌、排泄,造成膽汁在肝內的淤積從而引起肝功能異常有關。而胃癌術后化療患者由于消化道重建,化療過程中更加可能引起消化道不良反應[16],目前化療過程中預防性的使用止吐藥物等可以適當緩解消化道不良反應。嚴重的消化道反應也是惡性腫瘤術后患者不能完成術后化療治療的不良反應之一,在臨床工作中,針對化療過程中出現2級以上消化道反應的胃癌術后化療患者應該更加引起重視,積極的預防性應用止吐、護胃藥物緩解消化道反應,及時調整化療方案及化療藥物劑量,以避免發生嚴重的肝功能異常。既往有文獻報道肝轉移也是化療相關肝功能異常的高危因素,納入本研究的合并肝轉移的胃癌術后化療患者只有21例,僅占371例患者的5.67%,21例合并肝轉移的患者中肝功能異常發生率為47.62%,本研究中相關因素分析顯示肝轉移不是胃癌術后化療性肝功能異常的相關因素,可能是由于納入的樣本量不足所致,仍應該在臨床工作中引起重視[5]。本研究發現年齡不是胃癌術后化療患者發生肝功能異常的的危險因素,但是目前在臨床工作中,對于年齡較大的胃癌術后化療患者,一般是適當的減少化療藥物劑量,避免出現嚴重的化療相關不良反應。
本研究發現預防性使用保肝藥物是胃癌術后化療性肝功能異常的保護因素,目前已經有大量研究證明了預防性使用保肝藥物可以有效減少化療性肝損傷的發生,而且我國于2014年發布的《腫瘤藥物相關性肝損傷防治專家共識》也建議合理使用保肝藥物,然而因為部分保肝藥物也可能存在一定的肝臟毒性,一般不主張同時聯合應用3種以上的保肝藥物[17~20]。目前在臨床工作中,胃癌術后患者進行化療的同時,一般都會預防性的使用保肝藥物,有效的減少了化療性肝功能異常的發生,但是不可避免的存在保肝藥物濫用現象,應該針對性的對容易出現化療性肝功能異常的胃癌術后患者預防性使用保肝藥物,以減少保肝藥物濫用,減輕胃癌術后化療患者的經濟負擔。
綜上所述,本研究顯示胃癌術后化療患者發生肝功能異常與長期飲酒、合并乙型病毒性肝炎及2級以上消化道反應、預防性使用保肝藥物因素有關。長期飲酒、合并乙型病毒性肝炎及2級以上消化道反應是胃癌術后化療患者出現肝功能異常的危險因素,預防性使用保肝藥物是保護因素,建議在臨床工作中針對合并上述危險因素的胃癌術后化療患者予以預防性保肝治療,以減少化療性肝功能異常的發生,保證胃癌術后化療患者能夠順利、安全的完成化療治療周期,獲得更長的生存時間及更好的生活質量。

