HPLC同時測定透明質酸發酵液中兩種單糖含量的研究
穆淑娥,陳玉娟,黃思玲,欒貽宏,郭學平
(華熙生物科技股份有限公司,山東 濟南 250101)
透明質酸(hyaluronic acid,HA),又名玻璃酸,玻尿酸,是一種酸性黏多糖,廣泛存在于脊椎動物組織細胞間質中。HA由β-D-葡糖醛酸和β-D-N-乙酰氨基葡糖組成的雙糖單位反復交替連接而成,分子量可達到4×106Da,通常應用其鈉鹽形式,即透明質酸鈉[1]。HA是在1934年由美國科學家Meyer等從牛眼玻璃體中首次分離得到,因其具有良好的潤滑性、保濕性和黏彈性,并具有極佳的生物相容性,現廣泛應用于化妝品、食品和醫藥行業中。
目前HA的工業生產主要有兩種方法:動物組織提取法和微生物發酵法[2]。其中微生物發酵法生產HA與傳統的動物組織提取相比具有明顯的優勢,如成本低、原料不受限適合規模化生產、產品易于純化、質量可控等[3-4],因此發酵法生產HA逐步取代了組織提取法。在發酵法生產HA過程中,做為底物的葡萄糖在UDP-葡糖脫氫酶和UDP-葡糖焦磷酸化酶的作用下轉化為葡糖醛酸(GA)及乙酰氨基葡糖(NAG),兩種單糖在透明質酸合成酶的作用下合成HA[5-6],檢測發酵液中兩種未轉化為HA的單糖前體含量的變化,可更直觀地了解發酵過程,輔助判斷發酵終點。本文建立了一種高效液相色譜法(HPLC)檢測HA發酵液中兩種單糖前體的含量,專屬性強,精密度良好,且操作簡便,是一種易于推廣的透明質酸鈉發酵液中單糖前體含量測定方法。
1 儀器與試藥
1.1 儀器
梅特勒-托利多AL104型分析天平(0.1 mg),Agilent 1260高效液相色譜儀(紫外檢測器)。
1.2 試藥
無水乙醇(色譜純),磷酸二氫鈉(分析純),去離子水。葡糖醛酸標準品(中國食品藥品檢驗研究院),N-乙酰氨基葡糖標準品(阿拉丁),透明質酸鈉發酵液(華熙生物科技股份有限公司)。
2 方法與結果
2.1 色譜條件
色譜柱:Venusil HILIC(4.6 mm×250 mm,5 μm);流動相:4 mmol/L磷酸二氫鈉溶液;流速:0.8 ml/min;柱溫:35 ℃;進樣量:20 μl。
2.2 溶液制備
2.2.1 流動相 4 mmol/L磷酸二氫鈉溶液:稱取0.62 g二水合磷酸二氫鈉置于1000 ml量瓶,加水溶解并定容至刻度,使用前經0.45 μm濾膜過濾,超聲脫氣15 min。
2.2.2 標準儲備液 標準儲備液A:精密稱取葡糖醛酸標準品50 mg至5 ml量瓶,用水溶解并定容至刻度,混合均勻;標準儲備液B:精密稱取乙酰氨基葡糖標準品50 mg至5 ml量瓶,用水溶解并定容至刻度,混合均勻。
2.2.3 標準溶液 精密量取標準儲備液A和標準儲備液B各0.2 ml至10 ml量瓶中,流動相定容至刻度,混勻,進樣前經0.45 μm濾膜過濾。
2.2.4 系列標準工作液 精密量取標準儲備液A及標準儲備液B各0.05,0.1,0.2,0.4,0.5 ml至10 ml量瓶,流動相定容至刻度,混勻,進樣前經0.45 μm濾膜過濾。
2.2.5 供試溶液 精密量取HA發酵液0.5 ml置于10 ml量瓶,加入1.5 ml純水稀釋后用無水乙醇定容至刻度,搖勻,使HA及發酵液中的其他多糖及蛋白等大分子物質充分沉淀,進樣前經0.45 μm濾膜過濾。
2.3 定量方法
分別取標準溶液和供試溶液各20 μl注入液相色譜儀,記錄色譜圖,以外標法[7]計算供試品中兩種單糖殘含量(mg/ml)。
2.4 方法專屬性研究
專屬性測試色譜圖見圖1。如圖所示,流動相溶劑峰出現在5.9 min,而標準溶液中的GA和NAG色譜峰分別出現于5.0 min和4.0 min。溶劑峰對兩種單糖未造成干擾,且兩個單糖之間的分離度5.8。滿足方法學要求(分離度>2.0)。
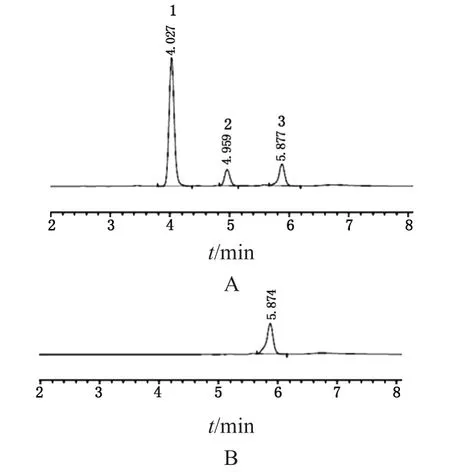
圖1 專屬性驗證色譜圖
2.5 線性和范圍
按照2.2.4所述方法制備兩種單糖的系列標準工作液,以峰面積為橫坐標x,單糖的加入量(mg)為縱坐標y,進行線性回歸得到標準回歸方程。結果表明,乙酰氨基葡萄糖加入量與峰面積關系的線性回歸方程為y=771.73x+0.4531,相關系數r2=1;葡萄糖醛酸線性方程為y=94.338x-0.2002,相關系數r2=1。兩種單糖在0.05 ~ 0.5 mg/ml濃度范圍內線性關系良好。
2.6 檢出限(LOD)
當信噪比為3時,該方法對HA發酵液中NAG的最低檢出濃度為2 μg/ml,對GA的最低檢出濃度為20 μg/ml。
2.7 精密度測試
按照2.2.5中所述方法平行制備6份供試品溶液(同一個取樣點的HA發酵液),按照既定方法檢測單糖含量。結果表明,兩種單糖的6個檢測結果相對標準偏差分別為1.2 %和1.8 %,表明本方法精密度良好。
2.8 準確度測試
取發酵培養基做為空白供試品(即不含GA及NAG)按照2.2.5中所述方法平行制備9份供試品溶液,設計高中低3個濃度準確加入2.2.2中所述兩種單糖的標準儲備液A/B,每種濃度平行制備3份,按照既定方法檢測單糖含量,根據標準品加入量計算方法回收率。結果表明,該方法對GA和NAG的回收率分別為97.1 %和99.8 %,9個樣品的回收率RSD為1.6 %,表明該方法具有良好的準確度。結果見表1。
3 討論
3.1 發酵液前處理
由于發酵液中HA含量較高,黏度較大,直接過濾較困難,也易堵塞色譜柱,應先通過前處理將發酵液中的HA盡量除去。大分子透明質酸鈉可溶于水但不溶于有機溶劑如乙醇(50 %以上)等,而葡糖醛酸和乙酰氨基葡糖為小分子單糖,在高濃度乙醇中有一定的溶解度,利用這一差別,經過充分預實驗,將發酵液乙醇濃度調至80 %,可將其中的HA充分沉淀,也可將其它多糖類物質以及蛋白質等雜質除去,減少發酵液中的成分對檢測的干擾。
3.2 色譜柱的選擇
分析單糖類物質通常采用糖柱或氨基柱[8]。糖柱的填料往往是基于配體交換作用的聚合樹脂,其分離原理是基于配體交換反應,這類色譜柱往往價格昂貴且對多種單糖的分離效果不佳。氨基柱屬于弱陰離子交換柱,流動相一般為乙腈和水,廣泛應用于糖類檢測,但這類色譜柱的鍵和相易水解,使柱效在使用過程中下降很快,重復性和耐用性較差。本文選用親水作用色譜柱HILIC對單糖進行分析,HILIC是近年來色譜領域研究的熱點之一,是一種用來改善在反相色譜中保留較差的強極性物質保留行為的色譜技術。本文建立的檢測方法表明這類色譜柱適用于兩種單糖的分析,分離度滿足要求,穩定性好。
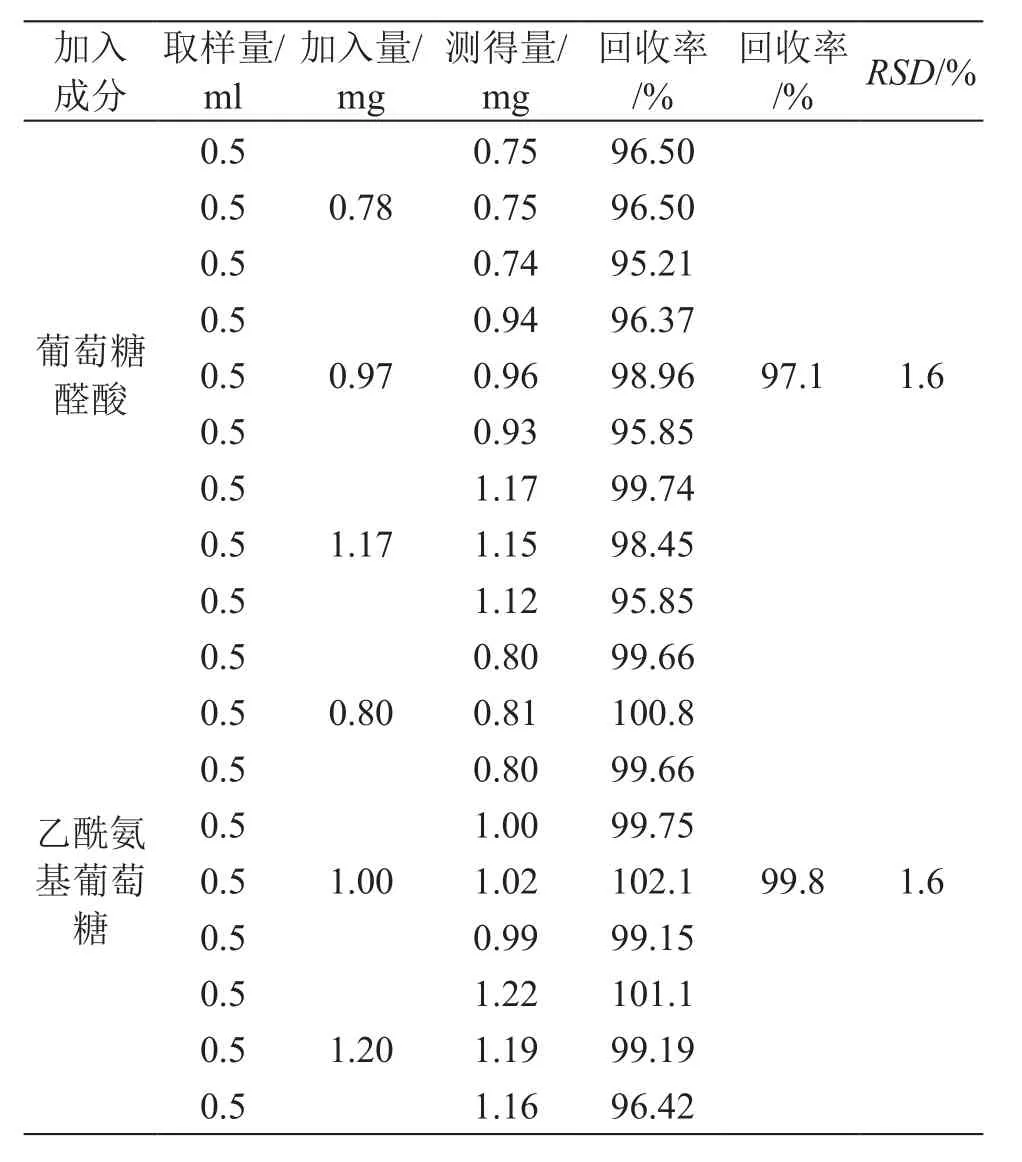
表1 加樣回收率實驗結果(n=9)
3.3 流動相的選擇
HILIC色譜柱分析單糖一般采用反相體系,緩沖鹽的加入能夠增加兩種單糖在色譜柱上的保留,通過調節緩沖鹽的濃度可改善兩種單糖的分離度,經實驗,最終確定流動相4 mmol/L磷酸二氫鈉。
本文建立了一種高效液相色譜法用于檢測HA發酵液中兩種單糖前體的含量,專屬性強,分離度好,且對檢測設備要求不高,基本配置(紫外檢測器)的高效液相色譜儀即可滿足要求,可用于發酵法生產HA的過程控制,了解轉化情況,輔助判斷發酵終點。
由于葡糖醛酸和乙酰氨基葡糖沒有特征紫外吸收,因此采用UV檢測器靈敏度并不是很高,兩種單糖的檢測限分別為20 ppm和2 ppm。如果將流動相中的不揮發性鹽用揮發性鹽(如乙酸銨)替代,則可用蒸發光散射檢測器來檢測單糖含量,提高方法靈敏度。

