芍藥苷調控酸敏感離子通道發揮鎮痛作用*
熊哲,謝家璇,朱鯤博,張雅婷,楊榮
(江漢大學醫學院1.生理教研室;2.2017級臨床實驗班,武漢 430056)
芍藥苷(paeoniflorin,Pae)源于毛茛科植物芍藥的根,是芍藥的主要有效成分。該藥具有擴張血管、解痙鎮痛、抗炎等作用,但其作用機制未被完全闡明。研究表明,多個受體和離子通道可能是芍藥苷發揮神經保護作用的靶點[1-2]。酸敏感離子通道(acid-sensing ion channels,ASICs)是H+門控的陽離子通道,在外周神經系統,ASICs作為酸感受器參與痛覺產生與調制,也是筆者前期研究工作的主要靶點之一[3-4]。芍藥苷是否能通過調控ASICs發揮鎮痛作用,筆者尚未見研究報道。筆者在本研究運用行為學和全細胞膜片鉗方法觀察芍藥苷鎮痛作用與大鼠三叉神經節(trigeminal ganglion,TG)神經元上ASICs關系,探討其可能作用機制,以期為芍藥苷用于臨床疼痛治療提供實驗依據。
1 材料與方法
1.1實驗動物 行為學和膜片鉗實驗均選用健康 SD 雄性大鼠,7~8周齡,體質量180~200 g,由華中科技大學同濟醫學院實驗動物中心提供[動物生產許可證號:醫動字第 19-025號;實驗動物合格證號:SCXK(鄂)2010-0007號],均自由飲食,飼養室溫度(23±2)℃,光暗周期同晝夜周期,相對濕度 (60±5)%。
1.2藥品與試劑 芍藥苷購自南京替斯艾么中藥研究所(淡黃色粉末,相對分子質量480.46,含量>98%,批號:TCM068-100316);腺苷A1受體拮抗劑1,3-二丙基-環戊黃嘌呤(8-cyclopentyl-1,3-dipropylxanthine,DPCPX,批號:9A/70155,Tocris公司 ),ASICs拮抗劑阿米洛利(amiloride,批號:BCBB4202)、三磷酸腺苷鎂(MgATP)、4-羥乙基哌嗪乙磺酸(4-[2-hydroxyethyl]-1-piperazineethanesulfonic acid,HEPES) 、 2-嗎啉乙磺酸 (2-[N-morpholino] ethanesulfonic acid,MES)均購自Sigma公司;木瓜蛋白酶(Roche公司,批號:201206);DMEM/F-12培養基(Gibco公司,批號:12400-016),其他藥品均為國產分析純。記錄 ASICs 電流細胞外液組成成分(mmol·L-1):氯化鈉(NaCl) 150,氯化鉀(KCl) 5,氯化鎂(MgCl2) 2,氯化鈣(CaCl2) 2,葡萄糖(glucose)10,HEPES 10,辣椒平(Capsazepine,CPZ) 0.01;分別用10 mmol·L-1MES在pH值6.9~5.9,或者10 mmol·L-1醋酸(acetate)在pH值<5.9范圍內替代10 mmol·L-1HEPES調整pH值。
記錄ASICs電流的電極內液組成成分(mmol·L-1):KCl 140,HEPES 10, MgCl22,二醇-雙-(2-氨基乙基)四乙酸(EGTA) 10,MgATP 2,用氫氧化鉀(KOH)調整pH值為7.2~7.4。
1.3儀器與設備 Axon patch 200B型膜片鉗放大器,P-97型微電極拉制儀和MP-285型微操縱器(美國Sutter 公司) ,Axiovert 200型倒置顯微鏡(德國Zeiss公司)。
1.4動物分組、模型制備與給藥方法 采用隨機數字表法,將大鼠分為5組,每組5只:對照組,模型組,阿米洛利組,芍藥苷組,DPCPX+芍藥苷組。造模前15 min,分別在上述各組大鼠右側觸須墊中央部位皮下注射0.9%氯化鈉溶液(NS)、NS、阿米洛利(30 μg)、NS和DPCPX(10 μg)各50 μL;5 min后分別腹腔注射NS、NS、NS、芍藥苷(50 mg·kg-1)和芍藥苷(50 mg·kg-1)。芍藥苷、阿米洛利和DPCPX于實驗前用NS溶解。腹腔注射10 min后開始制作面部炎性疼痛模型,對照組利用微量注射器取NS 50 μL注射到大鼠右側面部觸須墊皮下,其余4組右側面部皮下注射5% 甲醛50 μL。注射完畢后,立即將大鼠置有機玻璃觀察箱 (30 cm×30 cm×30 cm),視頻捕捉系統記錄大鼠自發痛行為。以大鼠抓搔注射部位時間( s )作為衡量疼痛行為指標,以3 min 為一觀察時段,連續記錄45 min。
1.5細胞的培養 SD大鼠腹腔注射20%烏拉坦麻醉(1.2 g·kg-1),斷頭,迅速取出三叉神經節,置于冷無鈣Hank’s平衡鹽溶液(Hank’s balanced salt solution,HBSS)。HBSS中沖洗2次,剪碎并加入木瓜蛋白酶150 μL、L-半胱氨酸5 mg,HBSS定容至3 mL,37 ℃,5% CO2培養箱消化40~50 min。然后用Pasteur管輕輕吹打使細胞分散,將細胞懸液轉入10 mL離心管,用含10%胎牛血清DMEM/F-12培養基定容5 mL,1 000 r·min-1離心3次(r=8 cm),每次5 min。將分離的單個三叉神經節細胞滴到多聚賴氨酸包被的蓋玻片,37 ℃,5%CO2培養箱培養過夜。
1.6全細胞膜片鉗記錄及數據的采集和分析 采用全細胞膜片鉗技術,在電壓鉗模式下記錄酸敏感離子通道電流。微電極由微電極拉制器兩步拉制而成,使其在充滿電極內液后的電阻維持在2~5 MΩ。通過微操縱器控制電極使封接電阻達GΩ 后,輕施負壓使細胞破膜,調節相應電容補償,即可獲得全細胞模式。實驗過程中,細胞均鉗制在-60 mV。信號采集頻率10 kHz,濾波頻率5 kHz,采樣后數據應用Clampfit 8.2進行分析。給藥通過快速換液裝置的排管進行,管口距所記錄的細胞約50 μm。
酸性液體作用的量效曲線用Hill方程擬合:I/Imax=[1+ {(pH)/pH50}n]-1,n為Hill系數,I為特定pH值時記錄到的電流幅度。pH50為半數有效pH。藥物對ASIC電流的抑制率按照下列公式計算:抑制率(%)=(對照ASIC電流幅值-藥物作用時ASIC電流幅值)/對照ASIC電流幅值×100%。
1.7統計學方法 采用Sigmaplot 9.0版軟件進行統計學分析,實驗結果以均數±標準誤表示,t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1芍藥苷對大鼠TG神經元上ASICs介導的酸誘導電流(Iasic)的調制作用 為研究芍藥苷對TG神經元上Iasic影響,在細胞外液中加入10 μmol·L-1TRPV1阻斷劑Capsazepine(CPZ),以排除TRPV1介導的酸誘導電流對實驗的干擾。選擇在中小直徑大鼠TG神經元 (15~30 μm)通過全細胞膜片鉗技術記錄Iasic。實驗中大部分受檢細胞(82.4%,98/119)對pH 5.9外液敏感,產生一個內向電流,阿米洛利(100 μmol·L-1)可明顯抑制酸性外液在TG神經元上誘發的內向電流,提示該內向電流由ASICs介導。該電流主要表現出3種形態:S型(slow type)為緩慢失活的內向電流(59.2%)、F型(fast type)為快速失活的內向電流(8.2%)、B型(biphasic inward current)是雙內向電流(32.6%),B型先出現一個快速失活的內向電流,緊跟著出現一持續內向電流(圖1)。
單獨應用芍藥苷未誘導出電流。實驗中預加100 μmol·L-1芍藥苷5 min 后,再給予酸性外液(pH值5.9),結果發現,芍藥苷對3種形態Iasic峰值均有明顯抑制作用,100 μmol·L-1芍藥苷使S型、F型和B型Iasic峰值分別減少了(36.8±5.1)%(n= 6,P<0.01)、(34.8±4.9)% (n=8,P<0.01) 和(37.4±6.6)% (n=6,P<0.01),提示芍藥苷對3種形態Iasic有類似抑制作用(圖1)。

芍藥苷(100 μmol·L-1)和阿米洛利(100 μmol·L-1)對酸性外液(pH 5.9)誘發的緩慢失活型(A) 、快速失活型(B)和雙內向電流(C)抑制作用。
圖1 芍藥苷和阿米洛利對大鼠TG神經元ASICs電流的抑制作用
Representative slow inactivated current type (A), fast inactivated current type(B) and biphasic inward current type(C) activated by acid extracellular solution (pH 5.9) were inhibited by Pae (100 μmol·L-1) and amiloride (100 μmol·L-1).
Fig.1InhibitionofPaeandamilorideonASICscurrentinTGneuronsofRats
在10~1000 μmol·L-1濃度范圍內,隨著芍藥苷濃度增加,其對Iasic(pH值5.9)抑制率也增加,最大抑制率(60.2±3.2)% (n=7),IC50為78.12 μmol·L-1(圖2)。
2.2預加和不預加芍藥苷時Iasic量效關系 圖3A為100 μmol·L-1芍藥苷對不同pH值酸性外液誘發的Iasic的抑制作用。圖3B為不含和含有100 μmol·L-1芍藥苷時Iasic量效曲線。從圖3可見,預加100 μmol·L-1芍藥苷 5 min,Iasic量效曲線明顯下移,閾值和最大反應pH值不變,預加芍藥苷前后兩條曲線pH50較接近,分別為6.46和6.38。
2.3芍藥苷對Iasic抑制作用機制 聯合應用腺苷A1受體特異性拮抗劑DPCPX ( 1 μmol·L-1) 時,DPCPX能部分逆轉芍藥苷 (100 μmol·L-1) 對Iasic(pH值5.9)的抑制作用(n=7)(圖4)。

A.不同濃度芍藥苷(10~1000 μmol·L-1)抑制Iasic(pH值5.9)的典型電流圖;B.芍藥苷對Iasic(pH值5.9)的抑制作用有濃度依賴性。
圖2 芍藥苷濃度依賴性抑制大鼠TG神經元Iasic
A.Representative current ofIasic(pH 5.9 ) inhibited with different concentration of Pae(10~1000 μmol·L-1); B.concentration-dependent inhibition of Pae onIasic(pH 5.9).
Fig.2Concentration-dependentinhibitionofPaeonIasicinTGneuronsofRats
2.4芍藥苷對甲醛誘導的面部炎性自發痛反應的作用 大鼠頜面部皮下注射甲醛 (5%,50 μL)可誘發典型雙相(第一相:0~3 min,第二相:12~36 min)自發疼反應,見圖5B。阿米洛利(30 μg)可明顯減少40%甲醛(福爾馬林)誘導的第二相(15~24 min)自發痛反應,在第二相15~18 min時間段,阿米洛利預先處理使大鼠抓臉持續時間由(52.8±4.6)s減少到(33.1±4.2)s(P<0.01),提示ASICs參與甲醛誘發的面部炎性自發痛的產生,見圖5A。預先腹腔注射芍藥苷 (50 mg·kg-1),能明顯抑制甲醛注射后18~27 min內自發痛反應,此外,大鼠面部皮下預先注射DPCPX,可部分翻轉芍藥苷抗傷害性作用,見圖5B。

A.芍藥苷(100 μmol·L-1) 抑制不同pH值酸性外液誘導的Iasic;B.預加100 μmol·L-1芍藥苷后,Iacid量效曲線明顯下移。
圖3 芍藥苷對Iasic量效曲線的影響
A.Current traces showed that Pae(100 μmol·L-1) inhibitedIasicinduced by different pH acid extracellular solution; B.The Concentration-response curve ofIasicwith Pae(100 μmol·L-1) pretreatment shifted downwards significantly.
Fig.3EffectofPaeonDose-responsecurveofIasic
3 討論
筆者在本實驗中發現,ASICs參與了5%甲醛溶液皮下注射誘發的頭面部持續性疼痛反應,芍藥苷可減輕該疼痛反應。組織酸化是致痛的原因之一,H+可通過激活外周傷害性感受器上的辣椒素受體(transient receptor potential vanilloid-1,TRPV1)和ASICs產生疼痛[6]。研究報道芍藥苷可抑制TRPV1介導的炎癥因子釋放,從而產生抗傷害性作用[7]。在全細胞膜片鉗實驗,筆者在細胞外液加入TRPV1特異性阻斷劑CPZ,整個實驗過程中都能觀察到芍藥苷對阿米洛利敏感的H+誘導電流的抑制作用,說明TG上的ASICs是芍藥苷產生鎮痛作用的新分子靶點。
在10~1000 μmol·L-1范圍內,隨著芍藥苷濃度增加,芍藥苷對TG神經元上的ASICs電流的抑制率也增加,呈現明顯濃度依賴性。如圖3所示,芍藥苷(100 μmol·L-1)非常有效地抑制了各pH值誘導的ASICs電流,即使是pH 4.9誘導出ASICs電流最大值也被芍藥苷抑制,提示芍藥苷可能通過非競爭性機制抑制ASICs。非競爭性作用方式存在兩種可能性:一種是芍藥苷可通過跨膜信號轉導途徑來抑制ASICs;另一種是芍藥苷直接結合到ASICs,然后通過變構調節作用,進而抑制ASICs電流。比較預加和不預加芍藥苷時ASICs電流的量效曲線有以下特點:①預加芍藥苷后濃度反應曲線明顯下移;②兩種情況下pH50值非常接近,分別為(6.31 ± 0.13)和(6.21 ± 0.15);③預加芍藥苷后最大反應濃度時ASICs電流幅值減小(54.89±4.94)%。結果表明,兩種情況下ASICs對H+親和力基本不變,提示芍藥苷可能通過受體介導的跨膜信號轉導途徑來抑制ASICs,而不是通過變構調節來發揮作用。
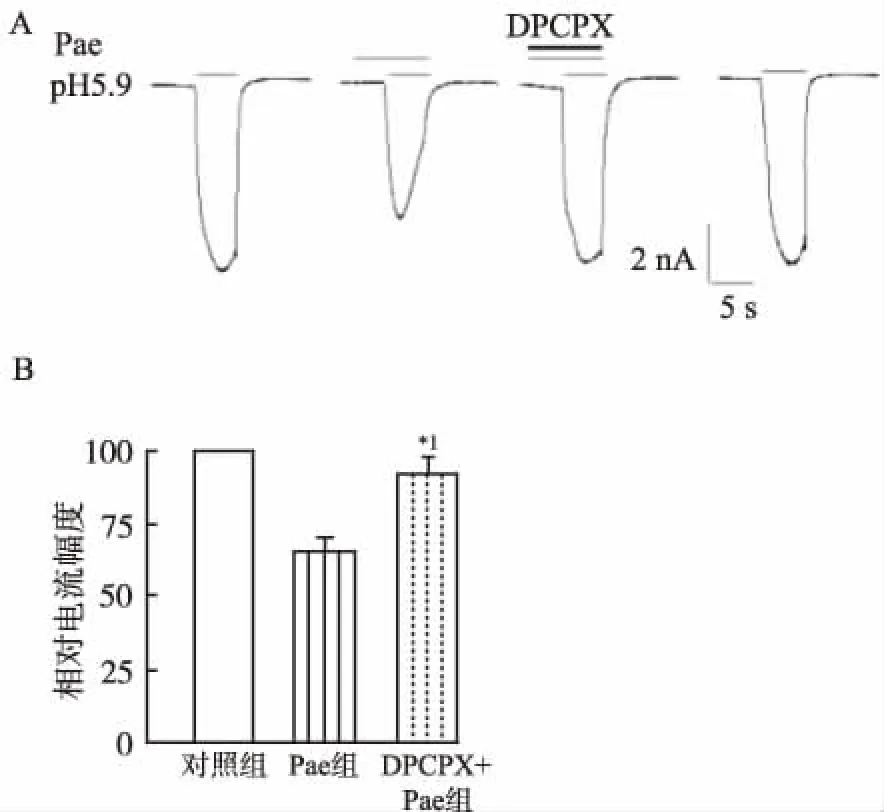
A.腺苷A1受體拮抗劑DPCPX阻斷了芍藥苷抑制Iacid(pH=5.9)的典型電流圖;B.聯合應用DPCPX(1 μmol·L-1)阻斷了芍藥苷(100 μmol·L-1)對Iacid(pH=5.9)抑制作用;與芍藥苷組比較,*1P<0.01。
圖4 芍藥苷抑制Iasic與腺苷A1受體關系
A.Adenosine A1 antagonist (DPCPX) abrogated the inhibition of Pae onIasic(pH=5.9) ; B.DPCPX combination abrogated the inhibition of Pae(100 μmol·L-1) onIasic(pH=5.9);*1P<0.01 versus Pae.
Fig.4RelationshipoftheinhibitionofPaeonIasicandadenosineA1antagonist
ASICs拮抗劑對口面部炎性疼痛有鎮痛作用,提示ASICs 參與口面部炎性疼痛信息的產生和(或)傳導。研究報道芍藥苷可激活腺苷A1受體來產生神經保護作用[8-10]。腺苷A1受體在神經系統分布廣泛,在三叉神經節中也存在大量A1受體[11-12]。本實驗中,面部皮下注射A1受體拮抗劑DPCPX可部分阻斷芍藥苷鎮痛效應,提示外周A1受體參與了芍藥苷鎮痛作用。此外,筆者還發現DPCPX可部分阻斷芍藥苷對ASICs電流抑制作用,表明TG神經元上A1受體是芍藥苷發揮鎮痛作用的靶點之一。

A.阿米洛利對Formalin誘發疼痛反應的抑制作用;B.Pae的面部鎮痛作用;與模型對照組比較,*1P<0.01,*4P<0.05;與對照組比較,*2P<0.01,*3P<0.05;與芍藥苷組比較,*5P<0.05。
圖5 芍藥苷抗傷害性作用與腺苷A1受體關系
A.amiloride attenuated formalin-induced pain response;B.analgesic effect of Pae on face;Compared with model group,*1P<0.01,*4P<0.05;Compared with control group,*2P<0.01,*3P<0.05;Compared with Pae group,*5P<0.05.
Fig.5Relationshipofanti-nociceptiveresponseofPaeandadenosineA1antagonist
綜上所述,芍藥苷對口面部外周炎性痛的鎮痛效應與其作用于A1受體進而下調TG神經元上ASICs的敏感性有關。本研究結果對闡明芍藥苷的鎮痛作用機制提供了一定的理論和實驗依據。

