小分子熱休克蛋白在宰后牛肉成熟中的作用
黃 峰 , 丁振江 , 孫紅霞 , 張春江 , 張 良 , 張 泓 *
(1.中國農業科學院 農產品加工研究所(北京),北京100193;2.中國農業科學院 合肥食品營養與健康創新研究院,安徽 合肥 238000;3.中國農業科學院 農產品加工研究所(哈爾濱),黑龍江 哈爾濱 151900)
動物品種、性別、肌肉的部位和營養情況等都可以影響肉的嫩度,但本質上影響嫩度改善的因素主要包括結締組織含量、肌節長度和肌原纖維蛋白的水解程度3個方面[1]。結締組織的含量主要影響肉的“本底硬度”,肌節長度主要在僵直過程中對肉嫩度產生影響,而肌原纖維蛋白的有限降解是成熟過程中肌肉嫩度得到改善的主要原因。目前,控制宰后嫩化的方法主要有化學、物理、生物和酶類嫩化法等,其中鈣激活酶體系是酶類嫩化法的主要研究對象[2]。鈣激活酶被認為是宰后肌肉成熟過程中發揮關鍵作用的內源酶類[3-4]。但最近研究發現除鈣激活酶外,細胞凋亡酶也參與了宰后肌肉的嫩化過程,成熟是多種內源酶和調控因子協同作用的結果[5-7]。熱休克蛋白作為一種機體保護蛋白,在動物被屠宰放血后,正常的生理狀態被打破,促使機體釋放熱休克蛋白而產生免疫應答。隨著蛋白質組學技術在肉品中的應用,許多的小分子熱休克蛋白(small heat shock proteins,sHSPs) 在宰后肌肉中被檢測到,并發現與宰后肌肉嫩度、保水性等食用品質變化具有顯著相關性,并被認為可能是宰后肌肉成熟過程中的一個重要調控因子[8-9]。作者主要對小分子熱休克蛋白的種類、結構與功能及對宰后肌肉成熟過程的調控機制進行探討。
1 小分子熱休克蛋白的種類與結構
熱休克蛋白是指生物體遭受外界高于其正常生長溫度或劇烈震動時,新合成或過表達的一類保護機體自身的蛋白質,又稱為脅迫蛋白。最早由遺傳學家Ritossa[10]在1962年研究果蠅唾液腺時發現。根據單聚體相對分子質量大小和同源程度不同,可將熱休克蛋白分為 sHSPs,HSP 60,HSP 70,HSP 90及HSP110五大家族[11]。sHSPs是熱休克蛋白的亞單位之一,相對分子質量在12 000~43 000之間,和其他熱休克蛋白相比,該類蛋白不需要ATP即能發揮作用。目前已在哺乳動物中發現了11種sHSPs,且在不同組織中表達不同(表1)[4]。Taylor等[12]依據其在組織中的表達把sHSPs分為兩類,一類是在所有組織中均表達;另一類是只在特定組織中表達。sHSPs作為一種重要的分子伴侶蛋白,結構上高度保守,在氨基酸序列C末端具有一段由80~100個氨基酸殘基組成特定區域,因與 αβ-晶體蛋白具有很高的同源性,所以也稱為αβ-晶體蛋白區域[13]。除了一個靈活的C端,sHSPs還有一個連接著一個保守序列區域WDPF的N端[14]。sHSPs在體內以高度有序的寡聚體形式存在,其寡聚體的結構和組成均取決于每個小分子熱休克蛋白單體的a-晶體結構以及C端和N端的長度和結構。受到應激反應時,sHSPs會發生解離或聚合,可形成相對分子質量達到2×105~8×105的低聚體復合物,從而發揮其生物學功能。
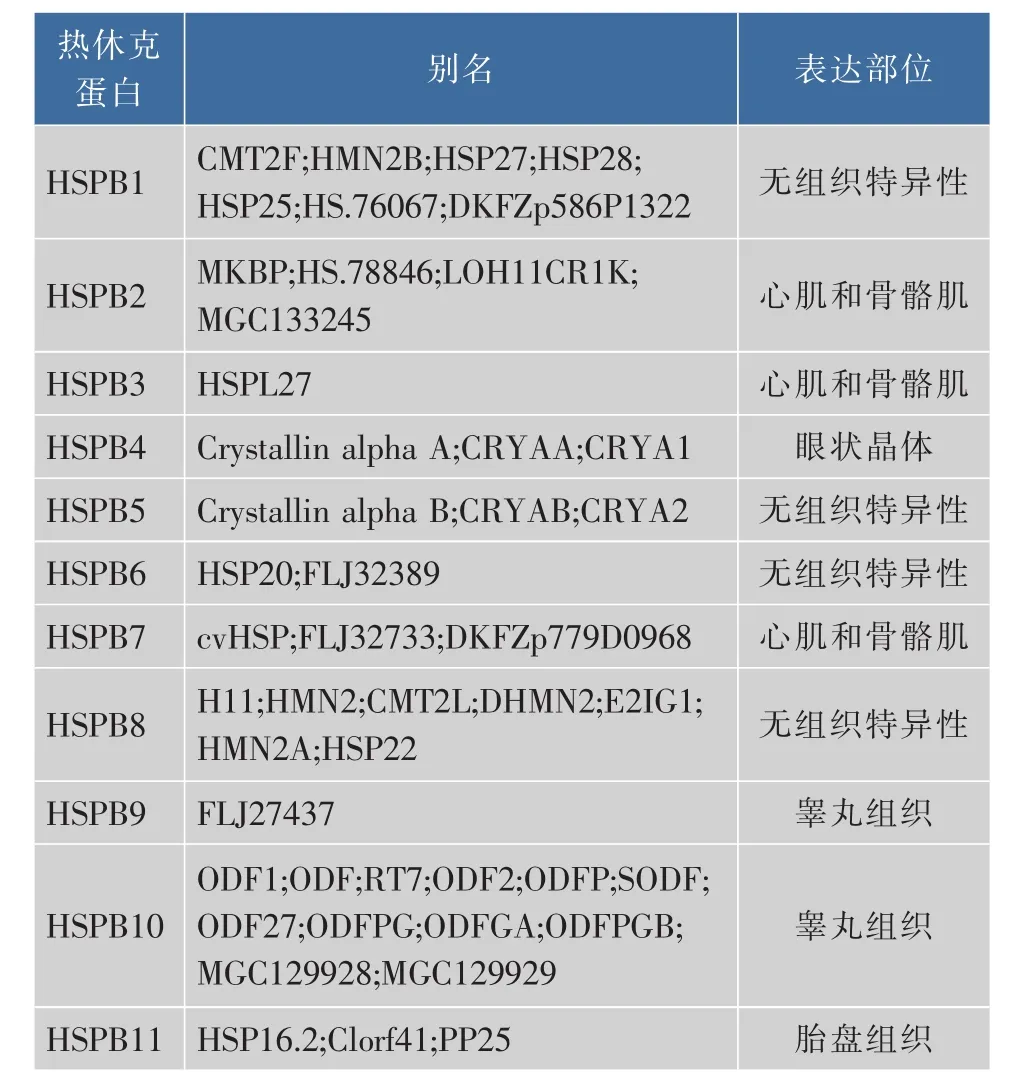
表1 小分子熱休克蛋白家族Table 1 Small heat shock proteins family
2 小分子熱休克蛋白的主要生物學功能
2.1 穩定細胞骨架
細胞骨架由微絲、微管和中間纖維構成,小熱休克蛋白具有穩定和修復細胞骨架結構的作用。HSP 27和aβ-晶狀體蛋白是sHSPs家族中的重要成員,有保護細胞骨架蛋白免受各種應激因素的損傷、防止蛋白變性和使變性的蛋白恢復折疊等作用[15]。肌動蛋白是微絲系統的主要組成部分,肌動蛋白受溫度影響較大,在高溫下以不溶性形式聚集,破壞細胞骨架;而HSP 27能使不可溶性肌動蛋白轉變為可溶性,從而穩定細胞骨架[10]。此外,強氧化刺激通過產生ROS破壞細胞中的微絲系統,并導致肌動蛋白的解聚和片段化,而HSP 27可以通過抑制ROS的產生而保護細胞骨架[17]。
2.2 分子伴侶功能
分子伴侶作用是指能夠結合或釋放其他蛋白質的不穩定構象,使得多肽鏈可以進一步的折疊,多聚體的組合或降解以及細胞器蛋白跨膜轉運的一種功能[18]。雖然sHSPs在哺乳動物細胞中的分子伴侶作用機制還未研究清楚,但是sHSPs在細胞中的作用是不可否認的。例如:HSP 27可以與甾體激素受體結合,不僅可以避免不良反應的發生;結合物還可通過激活蛋白酶活性生成超氧化物歧化酶(SOD)等,增強細胞耐熱、抗理化反應及抗氧化物損傷的功能;同時可提供結合蛋白,協同參與抗原遞呈、加工、“T”細胞導航以及免疫球蛋白裝配[19]等作用。HSP 22可與抗凋亡蛋白Bag3(又稱Bcl-2 interacting death suppressor)結合形成分子伴侶復合物[20]。HSP 22與HSP 27和其它分子伴侶相互作用,有刺激心肌細胞生存的作用[21]。研究表明,磷酸化程度較低的HSP 27多聚體的分子伴侶作用較強[22]。
2.3 抑制細胞凋亡
1972年Kerr[23]等首次提出細胞凋亡(apoptosis)的概念。細胞凋亡是指機體細胞收到凋亡信號的刺激后,在多個凋亡因子的相互作用下進行信號傳導并規律性完成的細胞程序性死亡,不同的凋亡誘導信號所形成的傳導途徑不同,目前發現的傳導途徑主要包括死亡受體通路(外通路)、線粒體通路(內通路)和內質網通路[24]。目前已有許多關于熱休克蛋白抑制細胞凋亡方面的報道,都是通過某種方式阻斷細胞凋亡通路。Mehlen等[25]探究到人類HSP 27表達可抑制Fas受體介導的細胞凋亡通路,即通過封閉接頭蛋白Daxx與細胞凋亡信號調節激酶Ⅰ之間的相互作用;Concannon CG等[26]發現HSP 27可以與procaspase-3結合阻礙其活化而抑制細胞凋亡。上述都是由于阻斷了細胞凋亡的死亡受體通路即外通路而抑制細胞凋亡。Mehlen等發現sHSPs對腫瘤壞死因子(TNF-a)的作用主要依賴于解毒分子谷胱甘肽(GSH),阻止細胞色素 C(Cytochrome C,Cyt-C)的釋放,進而抑制細胞凋亡;Rane MJ等[27]研究發現HSP27可通過調控caspase-9抑制細胞凋亡;Mao[28]報道αβ-晶體蛋白在十字孢堿所致的凋亡過程中與bax,bcl-Xs結合,抑制兩者向線粒體的移位,從而起到抑制細胞凋亡的作用。上述都是由于阻斷了線粒體通路即內通路而抑制細胞凋亡。
2.4 心臟保護作用
研究表明血漿中HSP B1抗原濃度明顯提高主要表現在冠狀動脈疾病患者中[29],且機體血漿中HSP B1抗體濃度與是否患有該疾病及病情嚴重程度有明顯的相關性[30]。在缺血心肌組織中HSP B5表達量明顯增高,研究證明影響HSP B5以何種磷酸化形式參與缺血病理過程的因素較多,缺血時間可能是其一。Wang X等[31]研究發現向大鼠體內注射帶有HSP B6基因的骨髓間充質干細胞有利于治療心肌梗死。有實驗表明HSP B8的過表達可以增強線粒體產生NO,進而保護心臟[32]。目前HSP保護缺血心肌組織的機制還需進一步研究。
3 小分子熱休克蛋白在成熟過程中的作用
3.1 小分子熱休克蛋白與宰后牛肉嫩度的關系
隨著蛋白質組學技術在肉品中的應用,許多的小分子熱休克蛋白在宰后肌肉中被檢測到。在哺乳動物中共檢測到11種 sHSPs,其中HSP 27、HSP 20和αβ-晶體蛋白在骨骼肌中的表達量最高[8]。Ouali等[33]首次提出小分子熱休克蛋白可能對肉品質有影響。各類小分子熱休克蛋白可以不同程度的抑制細胞凋亡,并通過分子伴侶作用維持細胞穩定,此外,小分子熱休克蛋白還可以延緩肌肉的老化速度、減弱肌原纖維蛋白降解。宰后肌肉中小分子熱休克蛋白的表達和對肉品質的影響機制還有待研究。
在嫩度預測因子的研究中發現HSP 27及其降解產物的含量可解釋91%的嫩度變化,高于之前發現的最高嫩度預測因子琥珀酸脫氫酶解釋的57.8%嫩度變化[34],因此,被許多學者認為HSP 27是最有可能參與嫩化過程的熱休克蛋白。目前,針對sHSPs的表達與宰后牛肉的嫩度的關系,有兩種對立的看法。Kim等[35]在宰后牛肉中發現HSP 27的表達與宰后牛肉嫩度之間存在正相關。Bernard等[36]研究表明由于sHSPs的分子伴侶作用,HSP 27和αβ-晶體蛋白的共同調節有利于肌動蛋白和肌球蛋白的降解,進而提高肉的嫩度。Morzel等[35]也發現HSP 27的表達與宰后牛肉嫩度之間存在正相關,并認為HSP27可能是因為抑制蛋白聚集,從而有利于肌原纖維蛋白的降解,最終提高了宰后牛肉嫩度。相反,Lomiwes等[37]在不同嫩度的牛肉中發現HSP 27表達量顯著不同,HSP 27含量越高的牛肉其嫩度越差。Balan等[38]在宰后牛肉中發現HSP27發生降解,且降解程度顯著相關與肌間線蛋白和肌鈣蛋白-T的降解,并推測降解后的HSP27喪失了其保護功能,從而提高內源酶對肌原纖維蛋白的水解能力。
3.2 sHSPs調控宰后牛肉嫩度的潛在機制
Bernard等[39]認為HSP 27可以和αβ-晶體蛋白、HSP B8相互作用而影響宰后肌肉的嫩度。有研究表明HSP 27的下調會導致肌動蛋白的聚合,提高肌動蛋白微絲的穩定性,而肌動蛋白和肌球蛋白的降解和宰后肌肉的嫩度有密切聯系,推測肌動蛋白和肌球蛋白的降解影響肉的質地,肌動蛋白的降解有利于宰后肌肉的嫩化,并且發現肌球蛋白輕鏈II和磷酸丙糖異構酶I也和肌肉嫩度有明顯的聯系。此外,HSP 27也是一種抗細胞凋亡蛋白,可以和細胞凋亡信號通路的關鍵控制蛋白結合,通過影響細胞凋亡的進程進而影響宰后肌肉的嫩度。
研究表明:pH值從7.4降低到6.5,會伴隨著αβ-晶體蛋白和肌原纖維蛋白的結合程度增加,也意味著肌肉中sHSPs濃度的降低是和結合肌原纖維蛋白有關聯[40]。通過體外模擬實驗,將αβ-晶體蛋白添加到肌原纖維蛋白提取物中會降低肌間線蛋白和肌聯蛋白的降解,進一步可以說明αβ-晶體蛋白可以作為μ-鈣激活酶的底物,并競爭性的抑制μ-鈣激活酶的活性[41],進而影響肉的嫩度,而αβ-晶體蛋白對宰后肌肉嫩化的作用機制還有待研究。
3.3 pH值對sHSPs調控作用的影響
最近的研究還發現宰后肌肉的極限pH值(pHu)與HSP表達及嫩度變化相關,Pulford等[41]認為pHu的降低會導致HSP 20、HSP 27和 αβ-晶體蛋白在肌肉中的濃度降低,并且在處于中間pHu的宰后肌肉中可以檢測出sHSPs,在低pHu或高pHu條件下,只能檢測出很少的sHSPs,推測損失的部分sHSPs是由于生成了由磷酸化或脫磷酸化的sHSPs、ATP以及信號傳導等控制的低聚體絡合物。pHu在5.8~6.0之間牛肉其嫩度較其他pH范圍的差,這種嫩度差異可能是由于pH改變了HSP 27對鈣激活酶的水解活性,最終造成鈣激活酶對肌原纖維蛋白的水解程度不同所造成[37,42-43]。也有學者推測在中間pHu,內源性蛋白水解活動和高濃度sHSPs的共同作用會穩定肌原纖維蛋白,并阻礙肌原纖維蛋白的水解,進而降低肉的嫩度[43]。此外,Lomiwes等[43]研究表明高pHu條件下的sHSPs濃度高于低pHu條件下sHSPs的濃度,盡管如此,在高pHu條件下,sHSPs也會隨著肉品質的成熟發生降解,可能是由于在此pH是μ-鈣激活酶的最佳活性條件。另外,許多學者利用蛋白質組學在宰后肌肉中檢測到HSP 27不同等電點的異構體[44],而磷酸化作為改變蛋白等電點的一種常見方式值得關注。
4 展望
目前有關熱休克蛋白27在細胞培養或在病理狀態下(如神經肌肉失調、肌炎、肌萎縮等)下的調控機制研究已相對成熟。許多學者最近發現熱休克蛋白27與宰后肌肉嫩度之間存在顯著相關性,但對這種相關性的內在機制存在兩種推測:一是HSP 27由于降解或沉淀喪失保護功能,從而提高內源酶水解能力;另一種是HSP 27可能抑制肌肉蛋白聚集更有利于其降解。目前有關HSP 27在宰后嫩化過程中的調控機制研究還較少,直接的支撐數據更是有限,特別是宰后肌肉嫩化過程中HSP 27對肌原纖維蛋白、細胞凋亡酶和鈣激活酶的結構修飾及修飾后肌原纖維蛋白對肌肉內源酶水解敏感性變化以及修飾后鈣激活酶或細胞凋亡酶酶對肌原纖維蛋白的水解活性變化等。因此,熱休克蛋白27在宰后肌肉嫩化過程中的調控機制有待深入研究,從而豐富和發展肉的嫩化理論,進一步完善嫩化過程中的內源酶調控網絡提供新的理論依據。

