術前血清前白蛋白水平與甲胎蛋白陰性肝細胞癌患者預后的關系
王奪 梁夏宜 劉軍杰 陳潔 陳苗 李航
作者單位:530021 南寧 1廣西醫科大學附屬腫瘤醫院超聲科;2廣西醫科大學第二臨床醫學院;3廣西醫科大學附屬腫瘤醫院肝膽外科
原發性肝癌居全球惡性腫瘤病死率第2位[1],其主要病理類型為肝細胞癌(hepatocellular carcinoma,HCC),大多數HCC患者確診時已屬晚期,預后較差。甲胎蛋白(alpha-fetoprotein,AFP)是HCC早期診斷和評估預后的血清生物學指標[2],但AFP受體內多種因素調控,早期單獨AFP檢測漏診率高達40%,且晚期仍有約30%的HCC患者術前和術后血清AFP表現為陰性或較低水平(<20 μg/L)[3-4]。因此,尋找精確評估AFP陰性肝細胞癌(AFP-negative hepatocellular carcinoma,AFP-NHCC)患者預后的生物學指標具有重要意義。前白蛋白(prealbumin,PA)是由肝細胞合成的不受外源影響的血漿載體蛋白,其在血清中的含量能反映肝細胞功能,動態變化可預測多種惡性腫瘤的預后[5-8]。本研究旨在探討術前血清PA水平與接受肝切除術AFP-NHCC患者預后的相關性。
1 資料與方法
1.1 研究對象
回顧性分析2014年1月至2015年12月于廣西醫科大學附屬腫瘤醫院行肝癌切除術患者的臨床資料。納入標準:⑴術前血清AFP<20 ng/mL者;⑵既往無其他消化系統疾病;⑶臨床病理資料以及隨訪信息完整;⑷術后病理證實為HCC。排除標準:⑴合并其他惡性腫瘤;⑵合并其他影響PA水平的疾病。本研究經醫院倫理委員會批準,所有患者均簽署知情同意書。
1.2 資料收集
通過既往文獻[5-9]和電子病歷系統選取與PA相關的臨床指標:⑴基線資料,包括性別、年齡、肝病家族史、體質指數(body mass index,BMI);⑵術前血清學指標,包括乙肝表面抗原(hepatitis B surface antigen,HBsAg)、總膽紅素(total bilirubin,TBIL)、血清白蛋白(albumin,ALB)、谷丙轉氨酶(alanine aminotransferase,ALT)、谷草轉氨酶(aspartate aminotransferase,AST)、血清 PA;⑶臨床病理指標,包括肝硬化情況、腫瘤直徑及數目、有無大血管侵犯、Child-Pugh分級、巴塞羅那分期(Barcelona Clinic Liver Cancer,BCLC)。所有患者均采集晨起空腹靜脈血,術前1周內檢測血清PA水平。共118例患者納入研究,分為高 PA組(≥170 mg/L)和低PA組(<170mg/L)。
1.3 隨訪
術后1周開始隨訪,術后1年內每1個月隨訪1次,1年后每3個月隨訪1次,隨訪截至2018年5月31日。隨訪方式包括門診隨訪、電話隨訪和上門隨訪。隨訪內容包含肝功能、腫瘤血清學指標、影像學檢查、生存狀態和死亡時間等。隨訪終點定義為患者發生死亡事件或截至隨訪日期。總生存時間(overall survival,OS)定義為患者接受手術之日至死亡或隨訪結束的時間。
1.4 統計學方法
采用SPSS 24.0軟件進行數據分析。計量資料采用均數±標準差(χ±s)表示;分類資料采用n(%)描述,組間比較采用χ2檢驗或Fisher確切概率法;生存分析采用Kaplan-Meier法,組間比較采用Log-rank檢驗;采用Cox回歸分析術前血清PA水平與OS的關系。以雙側P<0.05為差異有統計學意義。
2 結果
2.1 一般資料
共118例患者符合標準納入研究,其中男性103例,女性15例;平均年齡(48.7±10.6)歲。低PA組28例,高PA組90例,兩組患者基線資料比較見表1。
2.2 術前血清PA水平與AFP-NHCC患者臨床病理特征的關系
術前血清PA水平與腫瘤直徑、大血管侵犯、Child-Pugh分級以及BCLC分期有關(P<0.05),但與性別、年齡、家族史、BMI、HBsAg、TBIL、腫瘤數目等無關(P>0.05)。見表 1。
2.3 術前血清PA水平與AFP-NHCC患者預后的關系
118例患者隨訪資料完整,隨訪時間為2~53個月,中位隨訪時間為35個月。高PA組和低PA組患者中位生存時間分別為36.0個月和24.5個月,高PA組1年生存率、3年生存率分別為94.4%、83.3%,低PA組1年生存率、3年生存率分別為78.5%、60.8%,高PA組的生存率高于低PA組(χ2=11.689,P=0.001)。見圖1。
單因素Cox回歸分析顯示,低PA組AFP-NHCC患者的死亡風險大于高PA組(HR=2.779,95%CI:1.406~5.492,P=0.003)。進一步校正不同混雜因素后分析PA與OS的關系:模型2調整性別、年齡、肝病家族史、BMI,模型 3 調整 HBsAg、TBIL、ALB、ALT、AST及模型2中的因素,模型4調整表1中的所有臨床,結果均顯示低PA組AFP-NHCC患者的死亡風險大于高 PA 組(HR=2.975,95%CI:1.447~6.113,P=0.003;HR=3.144,95%CI:1.507~5.560,P=0.002;HR=2.622,95%CI:1.084~6.340,P=0.032)。見表 2。
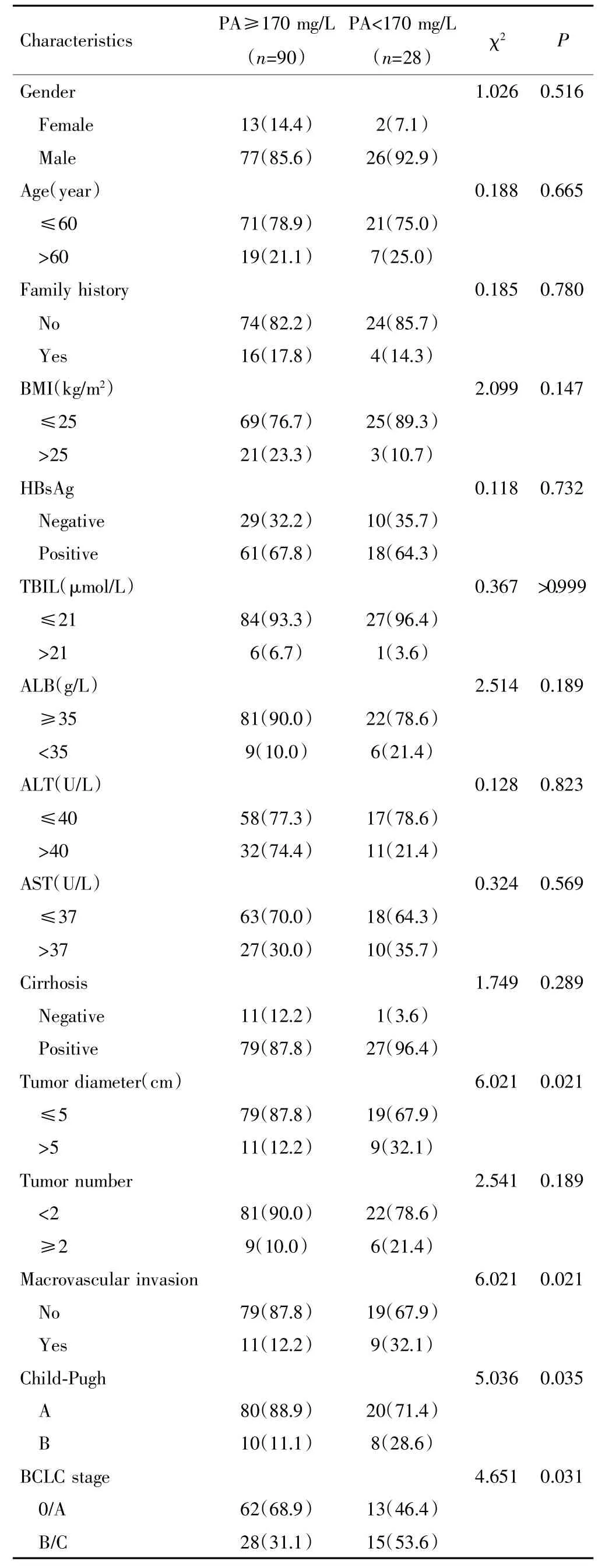
表1 術前血清PA水平與AFP-NHCC患者臨床病理特征的關系[n(%)]Tab.1 Relationship between preoperative serum PA level and clinicopathological characteristics of AFP-NHCC patients[n(%)]
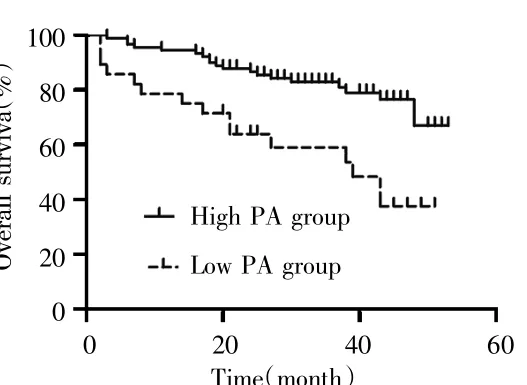
圖1 術前不同血清PA水平AFP-NHCC患者的生存曲線Fig.1 Curve of preoperative serum PA level and survival time of AFP-NHCC patients
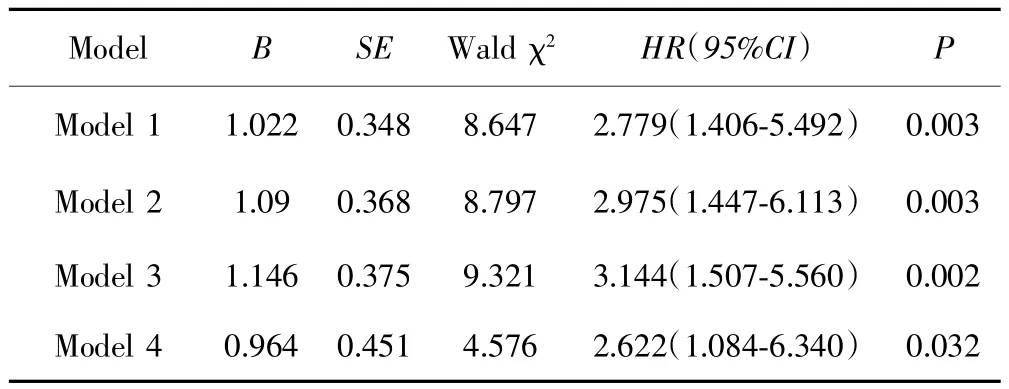
表2 術前血清PA水平與AFP-NHCC患者OS的關系Tab.2 Relationship between preoperative serum PA level and OS of AFP-NHCC patients
3 討論
目前臨床上部分HCC患者術前及術后AFP呈陰性,檢測AFP診斷AFP-NHCC的敏感性較低[10]。因此,尋找有效的評估指標,對改善AFP-NHCC患者預后尤為重要。PA又稱轉甲狀腺素蛋白,半衰期僅為1.9 d,為肝臟中合成的急性時相蛋白,易于采集[11]。研究顯示PA可評估患者機體營養狀態,亦可對肝細胞損傷產生免疫應答并促進淋巴細胞成熟,在反映肝功能儲備方面較其他血清學指標更敏感,已逐漸應用于評估多種惡性腫瘤預后[9,12-13]。本研究顯示,患者術前血清PA水平與腫瘤直徑、大血管侵犯、Child-Pugh分級和BCLC分期有關,PA水平較低的HCC患者腫瘤直徑更大、大血管侵犯比例更高,與國內外研究結果一致[6-7],說明PA可能與HCC進展有關。在腫瘤發生發展過程中會伴隨蛋白質消耗增加,同時機體會出現不同程度的營養吸收障礙,導致蛋白質流失,引起PA水平降低。前白蛋白作為評價肝功能的指標,PA水平降低往往預示肝臟代償功能受損和營養狀態惡化,而肝功能受損可進一步降低患者的自身免疫能力,導致腫瘤進展,因此Child-Pugh分級和BCLC分期越差的肝癌患者PA水平越低。
LI等[14]研究表明,PA水平偏低是HCC患者肝切除術后肝功能不全的獨立危險因素。有學者提出將PA水平納入Child-Pugh分級評估HCC患者預后[15]。一項多中心研究亦顯示血清PA水平低可顯著影響肝癌患者的長期預后[16]。本研究進一步分析發現,術前血清PA<170 mg/L的AFP-NHCC患者總生存期較PA≥170 mg/L患者明顯縮短,多個Cox回歸模型均顯示低PA水平與AFP-NHCC患者術后OS較差有關。分析原因可能是低PA水平患者代償性肝功能水平較差,對乙肝毒性的炎癥刺激作用的防御能力降低,同時免疫抑制狀態給腫瘤發展與轉移提供了良好的生理環境。此外,術前血清PA采集方便,價格低廉,檢測準確性高,可重復性強,因此PA可用于輔助評估AFP-NHCC患者的預后。
綜上所述,本研究發現術前血清PA低水平與AFP-NHCC患者腫瘤直徑、大血管侵犯、Child-Pugh分級和BCLC分期有關,且預后較差,PA有望成為評估接受肝切除術肝癌患者預后的指標。但本研究為回顧性研究,樣本量較少,且隨訪時間有限,因此有關結論有待進一步驗證。

