Let-7a過表達(dá)對(duì)結(jié)腸黏液腺癌細(xì)胞LS-174T增殖及侵襲性的影響
黃崇杰,曹偉蘭,洪滉,劉鵬鵬,劉長(zhǎng)寶
(1.溫州醫(yī)科大學(xué)附屬第二醫(yī)院 肛腸外科,浙江 溫州 325027;2.溫州醫(yī)科大學(xué)附屬第五醫(yī)院 甲乳外科,浙江 麗水 323000)
大腸癌是最常見的消化道惡性腫瘤之一,其發(fā)病率在全球各腫瘤中位居第三,且有逐年升高的趨勢(shì)[1]。結(jié)直腸黏液腺癌占大腸癌病例的10%~15%,易發(fā)生腹膜種植轉(zhuǎn)移,對(duì)化療的反應(yīng)較差,所以根治切除率低,預(yù)后差[2]。目前關(guān)于腹膜種植轉(zhuǎn)移的機(jī)制尚不十分清楚,TGF-β是一種多功能的多肽類細(xì)胞因子,TGF-β1是其中一種亞型,大量研究發(fā)現(xiàn)其在胰腺癌、胃癌、大腸癌中的表達(dá)量明顯升高,且與腫瘤的預(yù)后較差直接相關(guān)[3-5]。miRNA與腫瘤的發(fā)生發(fā)展密切相關(guān),一直是近幾年來腫瘤研究的熱點(diǎn),let-7家族是第2個(gè)被發(fā)現(xiàn)的miRNA分子,而let-7a基因的下調(diào)已被公認(rèn)為大腸癌發(fā)生發(fā)展中的關(guān)鍵事件,且已被證實(shí)是一個(gè)抑癌基因,其中c-myc、RAS和HMGA2為let-7的下游靶基因。最新研究表明它可以調(diào)控TGF-β1信號(hào)通路,影響細(xì)胞增殖和分化[6],但對(duì)黏液腺癌腹膜轉(zhuǎn)移方面的研究尚未見報(bào)道。本研究通過慢病毒載體介導(dǎo)攜帶人let-7a基因?qū)肴私Y(jié)腸黏液腺癌LS-174T細(xì)胞,上調(diào)1et-7a基因的表達(dá),通過體外實(shí)驗(yàn),觀察其對(duì)腫瘤的生長(zhǎng)抑制作用、侵襲轉(zhuǎn)移及TGF-β1蛋白表達(dá)的影響,從而探討其與結(jié)腸黏液腺癌腹膜轉(zhuǎn)移的關(guān)系。
1 材料和方法
1.1 細(xì)胞株及主要材料人結(jié)腸黏液腺癌細(xì)胞LS-174T購自中國(guó)科學(xué)院上海分院,let-7a過表達(dá)慢病毒載體系統(tǒng)由上海吉?jiǎng)P基因科技有限公司構(gòu)建完成,DMEM培養(yǎng)基購自美國(guó)Gibco公司,0.25%胰蛋白酶購自美國(guó)Gibco公司,胎牛血清購買自杭州四季青公司,兔抗人Anti-TGF-β1多克隆抗體,山羊Anti-Rabbit IgG購自英國(guó)Abcam公司,RT-PCR反轉(zhuǎn)錄試劑盒購自加拿大MBI fermentas公司,Real-time試劑盒購自日本Toyobo公司,RNA提取液TRIzol購自美國(guó)Invitrogen公司,RT-qPCR引物購自上海生工生物工程有限公司。
1.2 方法
1.2.1 細(xì)胞轉(zhuǎn)染:①結(jié)腸黏液腺癌LS-174T細(xì)胞分為5組:空白對(duì)照組(A組,不進(jìn)行病毒轉(zhuǎn)染);轉(zhuǎn)染空病毒組(B組,只含有EGFP,濃度1×107TU/L);C1轉(zhuǎn)染組(C1組,濃度1×106TU/L):轉(zhuǎn)染hsa-Let-7a(含let-7a病毒和EGFP);C2轉(zhuǎn)染組(C2組,濃度1×107TU/L):轉(zhuǎn)染hsa-Let-7a(含let-7a病毒和EGFP);C3轉(zhuǎn)染組(C3組,濃度1×108TU/L):轉(zhuǎn)染hsa-Let-7a(含let-7a病毒和EGFP)。②0.25%胰蛋白酶消化細(xì)胞后,配制成密度為2.0×105/mL的細(xì)胞懸液種植于24孔板中。待細(xì)胞匯合度達(dá)到50%~60%時(shí)進(jìn)行病毒轉(zhuǎn)染,按3個(gè)不同的MOI值(MOI=1、10、100)計(jì)算所需病毒量,用Eni.S稀釋得到所需滴度。用培養(yǎng)基稀釋Polybrane使終濃度為5 μg/mL。病毒液、Polybrane、完全培養(yǎng)基按一定的比例配制,調(diào)整每孔總量為500 μL,加入標(biāo)記好的各孔。培養(yǎng)12 h后進(jìn)行換液,48 h后使用熒光顯微鏡觀察細(xì)胞生長(zhǎng)狀況及綠熒光表達(dá)情況。
1.2.2 MTT實(shí)驗(yàn):將上述5組細(xì)胞接種于96孔板,每組設(shè)8個(gè)復(fù)孔,同時(shí)設(shè)調(diào)零孔。分別于12、24、48、72、96 h各時(shí)點(diǎn)取一板,向所對(duì)應(yīng)孔中各加入20 μL配好的MTT溶液。培養(yǎng)箱內(nèi)孵育4 h后棄去培養(yǎng)液,每孔加入DMSO 200 μL,避光搖床上振蕩10 min,使其充分混勻。酶標(biāo)儀上選擇570 nm波長(zhǎng),檢測(cè)各孔的OD值,以時(shí)間為橫坐標(biāo),OD值為縱坐標(biāo),繪制LS-174T細(xì)胞生長(zhǎng)曲線,并做相關(guān)統(tǒng)計(jì)學(xué)檢測(cè)。
1.2.3 RT-qPCR檢測(cè)let-7a及TGF-β1 mRNA表達(dá)水平:將各組貼壁細(xì)胞消化離心后,裂解,提取RNA并反轉(zhuǎn)錄為cDNA,將反轉(zhuǎn)錄所得的cDNA,采用SYBR Green嵌合熒光定量PCR法(按照日本Toyobo公司的RT-qPCR試劑盒說明書操作),以β-actin為內(nèi)參檢測(cè)細(xì)胞的TGF-β1含量,以U6為內(nèi)參檢測(cè)細(xì)胞let-7a的含量,引物序列見表1。mRNA相對(duì)定量的計(jì)算方法:首先用RT-qPCR得到的目的基因Ct值分別與其相對(duì)應(yīng)的內(nèi)參的Ct值相減進(jìn)行校正,得到目的基因的校正Ct值(ΔCt),再以空白對(duì)照組中的平均校正Ct值作為本底參數(shù),則目的基因的量:每個(gè)實(shí)驗(yàn)重復(fù)3次取平均值。

表1 各目的基因及內(nèi)參引物序列
1.2.4 Western blot檢測(cè)TGF-β1 蛋白表達(dá)水平:將轉(zhuǎn)染后的各組細(xì)胞溫箱培養(yǎng)48 h后,消化裂解收集細(xì)胞并在4 ℃以12 000 r/min離心10 min。收集總蛋白質(zhì),并通過BCA蛋白質(zhì)測(cè)定試劑盒測(cè)定蛋白質(zhì)濃度。將處理過的蛋白質(zhì)樣品進(jìn)行電泳電轉(zhuǎn)至PVDF膜上。用TBST緩沖液洗滌后,用5%脫脂乳將印跡完全封閉2 h,與TGF-β1和β-actin內(nèi)參抗體孵育。在4 ℃的振蕩器上過夜。將膜用TBST洗滌3次,并與HRP標(biāo)記的山羊抗兔二抗孵育2 h。將膜洗滌3次,并用ECL試劑盒顯現(xiàn)反應(yīng)條帶。使用Gel Image System ver分析數(shù)據(jù)。
1.2.5 細(xì)胞侵襲實(shí)驗(yàn):取Transwell小室置于24孔板后水化基質(zhì)膠,在下室中加入500 μL含15% FBS的DMEM培養(yǎng)基,將LS-174T細(xì)胞胰酶消化后,予無血清培養(yǎng)基對(duì)其混勻重懸5×105的細(xì)胞密度,取100 μL接種在24孔板的上室中。置于37 ℃、5% CO2細(xì)胞培養(yǎng)箱,孵育24 h,取出小室,吸掉培養(yǎng)液后用棉簽拭去上室內(nèi)未穿過基底層膜的細(xì)胞。將小室置于無水甲醇中固定20 min,再用0.1%結(jié)晶紫染色20 min,沖洗,晾干后倒置顯微鏡對(duì)Transwell小室隨機(jī)取10個(gè)不同視野進(jìn)行拍照保存,計(jì)算平均值進(jìn)行統(tǒng)計(jì)分析,繪制統(tǒng)計(jì)圖。
1.2.6 劃痕實(shí)驗(yàn):將LS-174T細(xì)胞以每孔5×105個(gè)細(xì)胞接種在6孔板中。溫室培養(yǎng)待細(xì)胞長(zhǎng)滿70%~80%后,予無血清的DMEM培養(yǎng)基饑餓處理12 h。通過用無菌移液管尖端進(jìn)行垂直劃痕并用PBS除去脫落的細(xì)胞來模擬傷口。細(xì)胞在37 ℃的恒溫下培養(yǎng)。36 h后測(cè)量。
1.3 統(tǒng)計(jì)學(xué)處理方法采用SPSS19.0統(tǒng)計(jì)軟件分析。計(jì)量資料以±s表示,多組比較采用單因素方差分析,組間兩兩比較方差齊者采用LSD-t檢驗(yàn),方差不齊者采用Dunnett’s T3檢驗(yàn)。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。

圖1 各組細(xì)胞轉(zhuǎn)染慢病毒48 h后倒置熒光顯微鏡觀察熒光表達(dá)情況(×40)
2 結(jié)果
2.1 倒置熒光顯微鏡觀察各組細(xì)胞轉(zhuǎn)染效果各組細(xì)胞48 h綠色熒光表達(dá)情況見圖1,C3組熒光表達(dá)最強(qiáng),感染效率可達(dá)90%以上,與初始病毒濃度成正相關(guān)(P<0.05)。
2.2 MTT法檢測(cè)各組細(xì)胞增殖活力各組OD值均隨時(shí)間延長(zhǎng)而增高,第1天,5組OD值差異無統(tǒng)計(jì)學(xué)意義(P>0.05),第2、第3、第4天,與A組比,C組的OD值增幅明顯降低(P<0.05),B組OD值與A組比差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。說明let-7a對(duì)細(xì)胞增殖活力有明顯抑制作用,且let-7a含量越高對(duì)細(xì)胞增殖抑制作用越強(qiáng),空病毒對(duì)細(xì)胞增殖無明顯影響。見圖2。
2.3 RT-qPCR檢測(cè)各組細(xì)胞let-7a及TGF-β1 mRNA表達(dá)水平與A組比較,C組細(xì)胞let-7a的表達(dá)水平均上調(diào);C組之間細(xì)胞let-7a的表達(dá)水平隨著病毒濃度的升高而逐漸升高,差異均有統(tǒng)計(jì)學(xué)意義(P<0.05);而B組let-7a的表達(dá)水平相與A組比差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。與A組比,C組TGF-β1 mRNA表達(dá)水平下調(diào),且與C組間病毒濃度呈負(fù)相關(guān),差異均有統(tǒng)計(jì)學(xué)意義(P<0.01),而B組TGF-β1 mRNA表達(dá)水平較A組差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。見圖3。
2.4 Western blot檢測(cè)TGF-β1蛋白表達(dá)水平C組細(xì)胞TGF-β1表達(dá)水平較A組降低(P<0.05);B組與A組TGF-β1表達(dá)水平差異無統(tǒng)計(jì)學(xué)意義(P>0.05),見圖4。

圖2 各組細(xì)胞生長(zhǎng)曲線

圖3 各組細(xì)胞中l(wèi)et-7a和TGF-β1 mRNA的表達(dá)水平
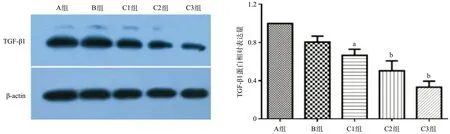
圖4 各組細(xì)胞TGF-β1蛋白相對(duì)表達(dá)量
2.5 Transwell侵襲實(shí)驗(yàn)檢測(cè)各組細(xì)胞侵襲能力C組細(xì)胞穿過濾膜數(shù)較A組均降低,差異有統(tǒng)計(jì)學(xué)意義(P <0.01),且轉(zhuǎn)染含let-7a慢病毒濃度越高穿過濾膜細(xì)胞數(shù)越少;A組與B組比,細(xì)胞穿過濾膜數(shù)差異無統(tǒng)計(jì)學(xué)意義(P>0.05),見圖5。
2.6 劃痕實(shí)驗(yàn)檢測(cè)各組細(xì)胞遷移能力C組細(xì)胞劃痕愈合率較A組降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);A組與B組比,細(xì)胞劃痕愈合率差異無統(tǒng)計(jì)學(xué)意義(P>0.05),見圖6。
3 討論
大腸黏液腺癌是一組起源于結(jié)直腸上皮組織,以黏液分泌異常亢進(jìn)為特征的惡性腫瘤,因其易浸潤(rùn)突破漿膜層和淋巴結(jié)轉(zhuǎn)移,容易發(fā)生腹膜種植轉(zhuǎn)移,預(yù)后較差。目前關(guān)于腹膜種植轉(zhuǎn)移的機(jī)制尚不十分清楚,目前的研究主要集中在癌細(xì)胞自身和腹膜的解剖生理功能及分子生物學(xué)機(jī)制,包括種子-土壤學(xué)說、乳斑學(xué)說。TGF是一種多功能的多肽類細(xì)胞因子,其中包括TGF-β、活性素、骨形態(tài)發(fā)生蛋白、生長(zhǎng)分化因子等[7],它們的氨基酸序列具有不同程度的同源性,其中TGF-β是一個(gè)相對(duì)分子質(zhì)量約為25 kDa的二聚體分子,有5個(gè)亞型(l~5),其中TGF-βl發(fā)揮最主要的作用,它可通過自分泌或旁分泌調(diào)節(jié)細(xì)胞活動(dòng),參與多種病理生理過程,對(duì)細(xì)胞的生長(zhǎng)、分化、黏附、侵襲及細(xì)胞外基質(zhì)的形成具有重要作用[8]。研究表明TGF-β可通過誘導(dǎo)腹膜纖維化,為種植轉(zhuǎn)移提供良好的土壤,誘導(dǎo)上皮間質(zhì)轉(zhuǎn)化、調(diào)節(jié)黏附相關(guān)分子、金屬蛋白酶的表達(dá)從而促進(jìn)細(xì)胞發(fā)生腹膜轉(zhuǎn)移[9-10]。所以我們認(rèn)為通過調(diào)控TGF-β1信號(hào)通路可以抑制大腸黏液腺癌腹膜轉(zhuǎn)移的發(fā)生發(fā)展。

圖5 Transwell顯示各組細(xì)胞遷移能力

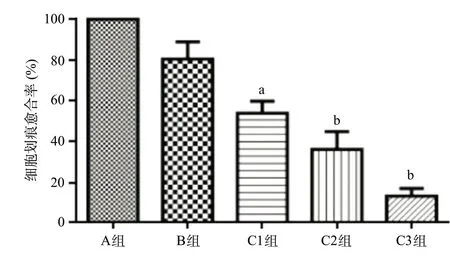
圖6 劃痕實(shí)驗(yàn)顯示各組細(xì)胞劃痕愈合率(×40)
近年來發(fā)現(xiàn),miRNA與腫瘤的發(fā)生發(fā)展密切相關(guān),let-7a基因的下調(diào)已被公認(rèn)為大腸癌發(fā)生發(fā)展中的關(guān)鍵事件,且已被證實(shí)是一個(gè)抑癌基因,研究發(fā)現(xiàn)它可通過調(diào)控c-myc、RAS和HMGA2下游靶基因抑制腫瘤細(xì)胞增殖、促進(jìn)凋亡[11],AKAO等[12]研究發(fā)現(xiàn),let-7a在結(jié)腸癌組織和細(xì)胞株中表達(dá)水平都有所下降,當(dāng)用let-7a-1轉(zhuǎn)染DLD-1結(jié)腸癌細(xì)胞株后,結(jié)腸癌細(xì)胞受到了明顯的生長(zhǎng)抑制,并且還發(fā)現(xiàn)轉(zhuǎn)染后,Ras和c-myc蛋白的表達(dá)水平明顯下降。本研究通過慢病毒載體介導(dǎo)攜帶人let-7a基因?qū)肴私Y(jié)腸黏液腺癌LS-174T細(xì)胞,熒光倒置顯微鏡觀察各組細(xì)胞48 h后綠色熒光表達(dá)情況,C3 感染組熒光表達(dá)最強(qiáng),感染效率可達(dá)90%以上,與初始病毒濃度成正相關(guān),表明慢病毒載體介導(dǎo)let-7a能成功、高效轉(zhuǎn)導(dǎo)入人結(jié)腸癌LS-174T細(xì)胞。MTT檢測(cè)結(jié)果顯示各組OD值均隨時(shí)間延長(zhǎng)而增高,在第1天,5組OD值無明顯差異,第2、第3、第4天,與空白對(duì)照組相比,轉(zhuǎn)染組的OD值增幅明顯降低,說明let-7a過表達(dá)對(duì)細(xì)胞增殖活力有明顯抑制作用,且let-7a含量越高對(duì)細(xì)胞增殖抑制作用越強(qiáng),空病毒對(duì)細(xì)胞增殖無明顯影響。熒光定量PCR檢測(cè)各組細(xì)胞let-7a mRNA表達(dá)水平,結(jié)果顯示與陰性對(duì)照組相比,轉(zhuǎn)染組let-7a mRNA的表達(dá)水平顯著升高,且轉(zhuǎn)染細(xì)胞let-7a的表達(dá)水平與含let-7a的慢病毒濃度梯度呈正相關(guān),陰性轉(zhuǎn)染組與未轉(zhuǎn)染組表達(dá)水平無明顯差異,實(shí)現(xiàn)了細(xì)胞內(nèi)let-7a不同表達(dá)水平的干預(yù)。進(jìn)一步結(jié)果發(fā)現(xiàn)let-7a高表達(dá)組即轉(zhuǎn)染組細(xì)胞增殖能力、遷移能力較未轉(zhuǎn)染組降低,且let-7a濃度越高降低程度越明顯,未轉(zhuǎn)染組與陰性對(duì)照組細(xì)胞增殖能力、遷移能力、侵襲能力無明顯差異,表明上調(diào)let-7a表達(dá)水平對(duì)LS-174T細(xì)胞增殖能力、遷移能力、侵襲能力有抑制作用,而空病毒對(duì)LS-174T細(xì)胞增殖及遷移侵襲能力無明顯影響。通過Western blot和RT-qPCR檢測(cè)TGF-β1蛋白及mRNA的表達(dá)水平,轉(zhuǎn)染組細(xì)胞內(nèi)TGF-β1 mRNA及蛋白表達(dá)水平較未轉(zhuǎn)染組均呈明顯下降趨勢(shì),未轉(zhuǎn)染組與陰性轉(zhuǎn)染組無明顯差異。TGF-β1表達(dá)水平同let-7a表達(dá)水平呈負(fù)相關(guān),進(jìn)而推測(cè)上調(diào)let-7a可能是通過下調(diào)TGF-β1表達(dá)水平而發(fā)揮抑制LS-174T細(xì)胞增殖活性及遷移侵襲能力,可能影響結(jié)腸癌腹膜種植轉(zhuǎn)移。
綜上所述,本研究初步探索了let-7a和TGF-β1在LS-174T細(xì)胞增殖、遷移及侵襲中的作用及其可能作用機(jī)制,結(jié)合實(shí)驗(yàn)結(jié)果,我們可以推測(cè)過表達(dá)的let-7a可明顯抑制細(xì)胞生長(zhǎng),可能通過TGF-β信號(hào)通路,抑制腫瘤細(xì)胞增殖、遷移和侵襲,從而抑制大腸黏液腺癌腹膜轉(zhuǎn)移的發(fā)生發(fā)展,但其具體分子通路、各個(gè)通路之間相互作用需進(jìn)一步深入研究。

