不同分子分型膀胱癌的臨床特征及預后
鄭榮魏,趙益華,黃偉,蔣旭敏,黃偉平
(1.樂清市人民醫院 泌尿外科,浙江 溫州 325600;2.溫州醫科大學附屬第一醫院 泌尿外科,浙江溫州 325015)
膀胱癌為臨床常見惡性腫瘤,2018 年統計數據顯示全球膀胱癌新增患者數為54.9393萬,死亡人數達19.9922萬,男性發病率高于女性,男女比例約為3:1[1]。膀胱癌嚴重威脅著人民的生命健康,其診治研究一直是學界關注的重點問題。近年來,隨著分子生物學的發展及各種生物檢測技術在臨床中的應用,從基因分子角度分析膀胱癌成為學界關注的熱點問題,從分子分型角度分析膀胱癌有望明確肌層浸潤性膀胱癌和非肌層浸潤性膀胱癌
的分子機制、預測患者對治療藥物的反應性、評估預后[2]。然而目前我國缺乏膀胱癌分子分型相關研究。細胞分裂周期相關因子3(cell division cycle associated protein 3,CDCA3)為SCF復合體(SKPl-CULl-F-BOX protein complex)的重要組成部分,能夠誘導細胞進入有絲分裂環節,并破壞有絲分裂的抑制酶[3]。王芹等[4]研究發現CDCA3 過表達會促進細胞周期DNA合成前期(G1)向DNA合成期(S)轉化,促進細胞增殖和分化,參與口腔癌的形成和發展。金鵬等[5]研究發現CDCA3 低表達可使非小細胞肺癌周期停止,進而提升化療敏感性,有助于優化患者的臨床治療效果。近年來有研究[6]證實腫瘤細胞中有CDCA3高表達現象,故CDCA3被視為細胞周期調節劑,其表達水平與惡性腫瘤的發生、發展有關。但是目前缺乏膀胱癌與CDCA3 關系的研究。因此,筆者認為有必要對CDCA3 分子分型與膀胱癌患者臨床特征及預后關系展開研究分析。
1 資料和方法
1.1 一般資料以美國癌癥基因組圖譜(the Cancer Genome Atlas,TCGA)數據庫為基礎,下載膀胱癌CDCA3 基因表達譜和相關病例的資料信息,數據庫網址為:“https://cancergenome.nih.gov”。共下載147例膀胱癌患者數據資料,其中男101例,女46例;年齡27~81歲,平均(58.7±6.9)歲。
篩選納入標準:①CDCA3檢測資料完整;②臨床相關資料數據完整;③完成3年隨訪,且隨訪數據完整。篩選排除標準:①臨床資料及相關檢查數據缺失;②未接受3年隨訪,或隨訪數據殘缺。
1.2 方法
1.2.1 CDCA3基因表達與膀胱癌臨床特征及預后關系分析:篩選下載的膀胱癌數據集GSE13507中的膀胱癌所有相關數據資料。將患者的CDCA3表達水平由低到高排列,確定CDCA3水平中位數,將低于中位數的樣本設置為CDCA3低表達組(74例),將高于中位數的樣本設置為CDCA3高表達組(73例),展開對比研究分析。
1.2.2 CDCA3 作用機制分析:進行基因集富集分析(gene set enrichment analysis,GSEA)[7],以GSEA3.0系統分析CDCA3表達對多種生物通路基因集造成的影響。應用默認加權富集統計分析方法,將GSEA網站數據庫中的相關基因集為對照基因集,置換500次。
1.3 觀察指標詳細記錄所有患者的臨床相關資料,包括性別、年齡、腫瘤數量、肌層浸潤情況、TNM分期、臨床分期、腫瘤轉移情況、腫瘤分化程度,并統計所有患者的3年隨訪情況,計算1年、3年復發率及病死率。對比不同CDCA3基因表達組患者的臨床病理特征、預后,分析CDCA3 表達與膀胱癌臨床特征及預后的關系。
1.4 統計學處理方法以SPSS23.0軟件對147例膀胱癌患者的數據進行分析。計量資料以±s 表示,2組間比較采用獨立樣本t 檢驗,計數資料采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 不同CDCA3 基因表達組患者臨床特征對比
CDCA3高表達組肌層浸潤患者比例、高級別T分期及N分期、腫瘤轉移患者比例均高于CDCA3 低表達組,而腫瘤分化程度低于CDCA3 低表達組,差異均有統計學意義(P<0.05)。詳見表1。
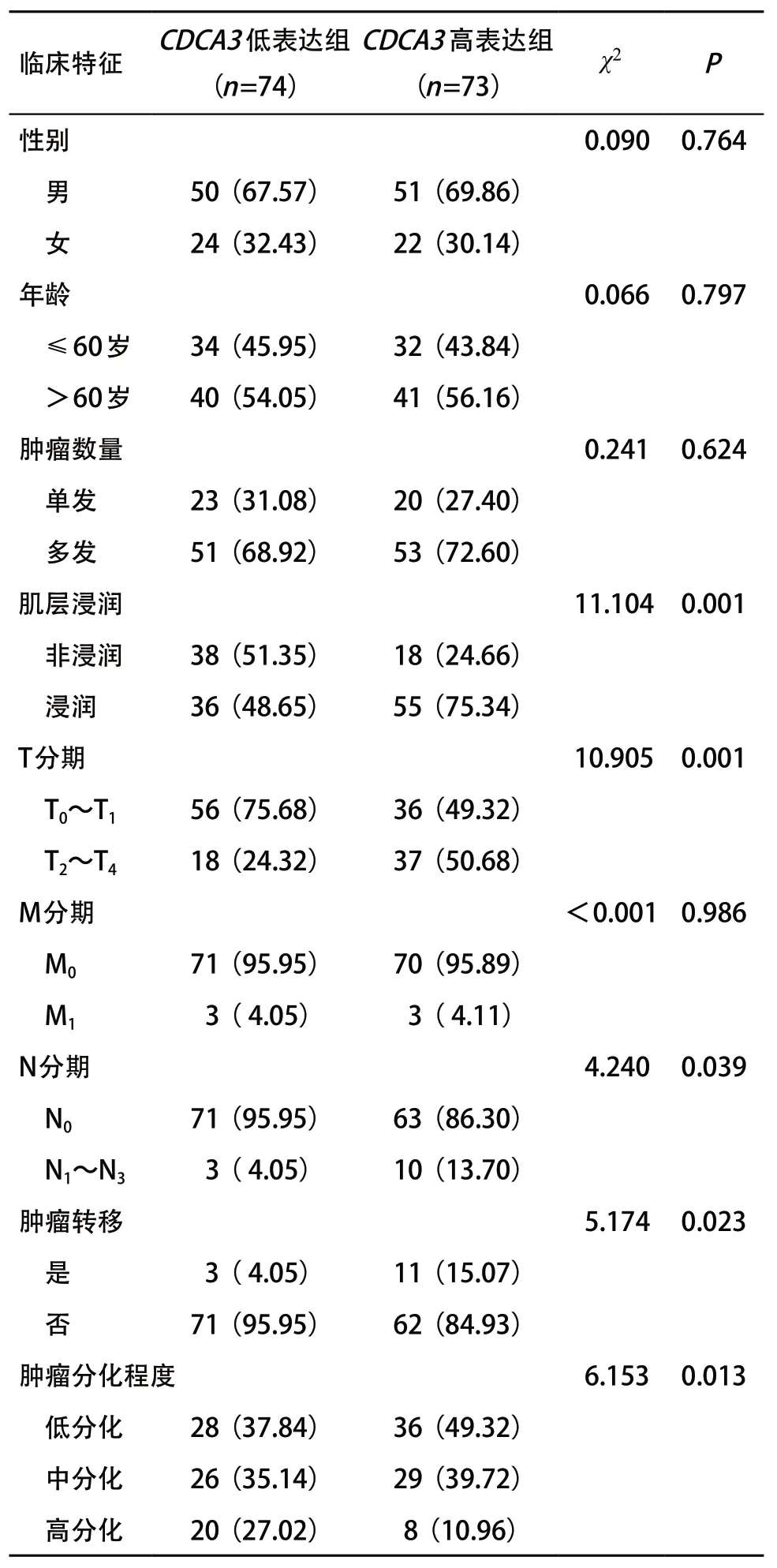
表1 不同CDCA3 基因表達組患者臨床特征對比[例(%)]
2.2 不同CDCA3基因表達組患者預后對比截止3年隨訪結束時,73例患者存活,總生存率為49.66%,CDCA3 低表達組患者的平均生存時間為(51.74±5.61)月;CDCA3 高表達組患者的平均生存時間為(41.01±2.36)月,高表達組患者的生存時間短于低表達組(t=12.912,P<0.001)。
2.2.1 復發率對比:CDCA3高表達組1年、3年復發率均高于CDCA3低表達組,差異均有統計學意義(P<0.05)。見表2。
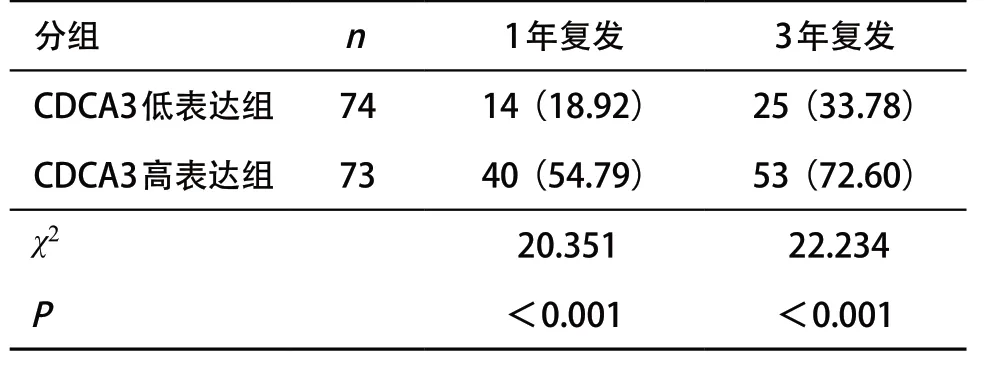
表2 不同CDCA3基因表達組患者復發情況對比[例(%)]
2.2.2 生存率對比:CDCA3高表達組1年、3年生存率均低于CDCA3低表達組,差異均有統計學意義(P<0.05)。見表3和圖1。
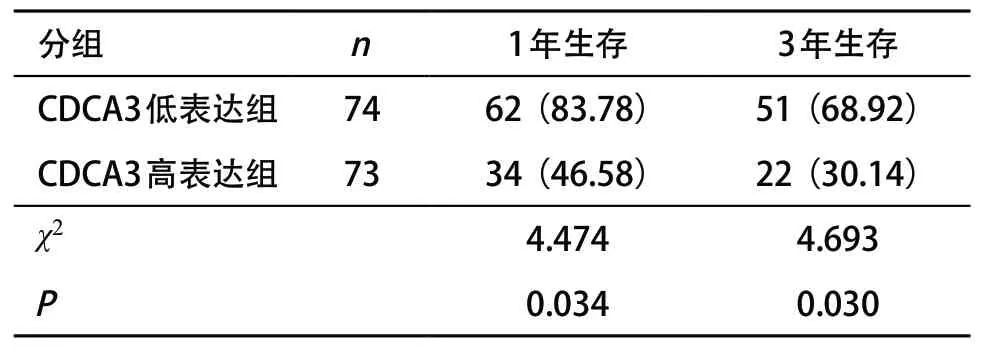
表3 不同CDCA3基因表達組患者生存情況對比[例(%)]
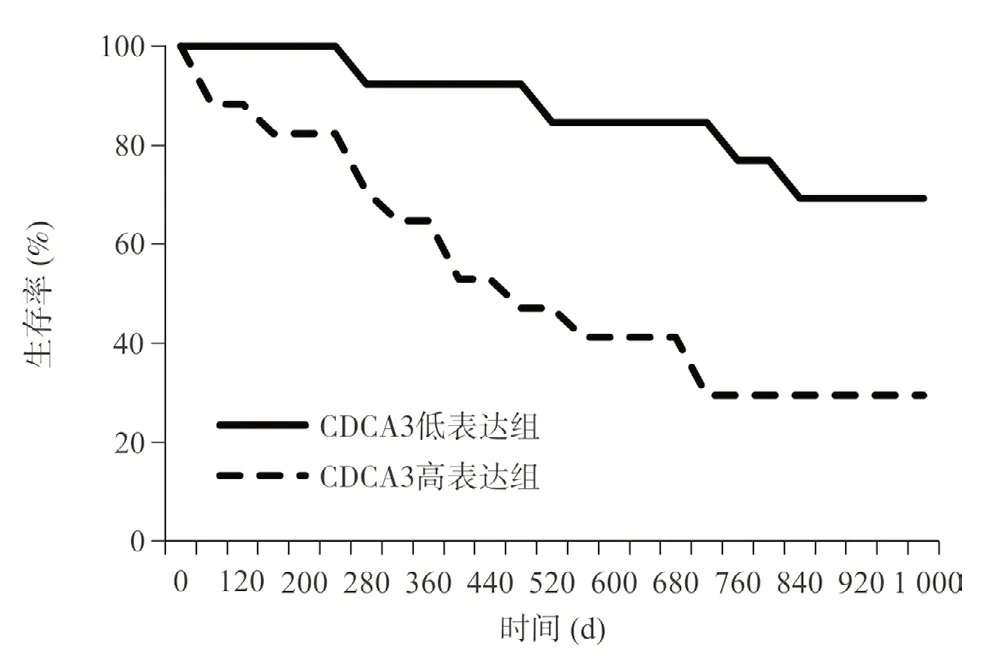
圖1 2組患者生存曲線
2.3 CDCA3推動膀胱癌發生與發展的機制分析應用GSEA對CDCA3對各種生物通路的影響進行分析,研究發現CDCA3高表達膀胱癌細胞中富集了G2M檢查點、糖酵解、E2F信號通路、MYC信號通路、MTOR信號通路、PTK通路、PI3K-AKT-mTOR信號通路、有絲分裂紡錘體、去折疊蛋白反應、膽固醇蛋白、精子發生等基因集,提示CDCA3 經上述基因集調控膀胱癌的發生及發展。見表4。
3 討論
隨著學界對膀胱癌認識的不斷加深,膀胱癌診斷、治療及預后評估均取得了一定成果,但是仍未有突破性的進展,其主要原因在于學界對膀胱癌的生物分子機制不清楚,缺乏分子分型分析,無法充分認識膀胱癌[8]。程卓夫等[9]在研究中指出,從腫瘤形態學、病理分級角度分析評估膀胱癌雖然能夠在一定程度上了解患者的發病情況,但無法了解膀胱癌的復雜生物學行為,有約36%的患者不能準確評估病情,導致一些患者無法得到切實有效的治療,有很高的復發、病死風險。楊金成等[10]研究認為,膀胱癌的發生及發展是一個復雜的生理過程,其中涉及多種分子通路作用,如在膀胱癌早期多有PTK通路激活參與,而腫瘤惡化發展過程中則有PI3KAKT-mTOR信號通路作用。諸多研究[11-12]均提示生物分子因素在膀胱癌發生及發展中發揮重要作用,其可能是肌層浸潤性膀胱癌的主要發生機制。然而目前關于膀胱癌的生物分子分型研究較少,對于膀胱癌分子分型與患者的臨床特征、預后的關系并不清楚。查閱國內外膀胱癌分子分型相關研究[13-16]發現目前學界對CDCA3與惡性腫瘤的關系問題較為關注,筆者認為CDCA3 可能是膀胱癌發生及發展的重要分子機制。基于此,筆者以147例有詳細臨床數據資料的膀胱癌患者為例,根據CDCA3 表達水平對患者進行分子分型,探究CDCA3 表達水平與膀胱癌臨床特征、預后的關系及其作用機制。
CDCA3為SCF復合體的一個組成部分,被公認為細胞周期調節劑,在腫瘤發生及發展過程中發揮重要作用[17]。項陽[18]以腫瘤生物信息分析證實CDCA3 為致癌基因的驅動基因,其能夠通過調控C-末端結構域磷酸酶1(small C-terminal domain phosphatase 1,SCP1)和其周圍細胞周期的關系發揮作用,調控腫瘤的發生及發展。BI等[19]則在研究中發現CDCA3能夠經HoxB3綁定而激活,促進腫瘤發展惡化。本研究中發現CDCA3高表達組肌層浸潤患者比例、T分期和N分期均明顯高于CDCA3低表達組,而腫瘤分化程度低于CDCA3低表達組(P<0.05),也提示CDCA3 表達水平與膀胱癌的惡性程度有關,隨著CDCA3表達水平的升高其惡性程度也隨之升高。另外本研究也發現CDCA3高表達組患者的轉移風險更高,這與何恒晶等[6]的研究結果一致。在CDCA3與膀胱癌預后關系分析中發現CDCA3高表達會增加預后不良風險,患者的復發及病死風險更高。提示CDCA3 基因表達會對患者的生存期造成影響,也表明可以通過CDCA3檢測評估患者的預后。將本研究結果與以往研究資料進行綜合分析可以發現CDCA3基因表達與膀胱癌臨床特點及預后關系密切,CDCA3高表達往往提示腫瘤惡性程度高、轉移風險高、預后狀況差,患者的總生存期短。因此,臨床中可以通過CDCA3 檢測對膀胱癌患者進行診斷、評估。
進一步對膀胱癌患者CDCA3高表達作用機制進行分析發現其與G2M檢查點、糖酵解、E2F信號通路、MYC信號通路、MTOR信號通路、PTK通路、PI3K-AKTmTOR信號通路、有絲分裂紡錘體、去折疊蛋白反應、膽固醇蛋白、精子發生等基因集有關,CDCA3可能通過調控上述通路刺激腫瘤細胞增殖、分化,促進膀胱癌發生及發展。然而目前尚缺乏關于多種基因通路與膀胱癌的關系研究,因此對于CDCA3 的具體作用機制并不清楚。
綜上,CDCA3的表達水平與膀胱癌患者的臨床特征、預后情況密切相關,CDCA3高表達患者的TNM分期、臨床分期往往較高,而腫瘤分化程度多較低,且多伴有肌層浸潤、腫瘤轉移,其惡性程度高于CDCA3低表達患者,而預后質量也往往更差,患者有很高的復發及死亡風險。而CDCA3高表達作用機制的發揮與G2M檢查點、糖酵解、E2F信號通路、MYC信號通路、MTOR信號通路、PTK通路、PI3K-AKT-mTOR信號通路、有絲分裂紡錘體、去折疊蛋白反應、膽固醇蛋白、精子發生等基因集的調控有關。由此判斷CDCA3 可能是膀胱癌的又一生物標志物,有望成為膀胱癌臨床診斷、預后評估標志物及治療新靶點。

