大蒜中有機硫化合物及其分析方法
翁瑞,盛曉婧,劉平香,張繼光,邱靜,錢永忠
大蒜中有機硫化合物及其分析方法
翁瑞1,盛曉婧2,劉平香1,張繼光2,邱靜1,錢永忠1
(1中國農(nóng)業(yè)科學院農(nóng)業(yè)質(zhì)量標準與檢測技術研究所/農(nóng)業(yè)農(nóng)村部農(nóng)產(chǎn)品質(zhì)量安全重點實驗室,北京 100081;2中國農(nóng)業(yè)科學院煙草研究所/ 農(nóng)業(yè)農(nóng)村部煙草質(zhì)量安全風險評估實驗室,山東青島 266101)
大蒜是在我國廣泛種植和食用的農(nóng)產(chǎn)品,具有抗菌、抗炎、抗氧化等多種營養(yǎng)健康功能。這些主要得益于大蒜中的有機硫化合物,包括蒜氨酸等風味前體化合物、大蒜素等硫代亞磺酸酯和大蒜烯等硫醚類揮發(fā)性化合物等。這些有機硫化合物或各自具有其生物活性,或多種化合物相互協(xié)同,共同產(chǎn)生同一種生理功效。但有機硫化合物普遍具有易酶解或穩(wěn)定性差等特點,且不同類別有機硫化合物的化學性質(zhì)差異也較大,目前對大蒜中有機硫化合物的分析方法仍然存在局限性,現(xiàn)有報道多是對某類化合物進行總量測定,或是針對個別化合物進行測定,尚未有研究對大蒜中的有機硫化合物進行全面系統(tǒng)的分析。因此,本研究分別對大蒜中主要風味前體化合物、硫代亞磺酸酯和硫醚類揮發(fā)性化合物的分析方法進行了分類討論和綜述,包括其樣品前處理方法和檢測方法。
大蒜;有機硫化合物;分析方法;特征性營養(yǎng)成分
1 大蒜中有機硫化物
大蒜(L)是在我國廣泛種植的食用農(nóng)產(chǎn)品,因其抗癌功效[1-2]等健康益處受到大眾的喜愛。研究表明,大蒜可顯著降低膽固醇水平、抑制血小板聚集、降低血壓,從而顯著降低心腦血管疾病的患病幾率,此外還具有抗菌抗炎[3]、抗氧化[4]等多種功效。這些營養(yǎng)功效主要得益于大蒜中的有機硫化合物(Organic sulfur compounds)。其中,大蒜素可顯著降低生物體內(nèi)活性氧含量,表現(xiàn)出抗氧化能力[5],并且能夠與細菌生長所必需的半胱氨酸的巰基結合,破壞細菌的蛋白質(zhì)代謝過程,具有較強的抗菌、抗病毒、消炎作用[6];蒜氨酸可抑制糖尿病并發(fā)癥的發(fā)生[7];S-烯丙基-L-半胱氨酸具有抗氧化和自由基清除作用,可以清除過氧化氫,抑制低密度脂蛋白氧化,減少氧化性低密度脂蛋白誘導的細胞損傷[8]。大蒜中的有機硫化合物各自具有其生物活性,或多種有機硫化合物相互協(xié)同,產(chǎn)生同一種生理功效[9]。
有機硫化合物是大蒜等蔥屬植物的特征性營養(yǎng)品質(zhì)成分,尤其大蒜被公認是有機硫化合物含量最豐富的食物。大蒜中有機硫化合物主要包括風味前體化合物、硫代亞磺酸酯(TS)和硫醚類揮發(fā)性有機硫化合物(表1)。其中,完整的大蒜鱗莖中的有機硫化合物主要是含硫氨基酸,包括半胱氨酸、少量的蛋氨酸、γ-谷氨酰肽(γ-GP)和S-烷(烯)基半胱氨酸亞砜(ACSO)等。細胞中的ACSO與蒜氨酸酶被液泡膜隔開,當鱗莖組織被破壞時,細胞質(zhì)中的ACSO會在液泡中蒜氨酸酶的催化作用下水解生成TS。此過程反應迅速,在36—40℃下的大蒜水溶液中ACSO可立即水解,反應時間僅為5—20 s[10]。TS化學性質(zhì)極不穩(wěn)定,在不同溫度、pH等環(huán)境下可反應生成大蒜烯、烯丙基硫醚、乙烯二噻烯等揮發(fā)性有機硫化合物,形成大蒜獨特的辛辣氣味。研究表明,當大蒜素在20℃下暴露20 min時,會轉化為66%的二烯丙基二硫化物(DADS)、14%的二烯丙基一硫化物DAS、9%的二烯丙基三硫化物(DATS)和二氧化硫等[11]。除上述代謝路徑外,γ-GP還可代謝為S-烯丙基半胱氨酸(SAC)、S-烯丙基巰基-L-半胱氨酸等[12]。大蒜中有機硫化合物的代謝路徑如圖1所示。
有機硫化合物極不穩(wěn)定,且不同類別有機硫化合物的化學性質(zhì)差異較大,因此,目前對大蒜中有機硫化合物的分析方法仍然存在局限性,尚未有研究對大蒜中的有機硫化合物進行全面系統(tǒng)的分析。
2 主要硫化物的分析方法
2.1 風味前體化合物
完整大蒜中含量較高的風味前體化合物包括蒜氨酸、γ-L-谷氨酰-S-(反-丙烯基)-L-半胱氨酸(GSPC)、γ-L-谷氨酰-S-烯丙基-L-半胱氨酸(GSAC)等,其含量分別為20.84—45.60 mg?g-1、30.04—42.34 mg?g-1和18.95—26.49 mg?g-1;γ-L-谷氨酰-S-甲基-L-半胱氨酸(GSMC)、甲基蒜氨酸、環(huán)蒜氨酸和異蒜氨酸含量次之,含量均低于5 mg?g-1(干重)[13]。S-烯丙基-L-半胱氨酸(SAC)、S-甲基-L-半胱氨酸(SMC)和S-(反-丙烯基)-L-半胱氨酸(SPC)在剛收獲大蒜中含量較低,但在發(fā)酵等加工過程中其含量會大幅升高[14]。大蒜中風味前體化合物的組成受到大蒜品種、生長環(huán)境、硫肥、采收條件等多種因素的影響[15]。
針對大蒜中風味前體化合物分析的研究工作主要有兩個主流思路。一是通過對TS、丙酮酸、氨等下游代謝產(chǎn)物的檢測間接獲得風味前體化合物的含量,尤其以間接測定丙酮酸為主。當大蒜組織被破壞時,風味前體化合物在蒜氨酸酶的作用下生成TS時,伴隨有丙酮酸的產(chǎn)生,因此大蒜中丙酮酸的含量與風味前體化合物含量呈正相關關系[16]。丙酮酸測定最常用的方法是SCHWIMMER和WESTON于1961年提出的分光光度法[17],當向大蒜提取溶液中加入過量的2,4-二硝基苯肼時,2,4-二硝基苯肼會與丙酮酸的羰基發(fā)生特征反應,并在420 nm下產(chǎn)生顯色反應。但此方法測定的是大蒜中的丙酮酸總量,包括蒜氨酸酶作用下生成的丙酮酸及大蒜組織經(jīng)由三羧酸循環(huán)產(chǎn)生的內(nèi)源性丙酮酸。在大蒜中,內(nèi)源性丙酮酸含量通常只占到2%左右[18],所以在通過測定丙酮酸間接推斷ACSO含量時,通常可忽略內(nèi)源性丙酮酸。此間接測定方法較簡單,但無法獲得風味前體化合物的輪廓信息;而且鑒于環(huán)蒜氨酸不會在蒜氨酸酶的作用下轉化成為大蒜素,因此測定丙酮酸無法獲得環(huán)蒜氨酸的含量信息。
另一種是對大蒜中蒜氨酸酶活性進行抑制后,直接對被破壞大蒜組織中的風味前體化合物進行檢測分析。大蒜中的蒜氨酸酶有兩種,反應底物分別為蒜氨酸、異蒜氨酸(最適pH為4.5)和甲基蒜氨酸(最適pH為6.5)。研究發(fā)現(xiàn),在pH 1.5—3(胃中消化液pH)條件下,蒜氨酸酶會發(fā)生不可逆的失活[19]。因此,可采用酸抑制法,即通過加入一定量的酸調(diào)節(jié)溶液(pH<3)抑制蒜氨酸酶的活性[13],甲醇-水-甲酸(50﹕50﹕1,v/v/v)溶液體系即可充分抑制蒜氨酸酶的活性[20]。除酸抑制法外,鑒于蒜氨酸酶為蛋白酶,能夠使蛋白質(zhì)變性的因素也可導致蒜氨酸酶失活。一是熱力滅酶法應用較為普遍,包括將未剝皮大蒜放入沸水中煮7 min的煮沸法[14]和將剝皮大蒜直接加熱20 min[21]的直接加熱法。二是冷凍處理法,將大蒜直接放入液氮中保存[22]。三是微波法,先將大蒜放入水中,再進行微波加熱[23]。陳倩娟等[24]發(fā)現(xiàn),在300 kW功率下微波3 min時,蒜氨酸酶的抑制效果最好。四是有機試劑處理法,一般使用90%的乙醇溶液處理30 min,液料比為4﹕1時效果最好[24]。五是酶抑制劑法,使用羥甲氧基胺半鹽酸鹽[25]或K+、Mg2+、Cu2+等金屬離子[26]均可抑制蒜氨酸酶的活性。

表1 大蒜中的有機硫化合物
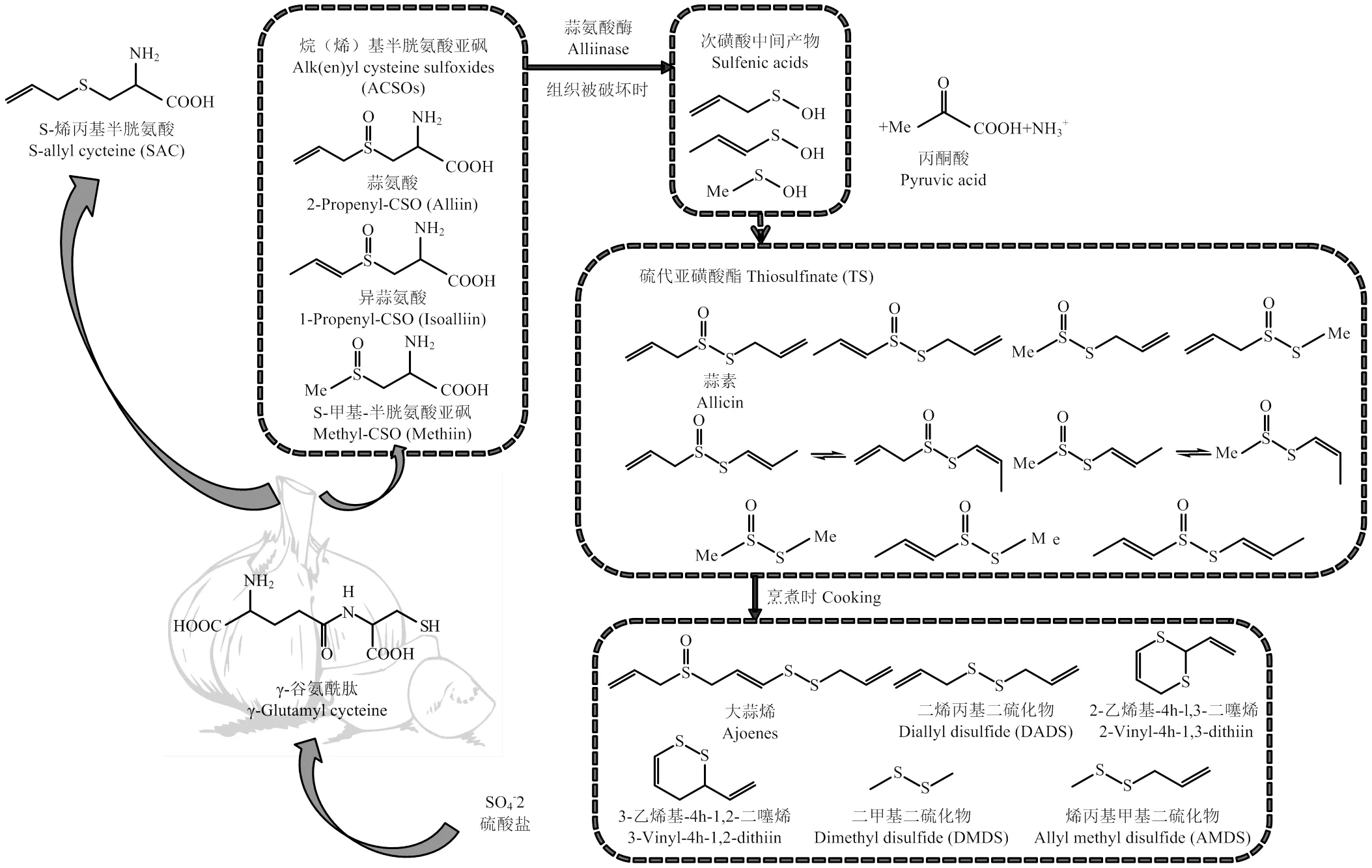
圖1 大蒜中含硫化合物的合成及轉化途徑
分析方法中,最早應用于檢測大蒜中風味前體化合物的是薄層色譜法[27]。受限于較差的分離和定量能力,高效液相色譜(HPLC)與紫外或熒光檢測聯(lián)用技術漸漸取代了薄層色譜法,成為風味前體化合物分析中的主流方法。傳統(tǒng)的HPLC方法大多需要繁雜的凈化步驟,或使用鄰苯二甲醛、叔丁基硫醇[10,28]、芴甲基氯甲酸酯[29]、丹磺酰氯[30]、異硫氰酸苯酯[31]等對風味前體化合物進行柱前衍生化,以除去樣品基質(zhì)的干擾。衍生化反應還可大幅提高風味前體化合物的消光系數(shù),顯著提高檢測靈敏度。除衍生化方法外,ARNAULT等[32]還使用庚烷磺酸為離子對試劑,在超低pH下實現(xiàn)了對蒜氨酸和保留行為更強的二肽的分離,并將此方法應用于對SAC、蒜氨酸和大蒜素的分析,但此方法無法對異蒜氨酸和S-甲基-L-半胱氨酸亞砜進行分析。
盡管HPLC方法可以實現(xiàn)風味前體化合物高準確性、高重復性的檢測分析,其分辨能力仍然有限,很難實現(xiàn)對痕量蒜氨酸類似物的分析,尤其是非對映異構體。基于此考慮,Keusgen等[27]通過將蒜氨酸酶固定在電極上,對風味前體化合物進行生物傳感檢測,簡化了HPLC方法中的柱前衍生化及分離步驟,可實現(xiàn)對大蒜相關樣品的高通量分析。MIRON等[33]基于蒜氨酸與2-硝基-5-硫代苯甲酸酯[34]及蒜氨酸和大蒜素與4-巰基吡啶的反應建立了檢測大蒜中蒜氨酸、大蒜素及蒜氨酸酶活性的分光光度法。HORIE等[23]使用毛細管電泳技術對蒜氨酸、S-甲基半胱氨酸亞砜和丙酮酸進行了分析,KUBEC等[35]使用芴甲基氯甲酸酯對風味前體化合物衍生化后使用膠束電動毛細管色譜對其進行了測定。ZHU等[36]和KIM等[14]通過液相色譜串聯(lián)質(zhì)譜(LC-MS/MS)的多重反應檢測模式(MRM),不需要進行衍生化等繁瑣的前處理過程,也最大程度地避免了基質(zhì)效應。此外,氣相色譜(GC)因其高靈敏度和分辨率,也被應用于大蒜中風味前體化合物的分析。但ACSO熱穩(wěn)定性較差,而GC分析通常伴隨高溫,且使用GC進行分析時通常需要進行衍生化,操作繁瑣,因此,使用GC對大蒜中風味前體化合物進行分析一直備受爭議,也并未得到廣泛應用。
2.2 硫代亞磺酸酯
存在于大蒜完整鱗莖細胞質(zhì)中的非揮發(fā)性風味前體化合物在大蒜組織被破壞(如咀嚼、粉碎等)時,會在蒜氨酸酶的作用下轉化為化學性質(zhì)極不穩(wěn)定的次磺酸中間產(chǎn)物,隨后迅速代謝為TS。大蒜中的TS主要為二烯丙基硫代亞磺酸酯(大蒜素),含量為1.48—5.32 mg?g-1;烯丙基甲基硫代亞磺酸酯(AMThs)含量次之,為0.97—2.67 mg?g-1;烯丙基(反-丙烯基)硫代亞磺酸酯(ATPThs)含量較低,為0.16—0.44 mg?g-1(鮮重)[37]。
TS為水溶性化合物,因此可直接使用水溶液對其進行提取。除此之外,也有研究使用甲醇[32]、二氯甲烷[38]等進行提取。近些年來,因為“環(huán)境友好”理念的普及,固相微萃取[39]、分散液液微萃取[40]、超臨界流體萃取[41]等方法也逐漸得到應用,尤其超臨界流體萃取法。所謂超臨界流體是溫度、壓力在其臨界狀態(tài)以上的流體狀態(tài),此時的黏度和擴散系數(shù)接近氣體,而密度和溶劑化能力接近液體。由于有機硫化合物在有機溶劑中仍具有較高的反應活性,而超臨界流體萃取過程中沒有有機溶劑的參與,并且始終與氧氣和高溫環(huán)境隔絕,因此可有效降低大蒜中有機硫化合物的氧化和分解。
大蒜素是大蒜中最典型的一類TS,約占TS總量的70%—80%,它也被認為是表征大蒜營養(yǎng)品質(zhì)的關鍵性指標。根據(jù)英國藥典記載,當且僅當蒜粉中大蒜素含量超過4.5 mg?g-1時,蒜粉才能表現(xiàn)出應有的生物活性[42]。但大蒜素的半衰期受濃度、溫度和貯存溶劑影響極大,非常不穩(wěn)定[43],因此分析難度也較大。
CAVALLITO等[44]通過甲醇提取后,第一次分離和表征了大蒜中的大蒜素。隨后FREEMAN等[45]使用前文所說的間接測定方法,通過分析檢測丙酮酸間接獲得了TS的含量,MIRON等[34]通過TS和二硫代二硝基苯甲酸的顯色反應測定了TS的總量。但這些方法都只能獲得TS的總含量,無法獲得各TS化合物的指紋信息。考慮到色譜方法的高分辨率,GC方法開始逐漸應用于對大蒜中TS的分析。但在1964年,BERNHARD等[46]指出,使用GC測定得到的化合物很多都是因高溫導致的非真實信息,隨后BRODNITZ等[11]使用氣相色譜-質(zhì)譜(GC-MS)技術建立了大蒜提取物中大蒜素的檢測分析方法,論證了大蒜素在高溫下的分解轉化現(xiàn)象,證實了這一結論。因此,盡管GC方法具有出色的定性定量能力和分辨率,仍不適用于大蒜素等熱不穩(wěn)定化合物的分析。為了規(guī)避GC導致的熱分解,研究興趣漸漸轉向HPLC方法,通過正相和反相HPLC對大蒜提取物[37]、加工產(chǎn)品[47]以及血液等生物樣品[40]中的大蒜素等TS進行分析,BOCCHINI等[48]將反相HPLC和柱后光化學反應器聯(lián)用,不僅提高了檢測的選擇性和靈敏度,也大幅提高了回收率。此外,RITOTA等[49]還利用高分辨魔角旋轉核磁共振技術(HRMAS-NMR)分析了意大利不同地區(qū)白皮蒜和紫皮蒜中糖類、有機酸、脂肪酸、多不飽和脂肪酸及有機硫化合物等的含量,將組學的技術應用到大蒜的溯源中,并采用固相微萃取(SPME)和GC-MS技術對大蒜中的大蒜素等TS類有機硫化合物進行了確證性檢測。
2.3 硫醚類揮發(fā)性有機硫化合物
目前已有大量研究報道了大蒜烯、烯丙基硫醚、乙烯二噻烯等硫醚類揮發(fā)性有機硫化合物的提取方法,其中最早使用的是蒸餾法,包括蒸汽蒸餾、水蒸餾、微波輔助蒸餾等。但盡管大蒜烯、烯丙基硫醚、乙烯二噻烯等揮發(fā)性有機硫化合物相較于TS化學穩(wěn)定性具有很大改善,但對溫度仍具有敏感性,在蒸餾操作中若遇到高溫,仍會分解,導致不真實信息的產(chǎn)生。因此,溶劑萃取法開始得到應用。鑒于揮發(fā)性有機硫化合物大都具有極弱的極性,使用溶劑通常為正己烷[50]、二氯甲烷[51]等。但此方法較為費時且需要消耗大量有機溶劑,因此近些年研究重心漸漸轉向固相微萃取、分散液液微萃取、超臨界流體萃取、低溫冷阱萃取等[39-40,52]。
大蒜中硫醚類揮發(fā)性有機硫化合物的定量檢測目前主要采用HPLC方法[53]。LOCATELLI等[39]研究發(fā)現(xiàn),采用SPME-GC和SPME-HPLC-UV檢測同一個大蒜油樣品中的DAS、DADS和DATS含量,會有不同的相對定量結果,GC檢測結果表明,DADS占總含量的80%以上,DAS約占10%,DATS含量較低;而HPLC檢測結果表明,DADS和DATS分別占到了總含量的50%和40%以上,DAS含量較低。究其原因,可能是由于DADS耐熱性較差,GC檢測過程中溫度相對較高,從而使其發(fā)生轉化所引起,因此,常規(guī)的GC及其質(zhì)譜聯(lián)用技術并不適合該類物質(zhì)的檢測。ABU-LAFI等[54]采用“低溫”GC-MS及柱頭進樣和HPLC技術研究了新鮮大蒜中低溫提取物的成分,發(fā)現(xiàn)主要有2-乙烯基-4H-l,3-二噻烯、3-乙烯基-4H-1,2-二噻烯和二苯基二硫化物3種含硫化合物,而在高溫水浴(100℃)條件下的大蒜提取物中,該類化合物會被分解為其他揮發(fā)性含硫化合物。除色譜方法外,KIMBARIS等[55]也采用傅立葉變換拉曼光譜技術實現(xiàn)了大蒜中二甲基二硫醚等多種有機硫化合物的快速、簡單、無損檢測。
3 小結與展望
大蒜是一種具有多種營養(yǎng)和藥用作用的食用農(nóng)產(chǎn)品,它的多種功效主要歸功于其含有的有機硫化合物,因此,對大蒜中有機硫化合物的分析至關重要。但大蒜中各類有機硫化合物的分析幾乎都面臨著化合物化學性質(zhì)不穩(wěn)定、易氧化、易降解的問題,因此未來仍需大力開發(fā)低溫、無損型的樣品前處理方法和檢測方法,例如超臨界流體萃取前處理方法、大氣壓離子化質(zhì)譜檢測方法等。
此外,受限于穩(wěn)定性,有機硫化合物的標準品極不易獲得,大多需要專門進行合成,且合成后的儲存時間也極為有限。目前針對大蒜中有機硫化合物分析的報道大多僅是對大蒜及相關產(chǎn)品中的風味前體化合物、TS等進行總量的測定,或是對個別化合物進行分析,并未對大蒜中有機硫化合物進行系統(tǒng)分析和研究。為全面評價大蒜質(zhì)量品質(zhì)水平,可通過組學技術對大蒜中的有機硫化合物進行分析。代謝組是自基因組、轉錄組和蛋白組之后發(fā)展起來的系統(tǒng)生物學的重要研究平臺,已開始應用于農(nóng)產(chǎn)品的諸多方面,包括產(chǎn)地溯源、真?zhèn)舞b別、功能基因鑒定、途徑解析以及農(nóng)產(chǎn)品在種植、貯存運輸過程中的監(jiān)控等。它相比基因組、轉錄組和蛋白組更接近生物體表型,基因組等的微小改變也可在代謝組層面得以體現(xiàn)和放大。因此,基于代謝組學分析大蒜中有機硫化合物的代謝輪廓是將來的一個研究方向。
[1] SHUKLA Y, KALRA N. Cancer chemoprevention with garlic and its constituents., 2007, 247(2): 167-181.
[2] KHANUM F, ANILAKUMAR K R, VISWANATHAN K R. Anticarcinagenic properties of garlic: A review., 2004, 44(6): 479-488.
[3] LANZOTTI V, SCALA F, BONANOMI G. Compounds from Allium species with cytotoxic and antimicrobial activity., 2014, 13(4): 769-791.
[4] FRATIANNI F, OMBRA M N, COZZOLINO A, RICCARDI R, SPIGNO P, TREMONTE P, COPPOLA R, NAZZARO F. Phenolic constituents, antioxidant, antimicrobial and anti-proliferative activities of different endemic Italian varieties of garlic (L.)., 2016, 21: 240-248.
[5] LIU C, CAO F, TANG Q Z, YAN L, DONG Y G, ZHU L H, WANG L, BIAN Z Y, LI H L. Allicin protects against cardiac hypertrophy and fibrosis via attenuating reactive oxygen species-dependent signaling pathways., 2010, 21(12): 1238-1250.
[6] LAWAL B, SHITTU O K, OIBIOKPA F I, MOHAMMED H, UMAR S I, HARUNA G M. Antimicrobial evaluation, acute and sub-acute toxicity studies of., 2016, 5(4): 296-301.
[7] ANWAR S, YOUNUS H. Inhibitory effect of alliin fromon the glycation of superoxide dismutase., 2017, 103: 182-193.
[8] BANERJEE S K, MUKHERJEE P K, MAULIK S K. Garlic as an antioxidant: The good, the bad and the ugly., 2003, 17(2): 97-106.
[9] RIVLIN R S, BUDOFF M, AMAGASE H. Significance of garlic and its constituents in cancer and cardiovascular disease., 2006, 136(3): V.
[10] KREST I, GLODEK J, KEUSGEN M. Cysteine sulfoxides and alliinase activity of somespecies., 2000, 48(8): 3753-3760.
[11] BRODNITZ M H, PASCALE J V, VAN DERSLICE L. Flavor components of garlic extract., 1971, 19: 273-275.
[12] RAMIREZ D A, LOCATELLI D A, GONZáLEZ R E, CAVAGNARO P F, CAMARGO A B. Analytical methods for bioactive sulfur compounds in: An integrated review and future directions., 2017, 61: 4-19.
[13] MONTANO A, BEATO V M, MANSILLA F, ORGAZ F. Effect of genetic characteristics and environmental factors on organosulfur compounds in garlic (L.) grown in Andalusia, Spain., 2011, 59(4): 1301-1307.
[14] KIM S, PARK S L, LEE S, LEE S Y, KO S, YOO M. UPLC/ ESI-MS/MS analysis of compositional changes for organosulfur compounds in garlic (L.) during fermentation., 2016, 211: 555-559. doi: 10.1016/j.foodchem.2016.05.102
[15] DIRIBA-SHIFERAW G, NIGUSSIE-DECHASSA R, KEBEDE W, J. S J, GETACHEW T. Bulb quality of garlic (L.) as influenced by the application of inorganic fertilizers., 2014, 9(8): 784-796.
[16] GONZáLEZ R E, SOTO V C, SANCE M M, CAMARGO A B, GALMARINI C R. Variability of solids, organosulfur compounds, pungency and health-enhancing traits in garlic (L.) cultivars belonging to different ecophysiological groups., 2009, 57(21): 10282-10288.
[17] SCHWIMMER S, WESTON W J. Enzymatic development of pyruvic acid in onion as a measure of pungency., 1961, 9: 301-304.
[18] CAVAGNARO P F, CAMARGO A, GALMARINI C R, SIMON P W. Effect of cooking on garlic (L.) antiplatelet activity and thiosulfinates content., 2007, 55(4): 1280-1288.
[19] BLOCK E. The organosulfur chemistry of the genus allium – Implications for the organic chemistry of sulfur., 1992, 31(9): 1135-1178.
[20] YAMAZAKI Y, IWASAKI K, MIKAMI M, YAGIHASHI A. Distribution of eleven flavor precursors, s-alk(en)yl-l-cysteine derivatives, in seven Allium vegetables., 2011, 17(1): 55-62.
[21] ZHANG M, LEI N, ZHU T Z, ZHANG Z S. Thermal processing effects on the chemical constituent and antioxidant activity of s-alk(en)ylcysteine s-oxides (alliin) extract., 2013, 51(1): 309-313.
[22] NASIM S A, DHIR B, SAMAR F, RASHMI K, MAHMOODUZZAFAR, MUJIB A. Sulphur treatment alters the therapeutic potency of alliin obtained from garlic leaf extract., 2009, 47(4): 888-892.
[23] HORIE H, YAMASHITA K. Non-derivatized analysis of methiin and alliin in vegetables by capillary electrophoresis., 2006, 1132(1-2): 337-339.
[24] 陳倩娟, 張民, 劉玉柱, 秦培軍. 蒜氨酸酶滅活方法研究. 食品科技, 2009, 34(6): 228-231.
CHEN Q J, ZHANG M, LIU Y Z, QIN P J. Study on inactivated enzyme methods of alliinase in garlic., 2009, 34(6): 228-231. (in Chinese)
[25] HRBEK V, REKTORISOVA M, CHMELAROVA H, OVESNA J, HAJSLOVA J. Authenticity assessment of garlic using a metabolomic approach based on high resolution mass spectrometry., 2018, 67: 19-28.
[26] 莫英杰, 王靜, 孫寶國, 曹雁平. 超聲波條件下蒜氨酸酶性質(zhì)研究. 中國食品學報, 2010, 10(1): 61-66.
MO Y, WANG J, SUN B, CAO Y. Effect of ultrasound on property of alliinase., 2010, 10(1): 61-66. (in Chinese)
[27] KEUSGEN M. TLC analysis ofconstituents., 1997, 63(1): 93-94.
[28] DORAN J A, O'DONNELL J S, LAIRSON L L, MCDONALD M R, SCHWAN A L, GRODZINSKI B. S-alk(en)yl-L-cysteine sulfoxides and relative pungency measurements of photosynthetic and nonphotosynthetic tissues of., 2007, 55(20): 8243-8250.
[29] THOMAS D J, PARKIN K L. Quantification of alk(en)yl-L-cysteine sulfoxides and related amino acids in alliums by high-performance liquid chromatography., 1994, 42(8): 1632-1638.
[30] YOO K S, PIKE L M. Determination of flavor precursor compound S-alk(en)yl-L-cysteine sulfoxides by an HPLC method and their distribution inspecies., 1998, 75(1/2): 1-10.
[31] RANDLE W M, LANCASTER J E, SHAW M L, SUTTON K H, HAY R L, BUSSARD M L. Quantifying onion flavor compounds responding to sulfur fertility-sulfur increases levels of alk(en)yl cysteine sulfoxides and biosynthetic intermediates., 1995, 120(6): 1075-1081.
[32] ARNAULT I, CHRISTIDèS J P, MANDON N, HAFFNER T, KAHANE R, AUGER J. High-performance ion-pair chromatography method for simultaneous analysis of alliin, deoxyalliin, allicin and dipeptide precursors in garlic products using multiple mass spectrometry and UV detection., 2003, 991(1): 69-75.
[33] MIRON T, SHIN I, FEIGENBLAT G, WEINER L, MIRELMAN D, WILCHEK M, RABINKOV A. A spectrophotometric assay for allicin, alliin, and aliinase () with a chromogenic thiol: reaction of 4-mercaptopyridine with thiosulfinates., 2002, 307(1): 76-83.
[34] MIRON T, RABINKOV A, MIRELMAN D, WEINER L, WILCHEK M. A spectrophotometric assay for allicin and alliinase () activity: Reaction of 2-nitro-5-thiobenzoate with thiosulfinates., 1998, 265(2): 317-325.
[35] KUBEC R, DADAKOVA E. Quantitative determination of S-alk(en) ylcysteine-S-oxides by micellar electrokinetic capillary chromatography., 2008, 1212(1/2): 154-157.
[36] ZHU Q, KAKINO K, NOGAMI C, OHNUKI K, SHIMIZU K. An LC-MS/MS-SRM method for simultaneous quantification of four representative organosulfur compounds in garlic products., 2016, 9(12): 3378-3384.
[37] KHAR A, BANERJEE K, JADHAV M R, LAWANDE K E. Evaluation of garlic ecotypes for allicin and other allyl thiosulphinates., 2011, 128(4): 988-996.
[38] YOO M, LEE S, LEE S, SEOG H, SHIN D. Validation of high performance liquid chromatography methods for determination of bioactive sulfur compounds in garlic bulbs., 2010, 19(6): 1619-1626.
[39] LOCATELLI D A, ALTAMIRANO J C, LUCO J M, NORLIN R, CAMARGO A B. Solid phase microextraction coupled to liquid chromatography. Analysis of organosulphur compounds avoiding artifacts formation., 2014, 157: 199-204.
[40] RAMIREZ D A, LOCATELLI D A, TORRES-PALAZZOLO C A, ALTAMIRANO J C, CAMARGO A B. Development of garlic bioactive compounds analytical methodology based on liquid phase microextraction using response surface design. Implications for dual analysis: Cooked and biological fluids samples., 2017, 215: 493-500.
[41] DEL VALLE J M, MENA C, BUDINICH M. Extraction of garlic with supercritical CO2 and conventional organic solvents., 2008, 25(3): 535-542.
[42] WANG H P, LI X X, LIU S, JIN S. Quantitative determination of allicin inL. bulbs by UPLC., 2010, 71(1-2): 159-161.
[43] RIVLIN R S. Historical perspective on the use of garlic., 2001, 131(3): 951s-954s.
[44] CAVALLITO C J, BAILEY J H. Antibacterial substances from asarum canadense. I. Isolation, physical properties and antibacterial action., 1946, 68(3): 489-492.
[45] FREEMAN G G, MCBREEN F. A rapid spectrophotometric method of determination of thiosulphinate in onion () and its significance in flavour studies., 1973, 1(5): 1150-1152.
[46] BERNHARD R A, SAGHIR A R, JACOBSEN J V, MANN L K. Isolation and identification of allyl monosulfide and allyl alcohol from Allium., 1964, 107: 137-140.
[47] OLECH Z, ZABORSKA W. A spectrophotometric assay for total garlic thiosulfinates content. Kinetic aspects of reaction with chromogenic thiols., 2012, 62(1): 23-29.
[48] BOCCHINI P, ANDALO C, POZZI R, GALLETTI G C, ANTONELLI A. Determination of diallyl thiosulfinate (allicin) in garlic (L.) by high-performance liquid chromatography with a post-column photochemical reactor., 2001, 441(1): 37-43.
[49] RITOTA M, CASCIANI L, HAN B Z, COZZOLINO S, LEITA L, SEQUI P, VALENTINI M. Traceability of Italian garlic (L.) by means of HRMAS-NMR spectroscopy and multivariate data analysis., 2012, 135(2): 684-693.
[50] YOO M, KIM S, LEE S, SHIN D. Validated HPLC method and temperature stabilities for oil-soluble organosulfur compounds in garlic macerated oil., 2014, 52(10): 1165-1172.
[51] LOCATELLI D A, ALTAMIRANO J C, GONZáLEZ R E, CAMARGO A B. Home-cooked garlic remains a healthy food., 2015, 16: 1-8.
[52] KIM N Y, PARK M H, JANG E Y, LEE J. Volatile distribution in garlic (L.) by solid phase microextraction (SPME) with different processing conditions., 2011, 20(3): 775-782.
[53] LOCATELLI D A, NAZARENO M A, FUSARI C M, CAMARGO A B. Cooked garlic and antioxidant activity: Correlation with organosulfur compound composition., 2017, 220: 219-224.
[54] ABU-LAFI S, DEMBICKI J W, GOLDSHLAG P, HANUS L O, DEMBITSKY V M. The use of the 'Cryogenic' GC/MS and on-column injection for study of organosulfur compounds of the., 2004, 17(2): 235-245.
[55] KIMBARIS A C, SIATIS N G, PAPPAS C S, TARANTILIS P A, DAFERERA D J, POLISSIOU M G. Quantitative analysis of garlic () oil unsaturated acyclic components using FT-Raman spectroscopy., 2006, 94(2): 287-295.
Analytical Methods of the Organic Sulfur Compounds in Garlic
WENG Rui1, SHENG XiaoJing2, LIU PingXiang1, ZHANG JiGuang2, QIU Jing1, QIAN YongZhong1
(1Institute of Quality Standards and Testing Technology for Agro-Products, Chinese Academy of Agricultural Sciences/Key Laboratory of Agro-food Safety and Quality of Ministry of Agriculture and Rural Affairs, Beijing 100081;2Tobacco Research Institute, Chinese Academy of Agricultural Sciences/Key Laboratory of Quality and Risk Assessment for Tobacco and Aromatic plant products (Qingdao) of Ministry of Agriculture and Rural Affairs, Qingdao 266101, Shandong)
Garlic is a kind of widely planted agricultural product in China, which has plenty of nutritional and healthy functions, such as antibacterial, anti-inflammatory, and anti-oxidation. These functions are mainly attributed to the organic sulfur compounds, including the flavor precursors, thiosulfinates and thioether volatile compounds. The organic sulfur compounds either have its own biological activities, or multiple compounds work together to produce the same physiological effect. However, considering the poor stability and property diversity of the organic sulfur compounds, the analysis of organic sulfur compounds remains a big challenge. Existing reports are mainly on the determination of several compounds or one group of compounds, and there has been no comprehensive analysis of the organic sulfur compounds in garlic yet. Therefore, in the present review, the analysis methods of the main flavor precursors, thiosulfinates and thioether volatile compounds in garlic were separately discussed and summarized, including the sample pretreatment and detection methods.
garlic; organic sulfur compounds; analytical methods; nutritional ingredient
10.3864/j.issn.0578-1752.2019.18.012

2019-01-17;
2019-04-09
國家特色蔬菜產(chǎn)業(yè)技術體系崗位專家任務(CARS-24-E-04)
翁瑞,E-mail:wrsdu1989@126.com
(責任編輯 趙伶俐)

