hsa-miRNA-30a-5p促進肺癌細胞A549增殖的機制研究
周 靜,吳 杲,馬福家
(1.寧波市婦女兒童醫院,浙江 寧波,315012;2.海軍軍醫大學附屬長海醫院虹口院區,上海 200081;3.海軍特色醫學中心藥劑科,上海 200052)
我國每年新發現肺癌病例數約為70萬[1],而肺癌致死率已上升至惡性腫瘤病死率的首位[2],尋找新的潛在肺癌基因治療靶點,開發更為有效的肺癌治療方案,已成為關乎全民健康的迫切問題。hsa-miRNA-30a-5p定位于人6號染色體,其家族與腫瘤的相關報道多集中于肝癌及乳腺癌研究領域。A類清道夫受體5-SCARA5,位于8號染色體短臂,被稱為“低調的抑癌高手”。SCARA5在肝癌、宮頸癌和乳腺癌的發生發展中扮演著重要角色,與這些類型的腫瘤侵襲和遷移也有密切的關系[3]。但與肺癌的相關研究未見有相關報道。在本研究中,我們擬對臨床肺癌標本中的hsa-miRNA-30a-5p 和SCARA5表達及相關性做出檢測和分析,用低通量方法做進一步驗證hsa-miRNA-30a-5p與SCARA5的表達差異,同時分析兩者的相關性,在此基礎上,我們通過生物信息學分析hsa-miRNA-30a-5p 和SCARA5基因3′-UTR區的結合關系,并通過熒光素酶報告基因法進行證實,最終擬通過干預A549細胞內hsa-miRNA-30a-5p含量來調控腫瘤細胞增殖活性。
1 材料與方法
1.1 實驗材料
人肺癌標本及癌旁組織取自解放軍第455醫院,人肺癌A549細胞購自中國科學院典型培養物保藏委員會細胞庫,RPMI1640培養基、0.25%胰蛋白酶、胎牛血清(FBS)、Lipofectamine 2000轉染試劑、RNA提取試劑盒(Trizol)及反轉錄試劑盒(M-MLV)均購自美國Invitrogen公司,熒光素酶報告基因表達載體(PGL3-promoter)和熒光素酶檢測系統(Promega公司),SCARA5蛋白一抗及二抗均購自美國Santacruz公司,細胞及組織總蛋白提取及定量試劑盒、化學發光試劑盒均購自美國Thermo公司,miRNA合成及測序均由上海生工工程有限公司進行,MTT(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide)和二甲基亞砜(DMSO)購自Sigma公司,無內毒素質粒DNA提取試劑盒(Qiagen公司),熒光定量檢測試劑盒、限制性內切酶、連接酶、切膠回收試劑盒均購自Takara公司,pshRNA基因沉默表達載體(美國Systermbio公司)。
1.2 儀器和設備
細胞培養箱(美國Thermo公司),水平離心機、高速低溫離心機以及微量移液器(Eppendorf公司),電泳儀、垂直電泳槽及轉膜儀(上海天能公司),酶標儀及紫外分光光度檢測儀(Thermo公司),PCR儀(BioRad公司)。
2 實驗方法
2.1 肺癌標本中hsa-miRNA-30a-5p及SCARA5
蛋白含量檢測
收集肺腺癌及其癌旁組織5對,組織取好之后用生理鹽水漂洗,后用濾紙吸干水分,然后將組織裝入凍存管,編號后液氮保存。開始檢測實驗前,取出液氮保存的組織樣本,切取2份各200 mg左右的組織,每份組織加入1 ml經4℃預冷的Trizol,使用電動勻漿器進行組織勻漿,勻漿液4℃下以12 000×g離心2 min,收集上清液,然后酚氯仿法提取組織Total RNA。RNA通過瓊脂糖凝膠電泳觀察完整性,并通過紫外分光光度儀檢測RNA濃度。取2 μg RNA經M-MLV反轉錄制備cDNA,熒光定量法檢測組織中hsa-miRNA-30a-5p含量。另取相同大小組織,加入1 ml組織裂解液T-MER,經充分勻漿后進行組織蛋白提取和定量,實驗過程完全按照試劑盒說明書進行,蛋白提取完成后,通過Western blotting檢測組織中SCARA5蛋白相對含量。
2.2 生物信息學預測hsa-miRNA-30a-5p與SCARA5
(NM_173833.5) 3′-UTR結合位點
采用Targetscan預測軟件對SCARA5(NM_173833.5) 3′-UTR區與hsa-miRNA-30a-5p進行結合位點預測,預測結果顯示(圖2A),hsa-miRNA-30a-5p在SCARA5的3′-UTR區存在8個堿基的種子區“5′-UGUUUACA-3′”。
2.3 載體構建
化學法合成長鏈DNA,5′-CTAGATGCATTTCAGGGACTGCATTTCAGGGAC TGCATTTCAGGGAC-3′,下游引物,5′-AGATC GTCCCTGAAATGCAGTCCCTGAAATGCAGTCCCTGAAATGCA-3′,兩端分別添加XbaⅠ酶切位點,片段包含hsa-miRNA-30a-5p與SCARA5基因3′UTR區結合位點,長鏈退火形成雙鏈DNA,后克隆至熒光素酶報告基因表達載體PGL3-promoter,重組載體經序列分析后命名為野生型熒光素酶報告基因表達載體pGL3-WT-SCARA5。使用同樣的方法將預測結合位點進行錯義突變,即由“5′-UGUUUACA-3′”突變為“5′- AUUCUGUA-3′”,構建突變型熒光素酶報告基因表達載體pGL3-MT-SCARA5,根據SCARA5(NM_173833.5)的基因信息,設計針對其編號取的siRNA序列5′-GCAACGCCAGCGAGGACAC-3′,然后根據siRNA序列設計兩條互補的長鏈DNA,上下游引物分別添加酶切位點BamHΙ和EcoRΙ及保護堿基,上游引物序列:5′- GATCCGCAACGCCAGCGAGGACAC CTTCCTGTCAGAGTGTCCTCGCTGGCGTTGCTTTTTG -3′;下游引物序列:5′- AATTCAAAAAGCAACGCCAGCGAGGACAC TCTGACAGGAAG
GTGTCCTCGCTGGCGTTGCC -3′,雙鏈DNA經退火形成雙鏈DNA,并克隆至基因表達載體,構建SCARA5基因表達載體pshRNA- SCARA5。 重組載體經序列分析無誤后,擴增轉化菌株,進行無內毒素質粒DNA提取,提取過程嚴格按照試劑盒說明書進行,使用dH2O將質粒DNA終濃度調整至500 ng/μl,-20℃保存。
化學合成miRNA-30a-5p mimics(5′ -uGuAAACAuCCuCGACuGGAAG-3′),inhibitor(5′-CuuCCAGuCGAGGAuGuuuACA-3′)及陰性對照(NC,5′-CuuCCAGuCGAGGAuGuuuACA- 3′),RNA末端加tt保護堿基。
2.4 Hsa-miRNA-30a-5p與SCARA5靶位關系的驗證
選取對數生長期的A549細胞,胰酶消化法制備細胞懸液,臺酚藍染色后使用血細胞計數板進行活細胞計數,使用完全培養基(RPMI1640+10%FBS)調整細胞密度為1×105個/ml,接種細胞于6孔板,每孔加2 ml細胞懸液,37℃和5% CO2條件下培養24 h,參照Lipofectmaine 2000轉染試劑說明書進行質粒和RNA共轉染實驗。轉染分為9組:A549對照組、pGL3-WT-SCARA5組、pGL3-MT-SCARA5組、miRNA30a-5p NC+pGL3-WT-SCARA5組、miRNA30a-NC+ pGL3-MT-SCARA5組、miRNA30a-5p mimics+pGL3-WT-SCARA組、miRNA30a-5p mimics+pGL3-MT-SCARA組、miRNA30a-5p inhibitor+pGL3-WT-SCARA組和miRNA30a-5p inhibitor+pGL3-MT-SCARA組,每組細胞轉染100 ng的海腎熒光素酶表達質粒(pGL3-TK)作為熒光霉素活性的檢測參照。A549細胞轉染后48 h,使用Promega公司的雙熒光素酶檢測系統和熒光素酶檢測儀,檢測轉染后細胞熒光素酶活性。
2.5 轉染miRNA30a-5p inhibitor對肺癌A549的影響
取對數生長期的A549細胞,0.25%胰酶消化后收集細胞,1 500×g水平離心2 min,收集細胞,使用含10%FBS的RPMI1640培養基重懸細胞,并調整細胞密度至1×105個/ml,接種細胞到6孔細胞培養板,每孔添加2 ml細胞懸液,37 ℃和5%CO2條件下培養24 h,然后進行轉染實驗,轉染過程及RNA用量完全參照試劑盒Lipofectmaine 2000說明書。實驗分為4組,A549細胞對照組、miRNA-30a NC轉染組、miRNA-30a-5p inhibitor轉染組和miRNA-30a-5p inhibitor且pshRNA-SCARA5轉染組。轉染后48 h,收集細胞,提取細胞Total RNA,熒光定量法檢測hsa-miRNA-30a-5p含量,同時,提取細胞總蛋白,用Western blotting法檢測胞內SCARA5蛋白相對含量。
2.6 A549細胞增殖活性的檢測
實驗分為4組,A549細胞對照組、miRNA-30a-5p NC轉染組、miRNA-30a-5p inhibitor轉染組和miRNA-30a-5p inhibitor且pshRNA-SCARA5轉染組。取轉染后48 h的A549細胞,胰酶消化法制備細胞懸液,離心收集細胞沉淀,用含10%FBS的RPMI1640完全培養基調整細胞密度至1×105個/ml,接種細胞到96孔細胞培養板,每孔添加100 μl細胞懸液,輕晃培養板使其分布均勻,37℃和5 % CO2條件下培養細胞,并于接種后的24、48、72 h,采用MTT法檢測細胞活性。檢測前,每孔細胞加入5 mg/ml MTT溶液10 μl,輕晃使其分布均勻,繼續培養4 h,去上清液,每孔加入150 μl DMSO溶液,37℃孵育15 min,酶標儀檢測570 nm波長(A570)細胞液的吸光度值,根據吸光度值制作細胞對數期生長曲線。
2.7 real time-PCR檢測hsa-miRNA-30a-5p含量
取2 μg 的Total RNA,反轉錄制備cDNA,反轉錄過程使用特異反轉錄引物,H.sapiens 6 snRNA:5′-TACCTTGCGAAGTGCTTAAAC-3′;hsa-miRNA-30a-5p,5′-GTCGTATCCAGTGCGTGTCGTG GAGTCGGCAATTGCACTGGATACGACTTCC-3′,取2 μl反轉錄產物作為PCR模板,熒光定量法檢測hsa-miRNA-30a-5p含量。2ΔΔCt法分析定量結果,內參選用U6(NM_001101.3)。PCR引物序列:U6上游引物5′-GTGCTCGCTTCGGC AGCACAT-3′,下游引物5′-TACCTTGCGAAGTGC TTAAAC-3′; hsa-miRNA-30a-5p上游引物5′-GCCGGCGCCCGAGCT CTGGCTC-3′,下游引物5′- TGTAAACATCCTCGACTGGAAG -3′。PCR使用20 μl體系,其中,SYBR Premix Ex Taq 10 μl,引物(20 μmol/L)各取0.2 μl,模板使用量為2 μl,反應體系用dH2O補足。PCR條件:95℃變性10 s;58℃退火10 s;72 ℃延伸10 s,循環數設置為40。結果分析中,以U6作為對照,通過Ct值進行數據分析。Ct值通過交點法計算獲得,即通過擴增曲線與閾值線的交點來計算Ct值。相對定量的結果則通過ΔΔCt法進行解析,目的基因相對于內參基因的表達量為2ΔCt=2Ctm-Ctn。
2.8 Western blotting檢測SCARA5蛋白含量
將濃度測定后的總蛋白以每組10μl進行垂直電泳,SDS-聚丙烯酰胺凝膠分離膠濃度為10%,經110 V電壓90 min電泳后,立春紅染色觀察蛋白條帶是否完整,400 mA電流轉膜90 min,轉膜后以5%的脫脂牛奶封閉2 h,4 ℃一抗過夜孵育,SCARA5和GAPDH一抗(TBST)稀釋比分別為1∶300和1∶1 000;TBST洗膜3次,加入二抗孵育2 h,羊抗鼠二抗稀釋比為1∶2 000;TBST洗膜3次,添加化學發光液反應底物,暗室曝光,掃描曝光底片,統計目的條帶光密度值(D值)。D值目的蛋白/D值GAPDH,即為SCARA5蛋白的相對含量。
2.9 統計學方法
3 結果
3.1 腫瘤標本中hsa-miRNA-30a-5p與SCARA5蛋白含量檢測
Hsa-miRNA-30a-5p相對含量檢測數據(圖1A)顯示,與癌旁組織比較,肺癌組織中的hsa-miRNA-30a-5p含量明顯降低,組間差異顯著(P<0.05),數據以(均值±標準差)表示,實驗設置3次獨立的生物學重復; SCARA5蛋白含量檢測結果(圖2B)顯示,肺癌組織和癌旁組織中蛋白含量分別為(1.00±0.38)和(4.29±1.18),統計結果顯示,組間差異顯著(P<0.05)。
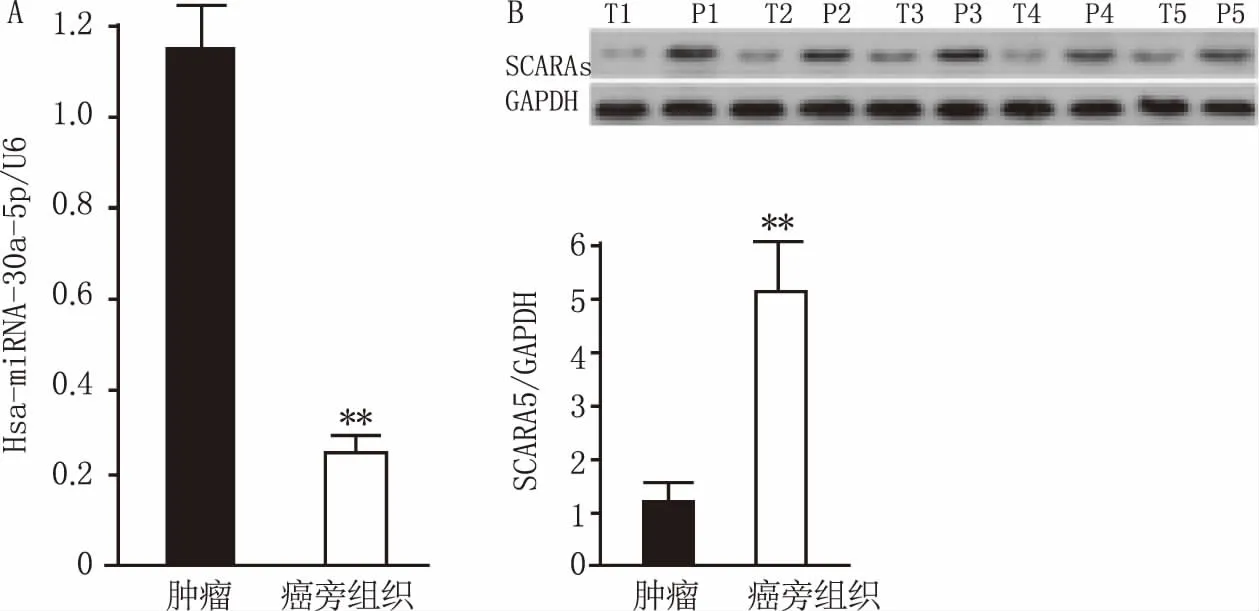
圖1 腫瘤標本中hsa-miRNA-30a-5p與SCARA5蛋白含量檢測 A.肺癌及癌旁組織中hsa-miRNA-30a-5p相對含量檢測結果,U6為內參;B.肺癌及癌旁組織中SCARA5蛋白表達檢測結果,GAPDH為參照蛋白;**P<0.01,與腫瘤組比較
3.2 Hsa-miRNA-30a-5p與SCARA5靶位關系驗證
生物信息學預測顯示,hsa-miRNA-30a-5p在SCARA5基因3′UTR區有8個堿基的結合位點(圖2A)。分別將miRNA-30a-5p mimics、miRNA-30a-5p inhibitor、miRNA-30a-5p NC與兩組熒光素酶報告基因表達載體pGL3-WT- SCARA5和 pGL3-MT- SCARA5進行共轉染,轉染后48 h,熒光素酶相對活性檢測結果顯示(圖2B),miRNA-30a-5p mimics能夠明顯抑制野生型熒光素酶表達載體熒光素酶活性,從(3.98±0.61)降至(1.62±0.31),差異具有統計學意義(P<0.05),而miRNA-30a-5p inhibitor則能夠增強野生型熒光素酶報告基因表達載體的熒光素酶活性,(3.98±0.61)上升至(6.27±0.35),組間差異顯著(P<0.05);對于突變型熒光素酶報告基因表達載體,無論miRNA-30a-5p mimics或者miRNA-30a-5p inhibitor都對其無明顯影響。以上數據和結果說明,hsa-miRNA-30a-5p與SCARA5基因之間的預測靶位確實存在。

圖2 熒光素酶活性檢測 A.hsa-miRNA-124-3p與SCARA5基因3′UTR結合位點的生物信息分析;B.A549細胞轉染后24 h,細胞內熒光素酶活性檢測結果注:“+”代表轉染,“-”代表不轉染*P<0.05,**P<0.01,與pGL3-WT-SCARA5轉染組比較
3.3 轉染后A549細胞內hsa-miRNA-30a-5p及SCARA5蛋白含量檢測
A549細胞轉染miRNA-30a inhibitor后48 h,細胞內hsa-miRNA-30a-5p含量明顯降低(圖3A),與對照組比較,差異顯著(P<0.05),而miRNA-30a-5pNC轉染組hsa-miRNA-30a-5p含量與對照組比較,無明顯差異(P>0.05);蛋白含量檢測結果說明(圖3B), 轉染miRNA-30a-5p inhibitor后48 h,細胞內SCARA5含量明顯上升,與細胞對照組比較,差異顯著(P<0.05),而miRNA-30a-5p inhibitor與沉默載體pshRNA-SCARA5共轉染組細胞內SCARA5蛋白表達與對照組比較,無明顯差異(P>0.05)。
3.4 hsa-miRNA-30a-5p含量變化對A549細胞增殖活性的影響
細胞瞬時轉染后24~72 h,各組細胞增殖活性檢測結果(圖4)顯示,轉染后48、72 h,與轉染對照組比較,miRNA-30a-5p inhibitor轉染組A549細胞增值活性明顯降低(P<0.05),pshRNA- SCARA5與miRNA-30a-5p inhibitor轉染組細胞增殖活性則明顯增強(P<0.01),恢復到基因干預前的水平。
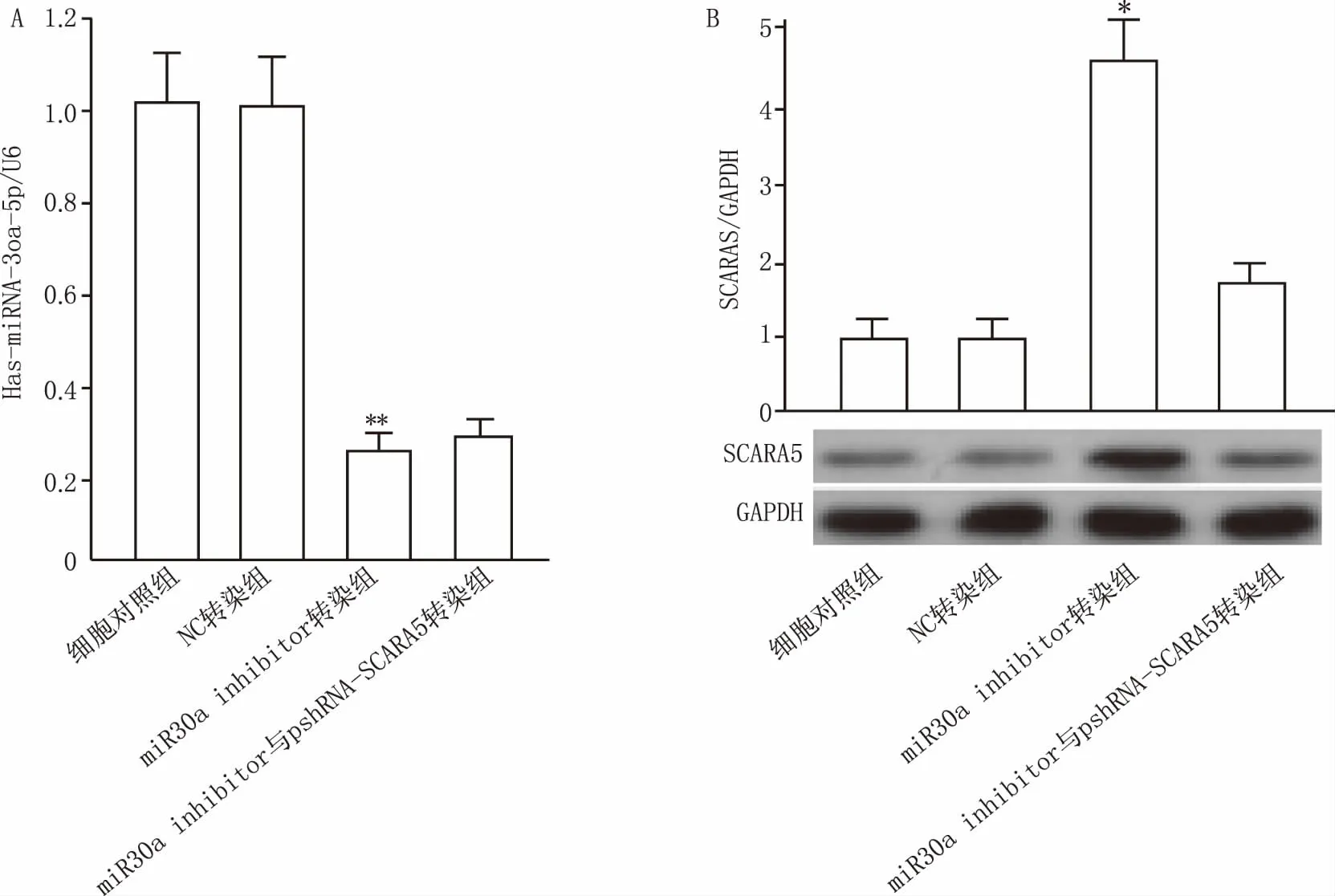
圖3 轉染后A549細胞內hsa-miRNA-30a-5p及SCARA5蛋白含量檢測 A.A549細胞轉染后48 h,各組細胞內 hsa-miRNA-30a-5p含量檢測結果;B.A549細胞轉染后48 h,各組細胞內SCARA5蛋白含量檢測結果*P<0.05,與細胞對照組比較
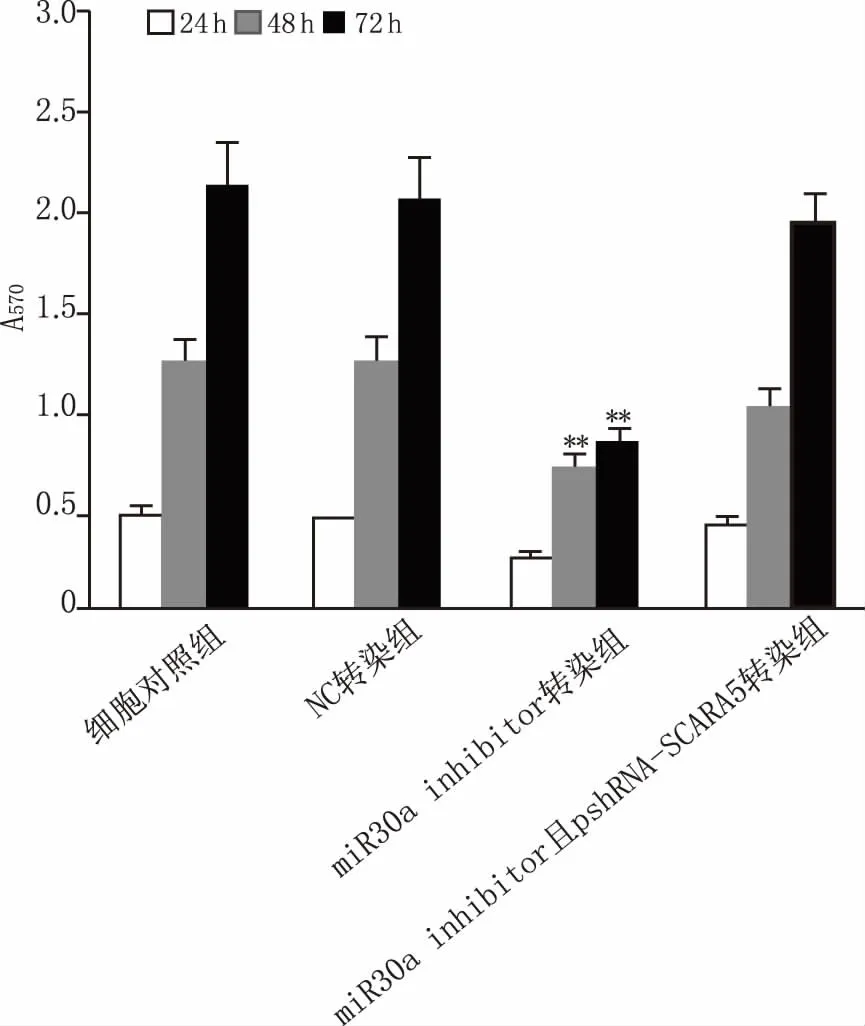
圖4 A549細胞增殖活性檢測 **P<0.01,與細胞對照組(相同時間點)比較
4 討論
微小RNA(miRNA) 屬于內源性非編碼RNA,廣泛分布于基因組,其成熟體長度一般為20~25個堿基。從遺傳進化學角度來講,miRNA具有高度保守性。miRNA具有多種生物功能,這些功能主要通過對其靶基因的調控來實現,miRNA通過種子區可以與其靶基因3′-UTR區結合,從而抑制基因翻譯[4]。miRNA與腫瘤關系密切,可調節細胞凋亡、生長、增殖、遷移、侵襲,通過參與多種信號通路的靶蛋白的克隆形成和血管生成,參與關鍵的發病機制[5-6]。Winther等研究表明,miRNA-21可作為食管腺癌及食管鱗癌的獨立預后因素[7]。Wang等通過研究發現,miRNA-128b在胃癌的發病進程中起重要作用,過表達miRNA-128b可抑制胃癌細胞的增殖,同時誘導胃癌細胞產生凋亡[8]。miRNA-10a,miRNA-26,miRNA-126a,miRNA-210,miRNA-342和miRNA-519a被證實可以作為乳腺癌的生物學標志物,且與乳腺癌對一線用藥他莫昔芬的藥物敏感性有關[9]。miRNA-29b及miRNA17則被證實在腸癌的調控機制失活中扮演了關鍵角色[10-11]。這些研究表明,miRNA是多種腫瘤發病機制的內在原因,而其也可以成為腫瘤基因治療的切入點。過去的4年中,肺癌的總體5年生存率僅上升了4%,早期較低的診斷率是改善肺癌預后的主要障礙,肺癌切除術患者生存率大于80%,這也表明肺癌的早期檢測和診斷對提高患者的生存率至關重要,而血清中miRNA作為非侵入性肺癌生物標志物被陸續發現和證實[12]。Chen等研究證實,miRNA-25可以通過其靶基因RGS3調控非小細胞肺癌細胞株A549和H520的增殖和侵襲[13]。另外,還有miRNA-143-3p,miRNA-218,miRNA130家族[14-16]和miRNA-630[17]均與肺癌的生物學調控機制有關。所有這些研究表明,miRNAs在肺癌的發病機制中很可能形成一個網絡調控系統,對相關的miRNA進行研究,將有助于尋找新的miRNA靶基因和新的肺癌基因治療靶點[18]。
SCARA5于2009年被我國科學家發現,一系列的研究表明,SCARA5基因作為肝癌抑制基因,在肝癌組織中表達下降,SCARA5的肝癌抑制作用可能是通過抑制FAK蛋白的激活來實現的[3]。Khamas 等通過研究證實,SCARA5在腸癌中表達異常[19]。在膠質瘤細胞U251中過表達SCARA5,可以顯著抑制腫瘤細胞的增殖,顯著降低克隆形成、遷移和體外侵襲,體內實驗也表明,SCARA5過表達可以抑制皮下腫瘤的增殖[20]。Liu等通過實驗證實,SCARA5與A549細胞的EMT有關,并認為是轉錄因子SNAIL1的負調控作用所致[21]。Hsa-miRNA-30a-5p及其家族是高度保守的miRNA家族,與腫瘤發生、發展密切相關,hsa-miRNA-30a-5p下游目標包括轉錄因子如ITGB3、DTL、EWS-FLI和CD99等,通過調節這些下游目標蛋白的表達,參與調節結直腸癌、尤文瘤等類型腫瘤的發生與發展[22-24]。Hsa-miRNA-30a-5p與肺癌的相關研究較少,與SCARA5的相關研究則目前未見報道。我們在肺癌組織中驗證SCARA5的表達,數據顯示SCARA5在肺癌組織中的表達量明顯低于癌旁組織,hsa-miRNA-30a-5p在肺癌與癌旁組織中的表達與SCARA5呈顯著負相關。
我們的研究顯示,hsa-miRNA-30a-5p與SCARA5具有顯著負相關性,hsa-miRNA-30a-5p在肺癌中的高表達導致了腫瘤組織內SCARA5表達的顯著降低。MTT檢測結果顯示,通過miRNA-30a-5p inhibitor轉染可以明顯抑制A549細胞對數生長期增殖活性,當miRNA-30a-5p inhibitor與SCARA5基因沉默同時進行時,A549細胞增殖活性又恢復到基因干預前的水平。這些數據說明,miRNA-30a-5p inhibitor確實是通過抑制A549細胞內hsa-miRNA-30a-5p的表達,增強了其靶蛋白SCARA5含量,而高表達的SCARA5則明顯抑制了A549細胞的增殖活性,因此在肺癌細胞A549中,SCARA5顯然作為抑癌蛋白發揮作用。
本研究的意義在于證實hsa-miRNA-30a-5p是肺癌細胞中SCARA5蛋白低表達的主要因素,通過抑制腫瘤細胞內hsa-miRNA-30a-5p,可以顯著上調其靶蛋白SCARA5的表達,進而顯著抑制腫瘤細胞A549的增殖活性。該實驗結果提示我們,hsa-miRNA-30a-5p可成為潛在的肺癌基因治療靶點。

