二氫楊梅素對Bloom解旋酶結構和生物學活性的影響
劉金河,張望明,晏文濤, 許鍵煒,葛章文
(1. 貴州醫科大學細胞工程生物醫藥技術國家地方聯合工程實驗室,組織工程與干細胞實驗中心,貴州省再生醫學重點實驗室,貴州 貴陽 550004; 2. 中國醫學科學院成體干細胞轉化研究重點實驗室;3. 貴州省人民醫院檢驗科,貴州 貴陽 550002;4. 貴州中醫藥大學第一附屬醫院檢驗科,貴州 貴陽 550001)
Bloom綜合征(Bloom syndrome,BS)是一種隱性的常染色體遺傳病,臨床主要特征是生長發育遲緩、面部有對光敏感的斑、免疫缺陷、易患多種癌癥及不孕不育[1]。BS主要是由細胞內的Bloom解旋酶(Bloom helicase,BLM)突變導致基因組的不穩定,進而導致各種基因突變發生并誘發癌癥。BLM解旋酶能夠結合雙鏈DNA,利用ATP提供能量,由3′-5′解開雙鏈DNA[2]。因此,研究小分子藥物對BLM解旋酶功能的影響,尋找靶向特效抑制藥物,對治療此類癌癥具有重要意義。本研究中使用的BLM解旋酶為該酶的核心區域,氨基酸殘基序列區間為642-1290,簡稱BLM642-1290。
二氫楊梅素(dihydromyricetin,DMY)是一種黃酮類化合物(結構見Fig 1),主要存在于楊梅科、柳科、葡萄科、藤黃科等植物中,在藤茶屬植物中含量最高[3-4]。最近的研究表明,DMY具有廣泛的藥理活性,能夠通過促進細胞凋亡,多環節阻滯或延緩腫瘤的發生發展[5-6]。在急性胰腺炎(acute pancreatitis,AP)的損傷修復中,通過抑制TRAF3-p38信號通路來抑制AP的應答[7]。在對乙酰氨基酚(acetaminophen,APAP)誘導的小鼠急性肝損傷中,具有良好的修復作用[8]。在抑制肝臟的脂肪堆積,防止動脈粥樣硬化方面,也具有明顯的療效[9]。在臨床上,能緩解地塞米松造成的肌肉萎縮[10], 能通過抑制semaphorin 4D來抑制結直腸癌的發展[11]。另外,DMY的抗氧化作用也比較強,在抗炎、抗病原微生物、解酒護肝、調血脂等方面也有廣泛的應用,具有較大的臨床應用潛力[12]。
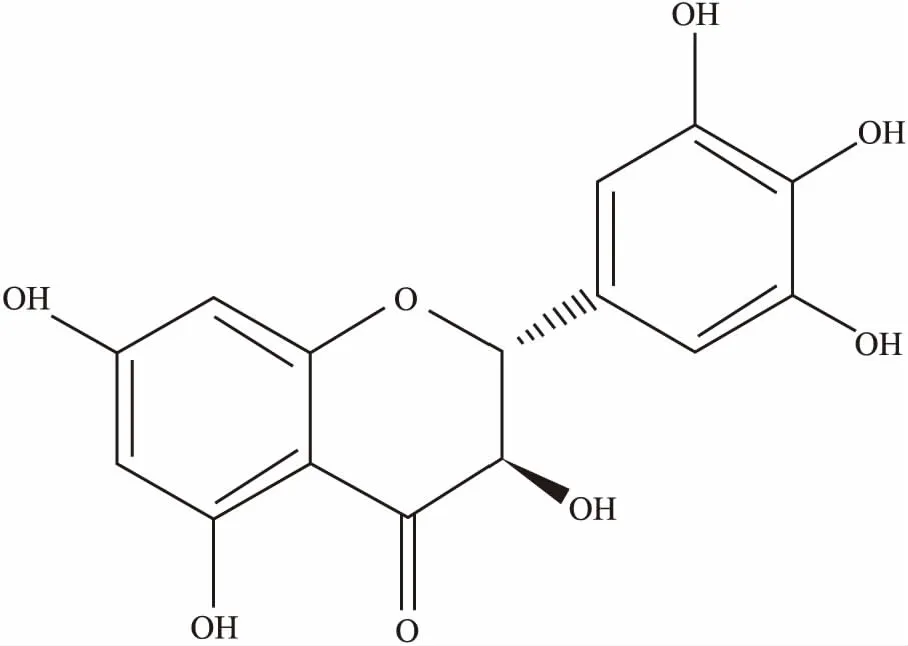
Fig 1 Chemical structure of DMY
目前對DMY的研究有很多,主要關注DMY的各種藥理作用,其中抗腫瘤方面著重在肝癌、乳腺癌、卵巢癌等惡性腫瘤方面,而DMY對這些癌細胞及活體影響的分子機制的研究卻鮮見報道。本文采用圓二色譜(circular dichroism,CD)、自由磷檢測、紫外光譜、熒光偏振等技術和方法,研究DMY對BLM642-1290解旋酶的二級結構、生化活性、構象的影響,探討DMY與BLM解旋酶相互作用的分子機制。
1 材料與方法
1.1 試劑DMY(CAS27200-12-0,20 mg,上海源葉生物公司);ATP酶活性檢測試劑盒(英國Innova Biosciences公司);DNA底物雜交緩沖液(20 mmol·L-1Tris-HCl,100 mmol·L-1NaCl,pH 7.9);熒光偏振實驗反應緩沖液(20 mmol·L-1Tris-HCl,25 mmol·L-1NaCl,3 mmol·L-1MgCl2和0.1 mmol·L-1DTT,pH 7.9);ATP酶活性檢測緩沖液(0.1 mol·L-1Tris-HCl,5 mmol·L-1MgCl2,1 mmol·L-1ATP和4 nmol·L-1ssDNA,pH 7.9);紫外光譜實驗緩沖液C(20 mmol·L-1Tris,500 mmol·L-1NaCl,500 mmol·L-1咪唑,10%甘油,pH 7.9);圓二色譜實驗緩沖液為1×PBS。其他化學試劑均為國產分析純。
1.2 儀器Ultrospec2100 Pro紫外分光光度計(美國GE公司);NGCTM蛋白質純化系統(美國Bio-Rad公司);Beacon 2000熒光偏振儀(美國Panvera公司);Milli-Q 超純水系統(美國Millipore Corp);Bio-Logic電化學工作站(法國,Bio-Logic)。
1.3 DNA底物實驗中的DNA底物由北京鼎國工程技術有限公司合成,其長度和序列見Tab 1。在40 μL DNA雜交緩沖液中,分別加入5 μL 100 μmol·L-1A1和A2單鏈DNA(ssDNA, A2),90 ℃水浴3 min,室溫下自然冷卻復性,獲得雙鏈DNA(dsDNA,A1A2),其作為熒光偏振實驗中檢測所需的雙鏈DNA底物。ATP酶活性測定中使用A1作為DNA底物。
1.4 BLM642-1290解旋酶的制備BLM解旋酶的重組大腸桿菌由西北農林科技大學奚緒光教授饋贈。首先,將BLM642-1290解旋酶大腸桿菌的菌種在37 ℃復蘇,然后接種到5 L培養基中進行擴大培養;在18 ℃條件下,擴大培養后的菌種中加入終濃度0.4 mmol·L-1IPTG誘導表達20 h; 4 ℃條件下,4 000 r·min-1離心15 min,收集管底部菌體,加入適量buffer A(20 mmol·L-1Tris,500 mmol·L-1NaCl,0.5 mmol·L-1咪唑, 10%甘油,pH 7.9),高壓細胞破碎儀(英國Constant Systems公司)進行細胞破碎(壓力為21 KPSI),破碎1次,離心收集上清液; 在蛋白純化儀上,用鎳親合層析柱和Superdex-200(美國GE Healthcare公司)進行分離和純化,獲得可用于開展生物學活性研究的BLM642-1290解旋酶(Fig 2),考馬斯亮藍染色檢測BLM642-1290蛋白純度(Fig 3)。本實驗所需蛋白為Fig 3中1號泳道BLM,BCA法測定BLM642-1290解旋酶蛋白濃度為0.383 g·L-1。

Tab 1 Oligonucleotide sequences used in this study
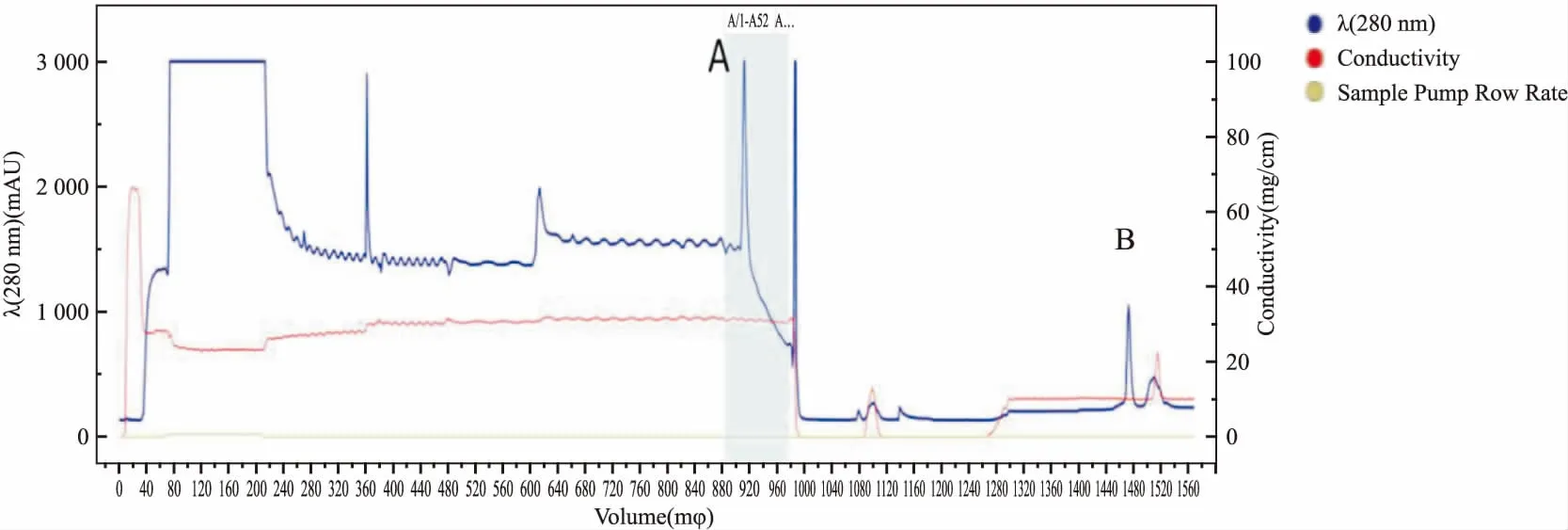
Fig 2 Purification of BLM642-1290 by Ni affinity chromatography and molecular sieve chromatography
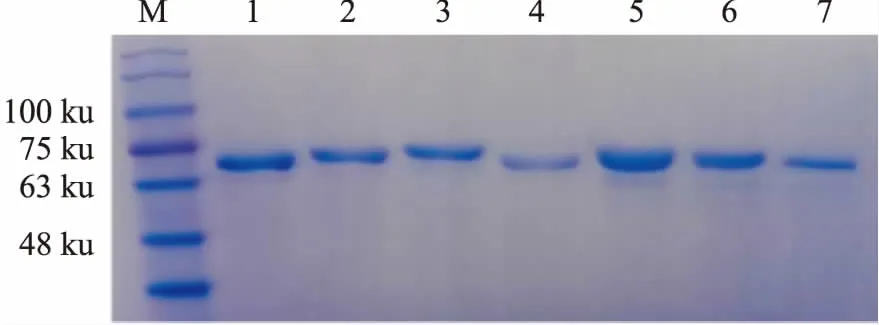
Fig 3 Determination of BLM helicase purity after molecular sieve chromatography
1.5 DMY對BLM642-1290解旋酶構象的影響緩沖液C中,終濃度為0.8 μmol·L-1BLM642-1290解旋酶與不同濃度梯度的DMY混合,25 ℃放置2 h后,于紫外分光光度計中掃描圖譜,速度為每次3 min,該反應總體系為200 μL。另外,單獨掃描不同濃度梯度的DMY在緩沖液C中的紫外吸收光譜。反應在室溫下進行,掃描速度750 nm·min-1,掃描精度1 nm,掃描范圍200~400 nm。每個圖譜均為10~15個穩定數據的平均值。
1.6 DMY對BLM642-1290解旋酶二級結構的影響在1×PBS緩沖液中,終濃度為0.8 μmol·L-1BLM642-1290解旋酶與不同濃度的DMY混合,總反應體系為400 μL(1 mm光程比色皿),先室溫下反應30 min后,再利用stop-flow電化學工作站(法國BioLogic Science Instruments公司)進行CD的檢測,掃描速度每次5 min,直到CD圖譜達到穩定,連續測定20次穩定后的CD圖譜數據,擬合獲得的20次實驗數據,實驗重復3次。色譜掃描區間為190~260 nm,掃描精度為1 nm,狹縫寬度為5 nm。
1.7 DMY對BLM642-1290解旋酶DNA結合活性的影響在此實驗中,采用2種方式來研究DMY對BLM642-1290解旋酶DNA結合活性的影響[13]。第1種,BLM解旋酶與2 nmol·L-1的DNA(A2或A1A2)相互結合形成復合物,然后用不同濃度的DMY進行滴定;第2種,在室溫下,不同濃度的DMY首先與BLM642-1290解旋酶反應5 min,然后再加入到2 nmol·L-1DNA(ssDNA或dsDNA)的反應緩沖液C中,熒光偏振儀檢測。實驗重復3次,數據為10~15個穩定偏振值平均之后的結果。
1.8 DMY對BLM642-1290解旋酶DNA解鏈活性的影響此方法借鑒劉金河等[13]的實驗方法,25 ℃條件下,DMY與BLM642-1290解旋酶混合5 min后,加入到含2 nmol·L-1A1A2反應buffer中檢測偏振值的變化,當偏振值達到穩定后,再加入終濃度為0.2 mmol·L-1ATP,10 s檢測1次數據直到數據穩定,取數據穩定后的10~15個熒光偏振值數據求平均值,并進行3次實驗重復。DNA解鏈的速率常數可根據方程(1)獲得:
At=A1exp(-kobst)
(1)
式中At是解鏈時間為t時的熒光偏振值,A1是解旋酶與dsDNA完全結合時的熒光偏振值。
1.9 DMY對BLM642-1290解旋酶ATP酶活性的影響不同濃度DMY分別與終濃度10 nmol·L-1的BLM642-1290解旋酶混合5 min后,將該混合液與ATPase活性檢測液按照1∶1(V/V)的比例混合,并開始計時,在2.5、5、7.5、10、15、20、25、30 min時間點,分別取出反應混合液200 μL,迅速加入到含50 μL Goldmix的EP管中,以終止ATP的水解反應,2 min后,加入穩定劑20 μL,平衡30 min,在650 nm波長下檢測其吸光度值[13]。如果酶活力定義為每分鐘催化1 mol底物水解所需的酶量(U·mL-1·min-1),BLM642-1290解旋酶的酶活力可由方程式(2)計算得出。
(2)
式中,A是根據標準曲線測出的Pi濃度(μmol·L-1);B是反應時間min;C是解旋酶的稀釋倍數。

2 結果
2.1 DMY能夠改變BLM642-1290解旋酶的空間結構DMY對BLM642-1290解旋酶的紫外吸收的影響如Fig 4所示,DMY在237 nm和330 nm處具有兩個紫外吸收峰(Fig 4A),而BLM642-1290解旋酶在237 nm和276 nm處具有兩個紫外吸收峰(Fig 4C)。當DMY與BLM642-1290解旋酶相互作用后,紫外吸收峰位發生了偏移,從237 nm處的紅移到239 nm,峰型基本保持不變(Fig 4B)。進一步分析可知,在237 nm處,BLM642-1290解旋酶與DMY相互作用后的紫外吸收值大于BLM642-1290解旋酶與DMY的紫外吸收值之和(1.25>0.49+0.25)(Fig 4C),表明DMY與BLM642-1290解旋酶之間發生了相互作用,BLM642-1290解旋酶的構象發生了變化。將[DMY]/[BLM642-1290]的比值與紫外吸收值進行線性擬合,得一條直線(斜率k=0.0235),可知BLM642-1290解旋酶與DMY有且僅有1個結合位點(Fig 4D)。
2.2 DMY能部分解開BLM642-1290解旋酶二級結構由Fig 5A可知,BLM642-1290解旋酶的α-螺旋結構在不同濃度的DMY的作用下都有一定的結構變化,208 nm和222 nm處的負峰也清晰可見,表明BLM642-1290解旋酶的結構遭到一定程度的破壞,但是不能完全破壞其α-螺旋結構,而是存在一個最適DMY濃度。由Fig 5B可知,在DMY濃度為0~25 μmol·L-1時,隨著DMY濃度的增加,α-螺旋在一定程度上逐漸解旋;當DMY濃度大于25 μmol·L-1時,隨著DMY濃度的增加,α-螺旋又逐漸從松散狀態基本回到最初的狀態。
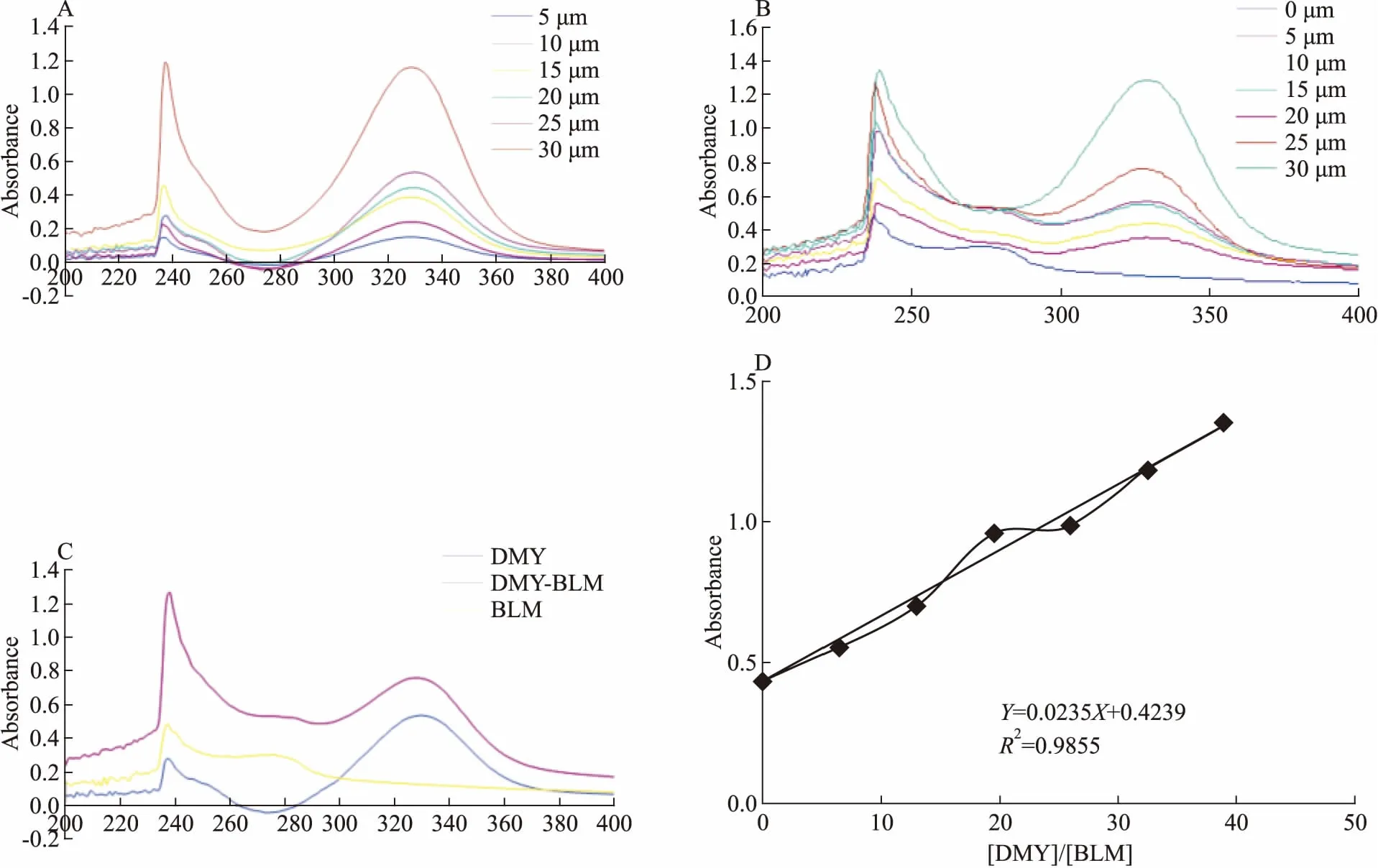
Fig 4 Ultraviolet(UV) absorption spectra of DMY interacted with BLM642-1290 helicase

Fig 5 Circular dichroism(CD) spectra of DMY interacted with BLM642-1290 helicase
2.3 DMY能夠抑制BLM642-1290解旋酶DNA結合活性DMY對BLM642-1290解旋酶的DNA結合活性的影響見Fig 6。由圖可知,無論dsDNA(Fig 6A)還是ssDNA(Fig 6B)作為BLM642-1290解旋酶結合活性的底物,BLM642-1290與DNA相互結合而產生的熒光偏振值的增加量,都隨DMY濃度的增加而明顯減小(P<0.01);另外,DMY單獨滴定dsDNA或者ssDNA的熒光偏振值無明顯變化,說明DMY與DNA并無相互作用(Fig 6C)。由此可以推斷,DMY與BLM642-1290解旋酶僅有的1個結合位點是在BLM642-1290解旋酶的DNA結合位點上,并且其與BLM642-1290解旋酶DNA結合位點的親和力大于DNA。
2.4 DMY能抑制BLM642-1290解旋酶DNA解鏈活性DMY對BLM642-1290解旋酶的解鏈活性的影響見Fig 7。由Fig 7A可見,隨著反應體系中DMY終濃度的逐漸增加(0~25.33 μmol·L-1),因解鏈而降低的熒光偏振值(A1-A2)逐漸減小,表明BLM642-1290解旋酶的解鏈活性逐漸降低。由此可知,BLM642-1290解旋酶的解鏈活性被DMY抑制,但不能完全抑制其解鏈。根據公式(1)進一步分析了DMY存在下BLM642-1290解旋酶的Kobs值的變化(Fig 7B),隨著DMY濃度的增加,BLM642-1290解旋酶的Kobs值逐漸減小,表明DMY能夠抑制BLM642-1290解旋酶的解鏈活性。
2.5 DMY能明顯抑制BLM642-1290解旋酶的ATPase活性DMY對BLM642-1290解旋酶的ATPase活性的影響見Fig 8。由Fig 8A可知,DMY能明顯抑制BLM642-1290解旋酶的ATPase活性(P<0.05),且酶活力的高低與DMY的濃度呈負相關,但不能完全抑制ATPase活性。由Fig 8B可知,在相同的酶濃度條件下,隨著時間的延長,BLM642-1290解旋酶的酶活力逐漸下降,表明BLM642-1290解旋酶的酶活力與時間呈負相關。通過米氏方程雙倒數作圖法進一步分析實驗數據,計算出酶反應的Vmax、Km等常數,結果見Tab 2。隨著DMY濃度的增加,Vmax逐漸減小,而Km保持穩定,且Kcat減小,證明DMY競爭性抑制BLM解旋酶的ATPase活性。
3 討論
BLM解旋酶是SF2超家族當中的一員,由解旋酶結構域(helicase)、RecQ保守的C末端結構域(RecQ-Ct)和解螺旋酶RNA酶D碳末端(HRDC)結構域組成[14]。Helicase結構域具有該家族特有的保守基序(Ⅰ、Ⅱa、Ⅲ-Ⅵ),結構和功能研究顯示,motif Ⅰ和motif Ⅱ與NTP的結合有關。Motif Ⅳ和motif Ⅵ與ATP水解和核酸的結合有關,motif Q是SF2特有的保守序列,位于motif Ⅰ N末端前,其作用與ATP結合和水解有關。RecQ-Ct結構域具有DNA結合活性及ATPase活性,但不能結合ATP。HRDC結構域位于BLM解旋酶的C末端,能夠輔助性結合DNA,進而調節其解鏈功能,也可增強和穩定BLM解旋酶與DNA的結合,但不具有催化活性[13]。
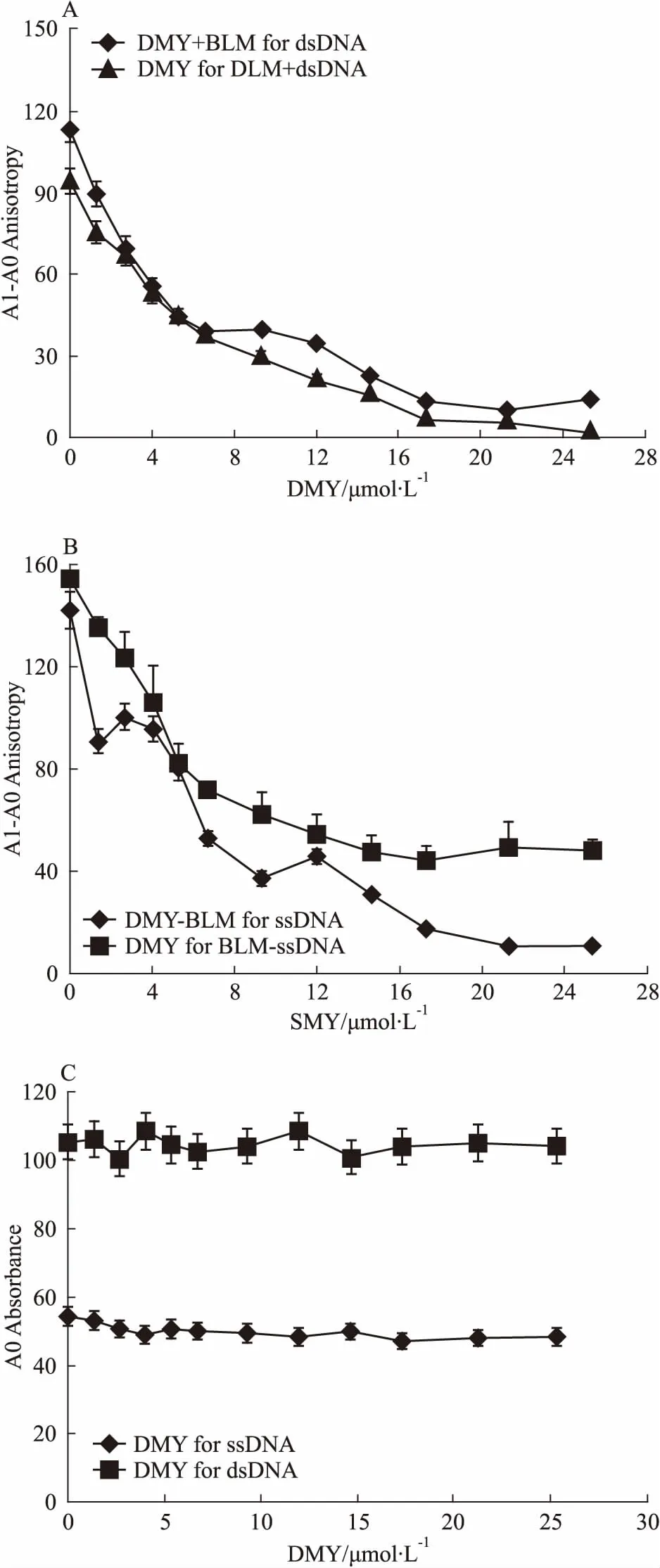
Fig 6 Effects of DMY on DNA-binding activity of BLM642-1290 helicase

Tab 2 Effects of DMY on ATPase activity constants of BLM642-1290 helicase

Fig 7 Effects of DMY on DNA unwinding activity of BLM642-1290 helicase
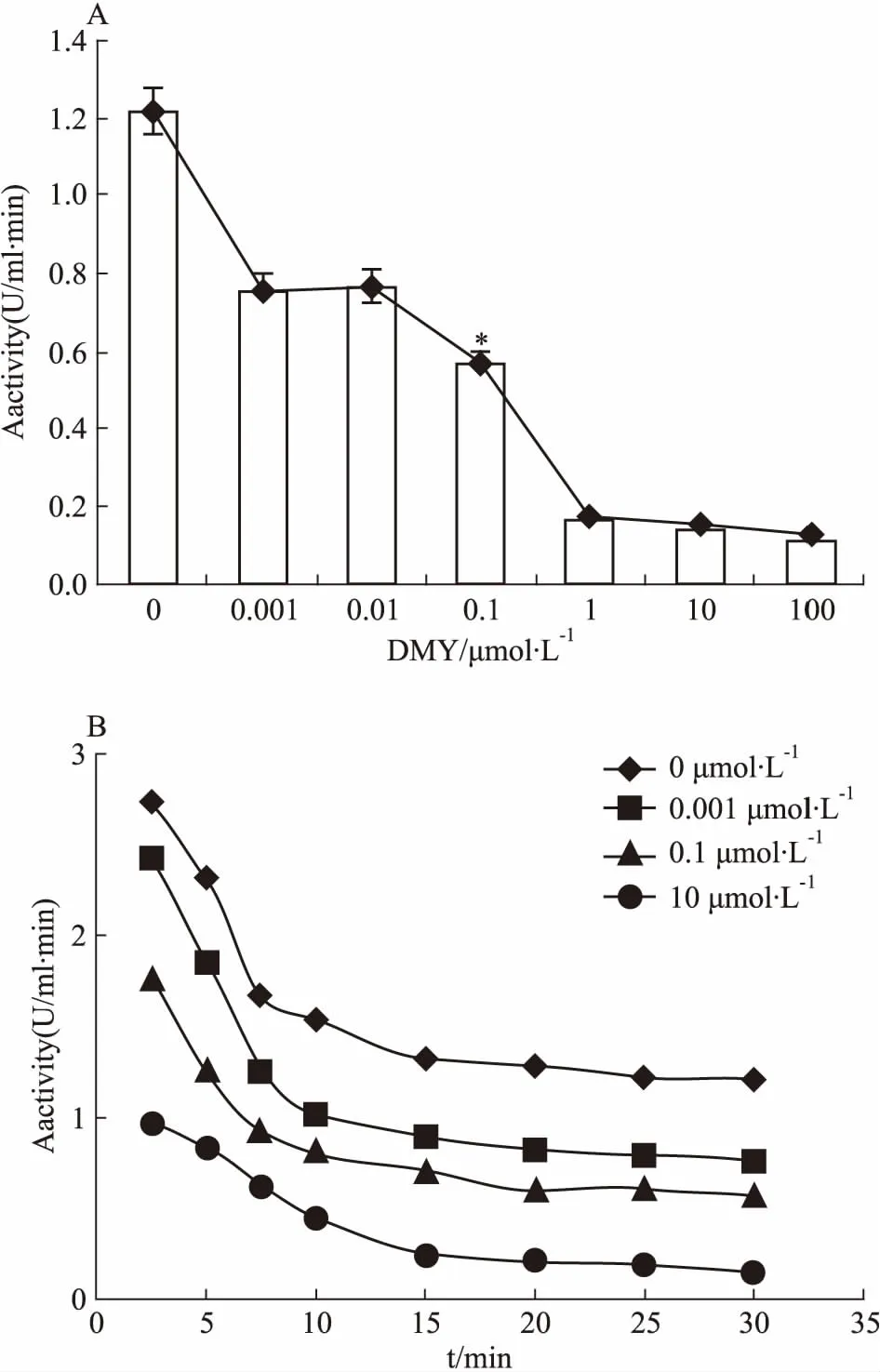
Fig 8 Effects of DMY on ATPase activity of BLM642-1290 helicase
從CD實驗結果可知,DMY對BLM解旋酶的二級結構具有一定影響,使得BLM解旋酶的結構逐漸發生一定程度的松散,因α-螺旋結構的微變化,使得Helicase結構域內負責與DNA相互結合的活性基團的位置和距離發生微小變化,從而使得BLM與DNA的結合能力下降,而結合活性實驗中進一步看到BLM解旋酶與DMY的結合力大于與DNA的結合能力,因此,DMY搶奪BLM解旋酶的DNA結合位點。從紫外光譜實驗和解鏈活性實驗可以看出,DMY與BLM解旋酶的結合僅有1個結合位點,而在結果“2.3”的DMY對BLM642-1290解旋酶DNA結合活性的影響當中可以看到,隨著DMY的濃度逐漸增加,BLM-dsDNA或BLM-ssDNA的偏振值增加量(A1-A0)逐漸降低,甚至為零,也就是說DMY能將DNA從BLM642-1290置換下來,并占據DNA的結合位點,另外,因ATPase活性的實現區域在BLM642-1290解旋酶的helicase結構域中,為此我們大膽推斷,這個結合位點很可能是在解旋酶結構域上,且阻止了motif Ⅳ和motif Ⅵ與DNA的結合,這種結合與DNA形成了可逆的競爭性機制。BLM解旋酶是人體細胞內普遍存在的一類具有解開雙鏈DNA能力的活性蛋白質,它參與細胞內DNA的復制、重組、修復、轉錄等代謝過程,在維持染色體的穩定性方面具有重要的作用。BLM解旋酶在多種腫瘤細胞體內表達升高,比如乳腺癌、前列腺癌、肺癌、惡性淋巴瘤等[2,15],抑制BLM解旋酶的活性或表達量,能明顯抑制腫瘤細胞的生長。例如,甘草次酸下調BLM解旋酶的表達,并抑制前列腺癌PC-3細胞的增殖[15],敲減BLM基因后的PC3細胞增殖能力、侵襲能力和遷移能力明顯被絲裂霉素C抑制[16]。因此,尋找副作用小、價格便宜的小分子藥物也就顯得非常重要,這也為抗腫瘤藥物的研發提供了新的思路。而提取DMY的植物在國內分布廣泛、取材容易、成本低廉,成藥后價格不高,值得進一步的研究。本實驗的基礎研究驗證了DMY確實可以抑制癌癥相關蛋白Bloom解旋酶的活性,也就在一定程度上說明DMY存在成為癌癥治療藥物的可能性,后續的動物實驗、臨床實驗的結果如何,有待進一步的研究。
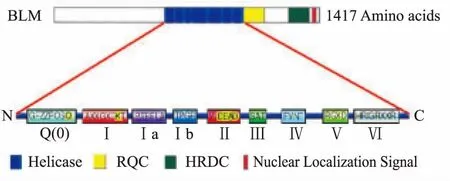
Fig 9 Domain of BLM helicase
(致謝:本實驗在貴州大學高原山地動物遺傳育種與繁殖省部共建教育部重點實驗室完成,衷心感謝各位同學和老師的支持和幫助)