姜黃素通過影響自噬調控肝細胞上皮間質轉化及肝纖維化進程的作用與機制研究
孔德松,張自力,張 峰,鄭仕中
(1. 南京中醫藥大學附屬南京中醫院科研部,江蘇 南京 210001;2. 南京中醫藥大學藥學院藥理學教研室,江蘇 南京 210023;3. 江蘇省中藥藥效與安全性評價重點實驗室,江蘇 南京 210023)
肌成纖維細胞(myofibroblast,MFB)的大量生成與活化是肝纖維化過程中的核心環節[1-2]。近年來,研究發現[3-5],肝細胞經上皮間質轉化(epithelial-mesenchymal transition,EMT)轉化為成纖維細胞后,對肝纖維化的發生與發展起重要作用,我們的前期研究也得到了同樣的結論[6]。抑制肝細胞EMT過程,減少MFB的生成,將是減緩甚至逆轉肝纖維化的有效措施。姜黃素(curcumin)的藥理作用與臨床開發一直是國內外制藥領域關注的熱點之一[7-8],臨床應用前景十分誘人。我們的研究表明,姜黃素可以有效抑制肝星狀細胞(hepatic stellate cell,HSC)的活化,具有很強的體內外抗肝纖維化作用,姜黃素在各類肝損傷中對肝細胞具有選擇性保護作用[9-10]。文獻研究發現,在姜黃素抗纖維化作用的研究中,涉及肝細胞EMT調控機制研究的報道較少。我們前期研究發現,姜黃素能夠抑制缺氧誘導的肝細胞EMT進程,減少細胞外基質(extracellular matrix,ECM)的生成[6],但參與調控的具體機制,仍有待進一步深入研究。
大量研究證實,自噬在非酒精性脂肪肝、肝纖維化、肝癌等肝臟疾病的發病進程中發揮重要作用[11-14]。在肝細胞內,自噬通過清除錯誤折疊蛋白、過度積累的脂類(脂肪分解)和(或)受損的線粒體(線粒體自噬)等途徑,保證肝臟細胞的能量供給,從而維持肝臟細胞的自穩態[15]。我們在前期預實驗中發現,肝纖維化小鼠肝細胞的整體自噬水平是下降的,在缺氧環境下的,隨著時間的推移,肝細胞自噬水平先是有所增加,后逐漸下降。最新研究表明,肝損傷進程中,肝細胞的自噬與EMT之間可相互調節,自噬可降低Snail蛋白的表達,抑制肝細胞EMT進程,同樣EMT也可影響肝細胞內的自噬流[16]。為此,我們推測肝細胞內自噬流的變化與肝細胞的EMT及向MFB轉變存在著重要關聯。本文旨在探討姜黃素對肝細胞自噬及EMT的干預效應,進一步深入闡釋姜黃素的抗肝纖維化作用及機制。
1 材料
1.1 細胞株小鼠胚胎肝細胞BNL CL.2,購自中國科學院上海細胞所。
1.2 藥物與試劑姜黃素(純度>99%,美國Sigma公司);干擾質粒構建(南京謹庭生物科技有限公司);蛋白抽提試劑盒(碧云天生物技術研究所);轉化生長因子β1(transforming growth factor β1,TGF-β1)(Cell Signal公司);波形蛋白(Vimentin)、α-平滑肌肌動蛋白(alpha smooth muscle actin,α-SMA)、Beclin-1、LC3抗體(Abcam公司);逆轉錄試劑盒、real time-PCR用試劑(Bio-Rad公司)。
1.3 儀器DM1L倒置光學顯微鏡(德國萊卡);SPECTRA MAX 190可見-紫外光微孔板檢測儀(美國MD公司);Mini Protean 3 Cell電泳儀(美國Bio-Rad公司);GS-15R冷凍離心機、MSD97K49微量離心機(美國Beckman公司);PCR儀(美國AB公司)。
2 方法
2.1 實驗分組取對數生長期的小鼠胚胎肝細胞BNL CL.2,分為5組:正常對照組、模型組、姜黃素低、中、高劑量(10、20、30 μmol·L-1)組,以TGF-β1(2 μg·L-1)處理細胞,同時給予姜黃素干預,作用24 h后檢測相關指標。
按文獻方法構建BECN1與陰性對照(CTR)基因的干擾RNA(siRNA),轉染小鼠胚胎肝細胞BNL CL.2,得兩種體外細胞模型:自噬基因沉默(siBECN1,模型細胞1)及對照(siCTR,模型細胞2)用于實驗[16]。實驗分為正常對照組、TGF-β1刺激組、BECN1 siRNA組、CTR siRNA組、姜黃素組、BECN1 siRNA+姜黃素組、CTR siRNA+姜黃素組,共7組。除正常對照組外,其余各組均以TGF-β1(2 μg·L-1)處理細胞,同時給予姜黃素干預,作用24 h后檢測相關指標。
2.2 Western blot檢測BNL CL.2肝細胞自噬、細胞表型及纖維化標志物蛋白表達細胞干預處理后,加入預冷RIPA裂解液,立即加入PMSF和磷酸酶抑制劑,冰上孵育30 min,移入離心管,4℃、15 000 r·min-1離心15 min,取上清液為細胞裂解液。BCA法測定蛋白濃度,加上樣緩沖液,沸水浴10 min。SDS-PAGE凝膠電泳(上樣量50 μg),100 V轉膜1.5 h,脫脂奶粉封閉。根據實驗前處理,分別加入一抗:肝細胞自噬相關蛋白(Beclin-1、LC3)、細胞表型相關蛋白(Vimentin)及纖維化標志物α-SMA,然后孵育二抗,化學發光劑ECL顯色。
2.3 Real-time PCR檢測BNL CL.2肝細胞自噬、細胞表型及纖維化標志物基因表達按TRIzol Reagent說明書提取細胞總RNA,酶標儀測定RNA含量。將mRNA反轉錄成cDNA,取反轉錄產物進行實時定量PCR反應。PCR以GAPDH為內參,所用特異性引物序列見Tab 1。實時熒光定量PCR法檢測mRNA相對表達基于比較CT(threshold cycle)值法,每個樣本的mRNA含量用各內參GAPDH含量進行標準化。
2.4 光學顯微鏡下觀察細胞形態變化取對數生長期的小鼠胚胎肝細胞BNL CL.2,用0.25%胰蛋白酶消化制成細胞懸液,接種于12孔板中(1×105個/孔)。至細胞80%貼壁后,按“2.1”干預分為7組,顯微鏡下拍照,觀察細胞形態變化。
2.5 GFP-LC3質粒轉染和細胞的篩選按照質粒小量抽提純化試劑盒說明書提取質粒pcDNA3.1-GFP-LC3。采用Effectene Transfection Reagent介導方法,將pcDNA3.1-GFP-LC3質粒轉染BNL CL.2肝細胞,按說明書操作,將轉染復合物加入到含10%胎牛血清的DMEM培養的細胞中。轉染24 h后加入G418工作液,終濃度為800 mg·L-1,每3~5 d更換培養液,同時以未轉染的BNL CL.2肝細胞作為陰性對照。培養14 d后,轉染細胞有抗藥克隆長出,而陰性對照組細胞全部死亡。將轉染細胞有限稀釋,并克隆化培養于96孔培養板中。培養5 d后,挑選單克隆細胞生長孔于倒置熒光顯微鏡下觀察,有綠色熒光的細胞為陽性細胞。待孔中細胞增殖至約50%融合度時,相繼傳代于24孔、6孔培養板、細胞培養瓶中擴大培養。

3 結果
3.1 姜黃素增強BNL CL.2肝細胞自噬相關蛋白與基因的表達,抑制細胞間質型及纖維化標志物蛋白與基因的表達Fig 1的Western blot結果表明,TGF-β1刺激后,BNL CL.2肝細胞間質型標志物Vimentin及肌成纖維細胞標志蛋白α-SMA表達增加,而細胞自噬水平降低,Beclin-1與LC3表達下降;姜黃素能夠降低Vimentin與α-SMA的表達,同時升高細胞內自噬相關蛋白的表達。Real-time PCR結果(Tab 2)與Western blot結果一致。
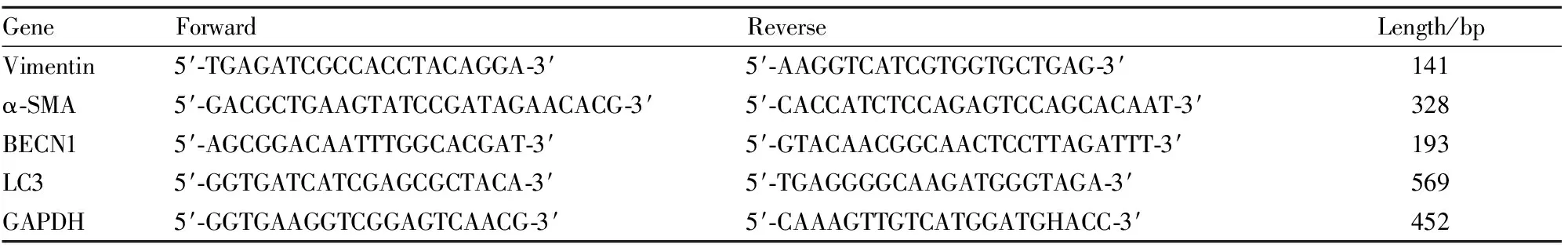
Tab 1 Primer sequence for real-time PCR

Tab 2 Effect of curcumin(CUR) on mRNA expression of Vimentin,α-SMA, BECN1, LC3 in BNL CL.2 cells stimulated by TGF-β1

Tab 3 Effect of CUR and BECN1 siRNA on mRNA expression of Vimentin,α-SMA, BECN1, LC3 in BNL CL.2 stimulated by TGF-β1
3.2 姜黃素可阻滯TGF-β1誘導及自噬基因干擾所致的BNL CL.2肝細胞的上皮間質轉化進程從細胞形態學上看(Fig 2),TGF-β1誘導和自噬相關基因(BECN1)干擾后,BNL CL.2肝細胞轉變為間質型細胞表型,給予姜黃素(20 μmol·L-1)干預,細胞形態未發生間質化轉變。
3.3 姜黃素可減少TGF-β1誘導及自噬基因干擾所致的BNL CL.2肝細胞的自噬小體的形成如Fig 3所示,TGF-β1與BECN1 siRNA處理后,BNL CL.2肝細胞自噬水平降低,給予姜黃素(20 μmol·L-1)能明顯增加細胞內自噬水平。
3.4 姜黃素通過促進自噬抑制BNL CL.2肝細胞EMT進程Tab 3的Real-time PCR結果表明,TGF-β1刺激后,BNL CL.2肝細胞間質型標志物Vimentin及肌成纖維細胞標志蛋白α-SMA基因表達增加;干擾自噬基因BECN1后,姜黃素抑制Vimentin與α-SMA基因表達的作用被部分阻斷。
4 討論
肝纖維化在我國常見、高發,肝細胞經EMT向MFB的轉變是肝纖維化發病進程的關鍵事件。姜黃素體內外具有明顯抗肝纖維化作用,并能抑制肝細胞EMT進程,減少ECM的生成。自噬參與多種肝臟疾病的發展進程調控,可能與肝細胞EMT存在重要關聯,但機制仍不明確。目前,姜黃素確切的抗肝纖維化作用的內在機制仍不十分清楚,特別是其調控肝細胞EMT進程與抗肝纖維化的關系更是知之甚少,有待于進一步解析與闡明,以此為靶標的藥物作用與機制研究更為鮮見,是當前肝纖維化病理機制與治療學研究的一個突出的前沿創新點。基于我們已有的研究積累和掌握的文獻資料,課題組提出并推測,自噬在肝纖維化發生時肝細胞EMT進程調控中發揮重要作用;姜黃素可通過影響肝細胞內自噬流的變化,進而逆轉肝細胞EMT進程,減少MFB的生成及ECM的沉積。
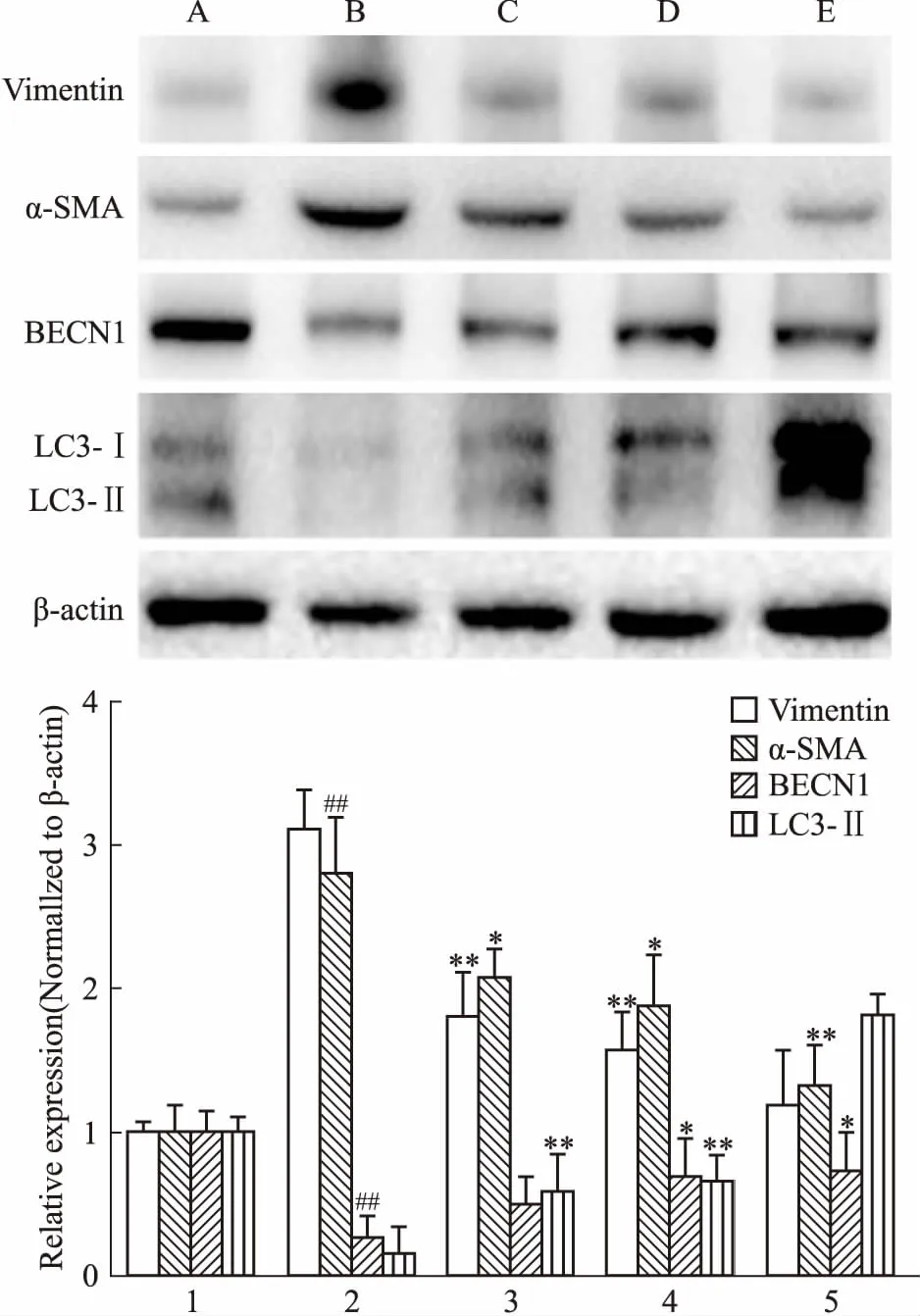
Fig 1 Protein expression of Vimentin,α-SMA,Beclin-1,LC3 in BNL CL.2 cells influenced by TGF-β1 and intervened by curcumin(CUR) by Western blot detection
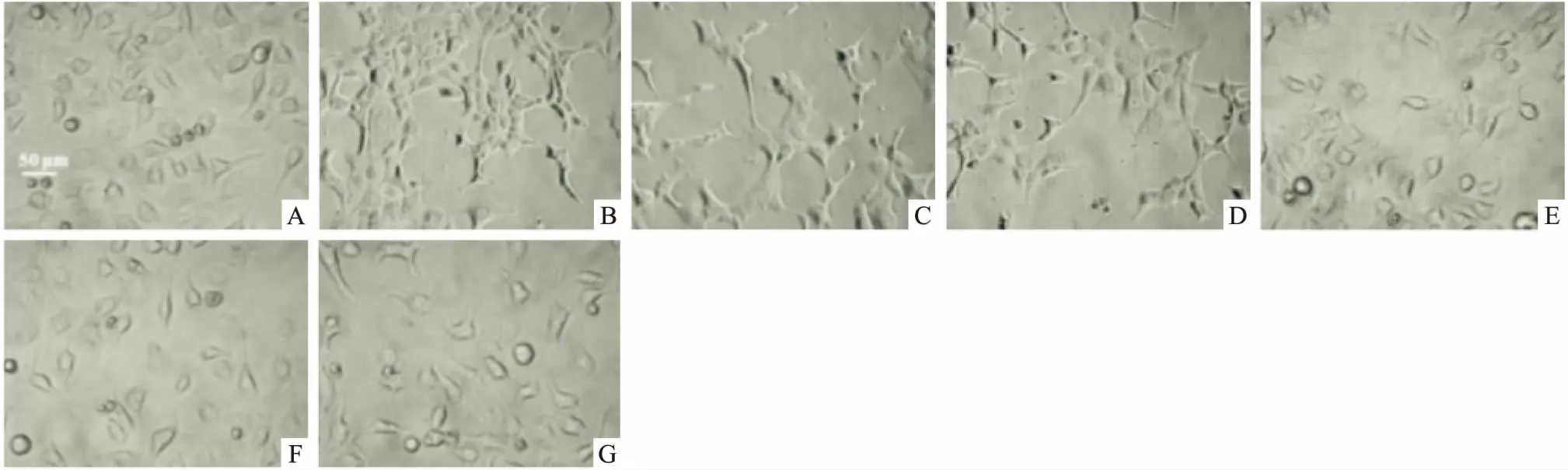
Fig 2 Morphologic change of BNL CL.2 cells in each group
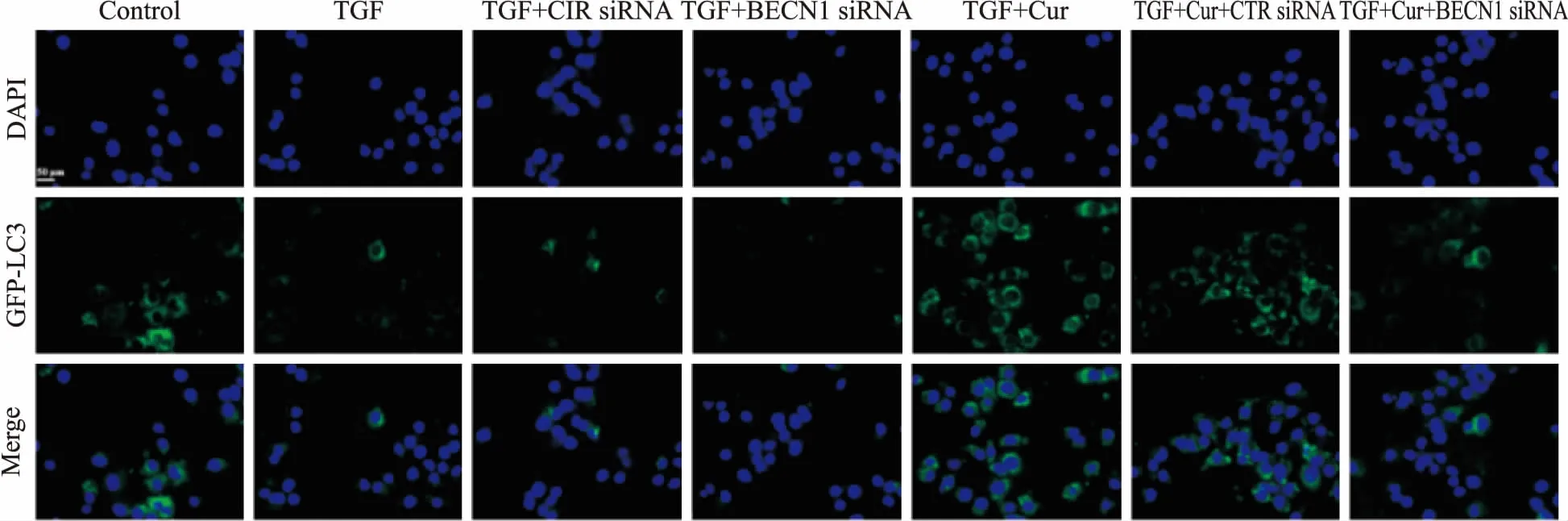
Fig 3 Autophagy levels in each group
本研究發現,TGF-β1(2 μg·L-1)處理后,BNL CL.2肝細胞間質型標志物Vimentin及MFB標志蛋白α-SMA表達增加,細胞形態也向間質型轉變,自噬水平下降。干擾自噬相關基因BECN1,肝細胞的間質化表型轉變更加明顯。姜黃素能抑制TGF-β1誘導后肝細胞Vimentin及α-SMA的表達,抑制肝細胞的EMT進程,增加肝細胞自噬相關基因與蛋白Beclin-1、LC3的表達。干擾自噬基因BECN1后,姜黃素抑制Vimentin、α-SMA基因表達的作用被部分阻斷,表明姜黃素抑制肝細胞EMT的作用依賴于對自噬的調控環節。我們的研究初步揭示了自噬在肝細胞向MFB轉變中的作用,以及姜黃素通過提高肝細胞自噬水平,抑制肝細胞EMT進程,進而抑制肝纖維化發生與發展的內在機制。
本研究仍存在諸多不足,將在后續研究中進一步解決:① 項目的機制研究還有待進一步深入。姜黃素通過何種機制調控肝細胞的自噬,姜黃素調控自噬后,自噬又是通過何種機制影響肝細胞EMT的。細胞自噬過程是胞內信號轉導網絡綜合調控的結果,ROS、mTOR、AMPK、p38-MAPK等多條信號轉導通路參與其中[17-20]。前期本實驗室研究發現,姜黃素可通過激活PPARγ,抑制HSC的氧化應激及進一步的活化。姜黃素是否能通過抑制ROS,調控肝細胞自噬,仍需進一步的驗證。但自噬對EMT進程調控的報道仍較少,仍需進一步闡明其中調控機制。② 姜黃素調控肝細胞自噬與細胞凋亡、壞死、焦亡等進程的區別與聯系等。當細胞遭受外界損傷時,細胞走向不同的死亡方式可能是由于細胞不同信號轉導通路的活化,各通路間也存在著相互調控與關聯。