表沒食子兒茶素促進Nrf2的核轉位減輕Aβ25-35對SH-SY5Y細胞的損傷
張 雯,宋俊科,朱曉瑜,楊海光,王海港,許啟泰,杜冠華
(1. 中國醫學科學院北京協和醫學院藥物研究所,天然藥物活性物質與功能國家重點實驗室,藥物靶點研究與新藥篩選北京市重點實驗室,北京 100050;2.海南綠檳榔科技發展有限公司,海南 定安 571200)
阿爾茲海默病(Alzheimer′s disease,AD)是一種與年齡相關的,隱匿發展的神經系統退行性疾病,給家庭和社會帶來沉重的負擔[1]。AD的特征性病理變化為胞內神經纖維纏結,胞外β淀粉樣(amyloid β protein,Aβ)沉積,神經元損傷及突觸減少。Aβ為AD病理進程的關鍵因素,Aβ的神經毒性及其誘導的蛋白級聯反應對AD的發生發展具有重要作用[2]。
研究表明,多酚類化合物具有很強的抗氧化能力,能夠清除細胞內自由基,發揮神經保護作用[3-5]。此外,多酚類化合物中的某些成分還能夠減少Aβ生成、促進Aβ消除,保護神經元免受Aβ神經毒性[6-8]。以往的文獻中,對表沒食子兒茶素沒食子酸酯的研究較多,但對表沒食子兒茶素(epigallocatechin,EGC)研究較少。EGC作為一種多酚類化合物,廣泛存在于茶葉、檳榔等植物中,其是否能夠減輕Aβ對神經細胞的損傷,未見報道。因此,本實驗選擇SH-SY5Y細胞為研究對象,研究EGC對Aβ25-35誘導SH-SY5Y細胞損傷的保護作用及機制。
1 材料與方法
1.1 材料
1.1.1藥物與試劑 EGC(HPLC>98%), 購自上海源葉生物科技有限公司;DMEM/F12培養基、胎牛血清(fetal bovine serum,FBS)、2′,7′-二氯熒光黃雙乙酸鹽(2′,7′-dichlorofluorescin diacetate,DCFH-DA),均購自Thermo Scientific公司;Aβ25-35、Hoechst 33258、MTT、氮乙酰半胱氨酸(N-acetylcysteine,NAC),均購自Sigma公司;蛋白裂解液、β-actin抗體,均購自Cell Signaling Technology公司;乳酸脫氫酶(lactate dehydrogenase,LDH )細胞毒性檢測試劑盒,購自碧云天生物技術公司;核因子E2相關因子2(nuclear factor erythroid-derived 2-like 2,Nrf2)、血紅素氧合酶-1(hemeoxygenase-1,HO-1)、醌氧化還原酶1(NADPH:quinone oxidoreductase 1,NQO1)、過氧化物還原酶6(peroxiredoxin 6,Prdx6)、硫氧還蛋白-1(thioredoxin-1,Trx1)、Lamin B1抗體,均購自Santa Cruz;丙二醛(malondialdehyde,MDA)測定試劑盒、超氧化物歧化酶(superoxide dismutase,SOD)測定試劑盒、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)測定試劑盒,均購自南京建成生物工程研究所。
1.1.2儀器 蛋白電泳儀、轉膜儀、成像儀(Bio-Rad公司);酶標儀(Molecular Devices);高內涵分析儀(Thermo Scientific)。
1.2 細胞培養SH-SY5Y細胞購自中國醫學科學院基礎醫學研究所,用含10% FBS的DMEM/F12培養液,37 ℃、5% CO2條件下培養。
1.3 Aβ25-35模型建立及分組細胞分為正常對照組、Aβ25-35損傷模型組、EGC低劑量組(Aβ25-35+5 μmol·L-1EGC)、EGC中劑量組(Aβ25-35+10 μmol·L-1EGC)、EGC高劑量組(Aβ25-35+20 μmol·L-1EGC)和陽性對照組(Aβ25-35+5 mmol·L-1NAC)。
1.4 MTT法檢測細胞存活率實驗終點,吸除原有培養液,每孔加入100 μL 0.5 g·L-1MTT溶液,培養4 h后吸除MTT,加入100 μL DMSO振蕩5 min,490 nm測定吸光度,計算細胞存活率。
1.5 LDH釋放率考察細胞活力實驗終點,取細胞上清,采用試劑盒檢測LDH,具體操作按照試劑盒說明書進行。
1.6 細胞活性氧(reactive oxygen species,ROS)的檢測實驗終點,傾去細胞培養液,PBS洗滌1次,每孔加入50 μL終濃度為10 μmol·L-1DCFH-DA和10 μg·mL-1Hoechst 33258的DMEM/F12培養基。30 min后PBS洗滌3次,之后用高內涵細胞分析系統檢測ROS水平。
1.7 氧化應激標志物檢測實驗終點,取細胞上清,采用試劑盒檢測SOD、MDA和GSH-Px,具體操作按照試劑盒說明書進行。
1.8 Western blot法檢測蛋白表達變化實驗終點,用胞核胞質蛋白抽提試劑盒,分別提取核蛋白和細胞總蛋白,進行SDS-PAGE電泳,轉印至PVDF膜后,置于5% BSA室溫封閉2 h。然后用稀釋的Nrf2、NQO-1、HO-1、Prdx6、Trx1抗體,于4 ℃孵育過夜。之后,TBST洗滌3次,再加入稀釋后二抗室溫孵育2 h,TBST洗滌3次后顯色成像。
1.9 免疫熒光法檢測Nrf2的核轉位實驗終點,吸除原培養液,PBS洗滌1次后,每孔加入50 μL多聚甲醛溶液固定15 min;PBS洗滌1次,每孔加入50 μL 0.3% Triton-100孵育10 min;PBS洗滌1次,每孔加入50 μL 5% BSA室溫封閉2 h;之后每孔加入50 μL Nrf2抗體稀釋液孵育過夜;回收一抗后,用PBS洗滌3次,然后加入熒光二抗稀釋液,37 ℃孵育1.5 h;PBS洗滌3次后,加入Hoechst 33258避光孵育30 min;最后PBS洗滌1次,置于高內涵分析儀進行檢測。

2 結果
2.1 EGC對Aβ25-35損傷SH-SY5Y細胞活力的影響如Fig 1A所示,與正常對照組相比,3 μmol·L-1Aβ25-35損傷SH-SY5Y細胞24 h后,細胞活力明顯降低(P<0.01)。EGC(10、20 μmol·L-1)和抗氧化陽性藥NAC(5 mmol·L-1)能夠逆轉Aβ25-35對SH-SY5Y細胞造成的損傷,明顯提高細胞存活率(P<0.05,P<0.01)。如Fig 1B所示,Aβ25-35明顯提高SH-SY5Y細胞LDH的釋放(P<0.01),EGC(5、10、20 μmol·L-1)和NAC(5 mmol·L-1)能夠明顯降低Aβ25-35誘導的LDH釋放(P<0.05,P<0.01)。
2.2 EGC抑制Aβ25-35誘導的SH-SY5Y細胞ROS的產生如Fig 2所示,3 μmol·L-1Aβ25-35損傷SH-SY5Y細胞后,細胞中ROS釋放量明顯增加(P<0.01),10、20 μmol·L-1EGC均能明顯抑制Aβ25-35損傷導致的ROS釋放(P<0.01)。
2.3 EGC調節Aβ25-35損傷SH-SY5Y細胞中氧化應激標志物的釋放如Tab 1所示,與正常對照組相比,Aβ25-35損傷導致SH-SY5Y細胞中SOD和GSH-Px活性明顯降低,MDA含量明顯升高(P<0.01)。EGC能夠明顯提高SOD和GSH-Px活性,減少MDA含量,抑制氧化應激損傷。
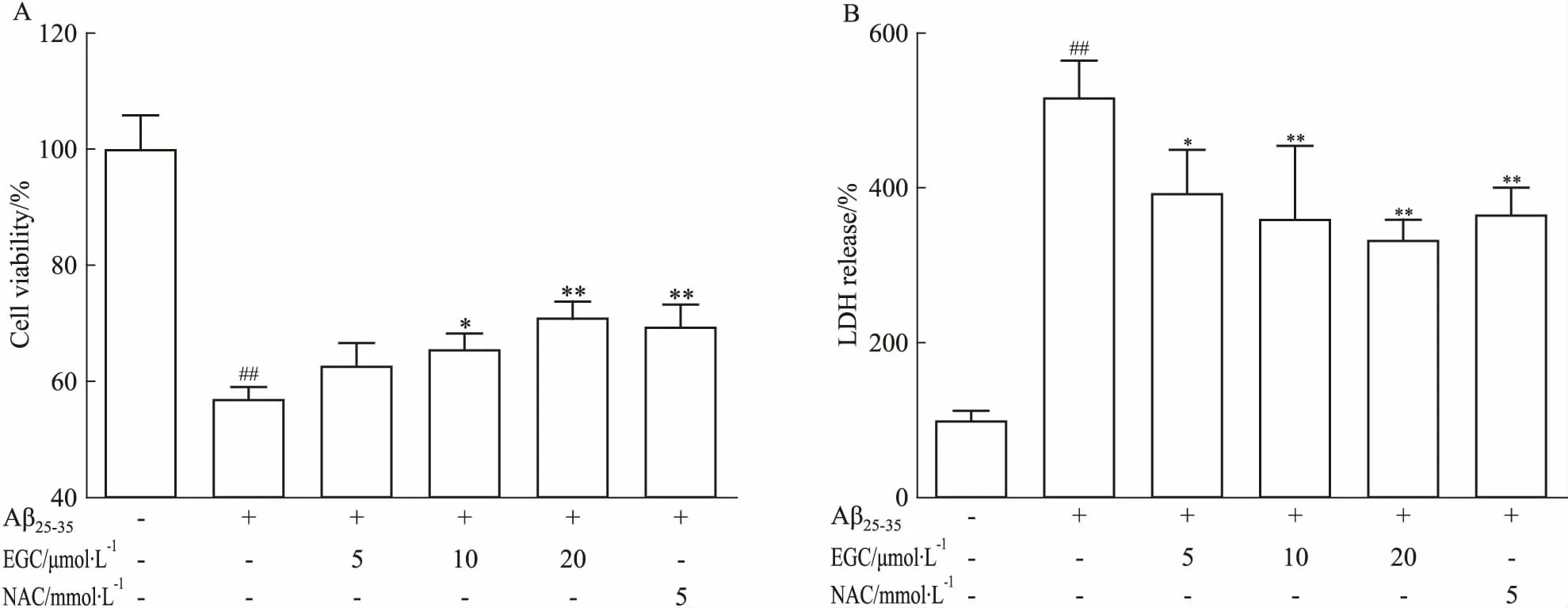
Fig 1 Effects of EGC on Aβ25-35-induced cytotoxicity in SH-SY5Y cells
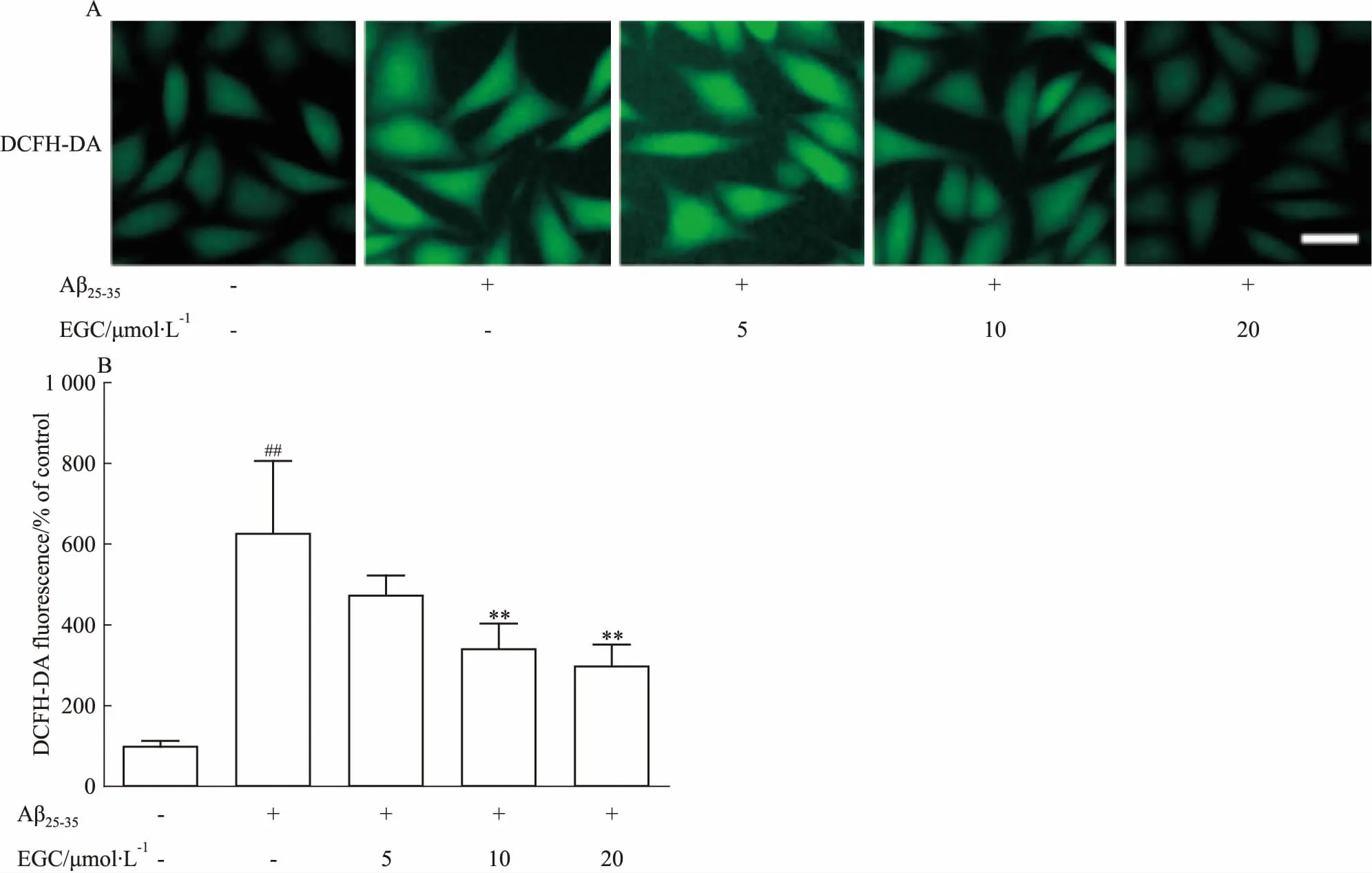
Fig 2 Effects of EGC on Aβ25-35-induced ROS accumulation in SH-SY5Y cells
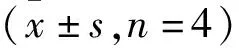
Tab 1 Effects of EGC on SOD, GSH-Px, MDA in Aβ25-35-induced SH-SY5Y cells
2.4 EGC對Aβ25-35損傷SH-SY5Y細胞Nrf2核轉位的影響采用Western blot和免疫熒光檢測SH-SY5Y細胞內Nrf2核轉位情況,結果如Fig 3所示,正常SH-SY5Y細胞核中Nrf2水平較低,Aβ25-35損傷后SH-SY5Y細胞核中Nrf2蛋白水平略有增加。EGC干預能夠明顯增強Aβ25-35損傷后Nrf2的核轉位。
2.5 EGC對Aβ25-35損傷SH-SY5Y細胞Nrf2下游抗氧化蛋白表達的影響采用Western blot檢測SH-SY5Y細胞內Nrf2下游抗氧化蛋白的表達情況,如Fig 4所示,EGC干預后能夠明顯增強Aβ25-35損傷后Nrf2誘導的II相輔酶HO-1、NQO1、Prdx6和Trx1的表達,提高細胞的抗氧化能力。
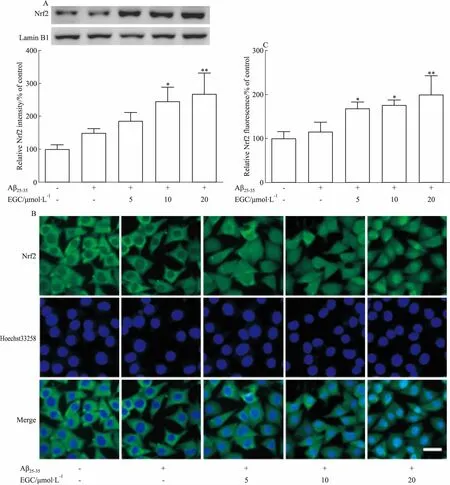
Fig 3 Effects of EGC on Nrf2 levels in Aβ25-35-treated SH-SY5Y cells

Fig 4 Effects of EGC on HO-1, NQO1, Prdx6, Trx1 levels in Aβ25-35-treated SH-SY5Y cells
3 討論
本實驗采用Aβ25-35損傷SH-SY5Y細胞模型,探討EGC對Aβ25-35損傷SH-SY5Y細胞氧化應激的影響。3 μmol·L-1Aβ25-35損傷SH-SY5Y細胞24 h后,細胞存活率明顯降低,LDH釋放明顯增加。EGC能夠減輕Aβ25-35誘導的SH-SY5Y細胞損傷,提高細胞存活率,降低LDH釋放。
氧化應激損傷是指機體抗氧化水平低于氧化水平,氧化中間產物在體內聚積,打破抗氧化與氧化平衡,造成機體損傷,誘發多種疾病[9-10]。研究表明,氧化應激在AD病理生理過程中發揮著重要作用[11-12]。Nrf2是細胞發生氧化應激反應的關鍵調節因子,對維持細胞內氧化還原水平至關重要[14-15]。本文實驗結果表明,Aβ25-35損傷能夠明顯增加SH-SY5Y細胞ROS水平,而EGC可以明顯降低Aβ25-35誘增的細胞內ROS。正常生理狀態下,Nrf2-Keap1處于抑制狀態,Aβ25-35損傷后SH-SY5Y細胞ROS水平明顯增加,Nrf2-Keap1被激活發生解離,解離后的Nrf2蛋白在細胞核中聚集,促進SOD、GSH-Px及HO-1等下游產物增多[16-17]。
SOD在新陳代謝中起重要作用,能夠特異性清除氧自由基,使細胞免受氧化應激損傷。GSH-Px也可以減少過氧化物在細胞內堆積,維持細胞正常生理功能。對抗氧化酶水平,Aβ25-35損傷后明顯降低SH-SY5Y細胞中SOD和GST-Px的活性,而EGC可以明顯升高SOD和GSH-Px活性。MDA是脂質過氧化終產物,可影響線粒體呼吸鏈中關鍵酶的活性,常用于評估氧化應激反應程度和自由基水平[13]。本實驗結果表明,與對照組相比,Aβ25-35損傷導致脂質過氧化產物MDA積累,而EGC可以明顯降低Aβ25-35誘增的MDA含量。采用Western blot和免疫熒光檢測了SH-SY5Y細胞核中Nrf2蛋白表達。正常SH-SY5Y細胞核中Nrf2呈弱陽性表達,Aβ25-35損傷使細胞核中Nrf2蛋白水平略有增加,但與正常對照組相比差異不明顯。EGC干預能夠明顯增強Aβ25-35損傷后Nrf2核轉位。檢測Nrf2-Keap1通路下游II相輔酶的表達水平表明,EGC處理能夠明顯增強Aβ25-35損傷后Nrf2誘導的II相輔酶HO-1、NQO1、Prdx6和Trx1的表達。SOD、GSH-Px、HO-1、NQO1、Prdx6和Trx1協同清除ROS,保護細胞免受氧化應激損傷。
綜上所述,表沒食子兒茶素能夠激活Nrf2-Keap1通路,調節氧化應激反應中相關酶的活性,阻斷Aβ25-35導致的ROS產生,提高SOD和GSH-Px活性,減少MDA含量,提高機體抗氧化水平,改善氧化損傷,降低Aβ25-35的神經毒性。