基于分子標記技術的苦瓜育種材料遺傳多樣性快速分析
王國莉
(惠州學院 生命科學學院,廣東 惠州 516007)
苦瓜(MomordicacharantiaL.)是葫蘆科苦瓜屬1年生攀緣草本,主要分布于熱帶、亞熱帶和溫帶地區[1-2]。苦瓜是一種藥食兩用植物,在中國及世界其他國家都有藥用歷史[3-5]。苦瓜的形態學分類可以依據栽培方式[6]、果皮顏色以及果實大小等標準進行。張長遠等[7]依據瓜的大小和瓜瘤形狀,把苦瓜分為麻點苦瓜和滑身苦瓜。黃月琴[8]根據瓜形將苦瓜分為長棒形、短棒形、棒形、圓錐形、紡錘形5類。張鳳銀等[9]從形態學上研究44份苦瓜的26個性狀發現,它們的果形、果色、單瓜種子數、瓜瘤大小和單瓜質量差異大。黃如葵等[10]通過對33份苦瓜28個形態學性狀的聚類分析,將所有材料分為3大類群。黃月琴等[11]從表型性狀上分析46份苦瓜的31個性狀,得出變異系數為5.39%~89.96%,并將其歸為4大類群。張燕等[12]采用調查和多元統計分析相結合的方法,對51份苦瓜材料進行分析,發現23個性狀的變異系數為5.88%~47.90%,并指出其性狀和果實品質有關聯,聚類分析將51份苦瓜分為5大類群。雖然從形態學上分析苦瓜的遺傳多樣性具有經濟簡單的優點,但這種方法也需要耗費大量的時間和精力,而且季節因素、環境因素、栽培方法以及觀察者的實際經驗也會影響結果的準確性。所以單純利用形態學指標并無法準確揭示不同苦瓜材料間的差異性以及遺傳規律。
目前,分子標記技術已經在遺傳育種、遺傳多樣性分析、基因組作圖、物種鑒定等方面廣泛應用,多種分子標記技術被應用于包括苦瓜在內的葫蘆科植物的遺傳分析中。汪自松[13]應用簡單序列重復(Simple sequence repeats,SSR)、序列相關擴增多態性(Sequence related amplified polymorphism,SRAP)和擴增片段長度多態性(Amplified fragment length polymorphism,AFLP )3種分子標記技術,構建了苦瓜子二代的遺傳圖譜。王莎[14]開發出400對瓠瓜SSR引物,并從中篩選出200對,對苦瓜、絲瓜、南瓜和西瓜進行PCR擴增以及親緣關系的比較分析。楊衍等[15]選用8對AFLP引物對36份苦瓜進行PCR擴增,共擴增出1 142條條帶,多態性條帶992條,說明供試苦瓜的變異性強,聚類分析將36份苦瓜分為2個類群。SRAP作為一種新型的分子標記具有很多優點,現已被應用到遺傳多樣性分析和品種鑒定等方面[16]。張景云等[17]應用SRAP和SSR標記技術分析了46份苦瓜的遺傳多樣性,遺傳相似系數為0.656時,可將供試苦瓜分為4大類。趙秀娟等[18]用61對SRAP引物將43份苦瓜分為2大類群。劉萌芽等[19]采用正交設計試驗優化了苦瓜SRAP-PCR的反應體系。SSR技術現已被廣泛應用到物種的鑒定、基因組作圖、遺傳多樣性分析等方面。WANG[20]設計出33對SSR引物用來擴增37份供試苦瓜,最后開發出12對SSR引物,共擴增出36條條帶,平均每對引物擴增3條。王心迪等[21]用正交分析法優化了苦瓜SSR標記的PCR反應體系。王國莉等[22]應用SSR和SRAP技術鑒別苦瓜品種,采用8對SSR引物對11個苦瓜品種進行擴增,共擴增出860條帶,多態性條帶比率為68.0%,最少用3對SSR引物即可區分出11個苦瓜品種。李光光等[23]應用SSR和SRAP標記分析46份苦瓜種質資源遺傳多樣性,分別擴增出70、637條條帶,多態性條帶分別為60、90條,表明供試苦瓜具有豐富的遺傳多樣性,并將其歸為4類。
雖然已有研究對SSR和SRAP分子標記技術的反應體系進行了優化,并將其應用于苦瓜材料的遺傳多樣性分析和品種鑒定中[19-23],但如何高效和即時分析苦瓜育種材料的親緣關系和遺傳多樣性,依然是分子標記輔助苦瓜育種的重要研究課題。鑒于此,采用一管式植物DNAout試劑盒法,從苦瓜種子中快速提取基因組DNA,并采用11對SSR引物和13對SRAP引物分別對10份苦瓜材料基因組進行PCR擴增,并對苦瓜材料的遺傳多樣性進行分析,為實現分子標記輔助選擇苦瓜育種提供借鑒。
1 材料和方法
1.1 試驗材料
供試10份苦瓜材料均來源于廣東惠州市農業科學研究所苦瓜種質資源庫,種植于惠州學院山暉園,2017年11月收種完畢,材料信息見表1。
1.2 方法
1.2.1 苦瓜基因組DNA的快速提取 采用一管式植物DNAout試劑盒(Andy Bio公司)提取苦瓜種子的基因組DNA。該方法快速提取的DNA不能用電泳方法檢測,只能作為PCR反應擴增模板。在離心管中加入0.1 mL 37 ℃恒溫下已經完全溶解的溶液A。將苦瓜種子搗碎,取一碎片(約1/4粒豌豆大小)加入離心管中。將離心管置于95 ℃下保溫10~15 min,保溫時間一定要足夠,否則易產生非特異性擴增。保溫結束后不用離心,直接取上清液作為模板進行PCR反應,模板的體積占PCR反應體積的1/10為宜。剩余樣品置于4 ℃保存。
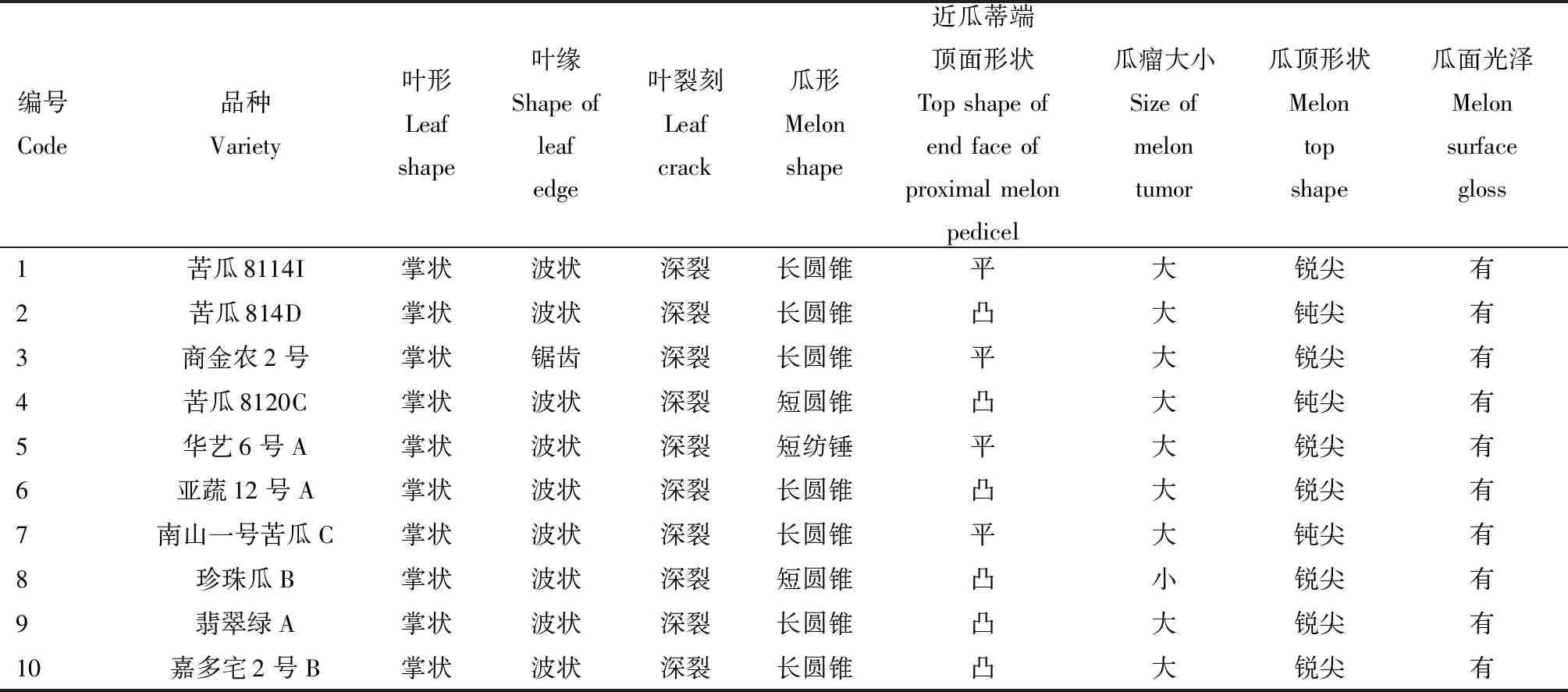
表1 供試苦瓜材料信息
1.2.2 苦瓜SSR-PCR反應體系 SSR-PCR體系參照WANG[20]和王國莉等[22,24]建立的體系,并進一步優化而成,PCR體系25 μL,成分及用量見表2。
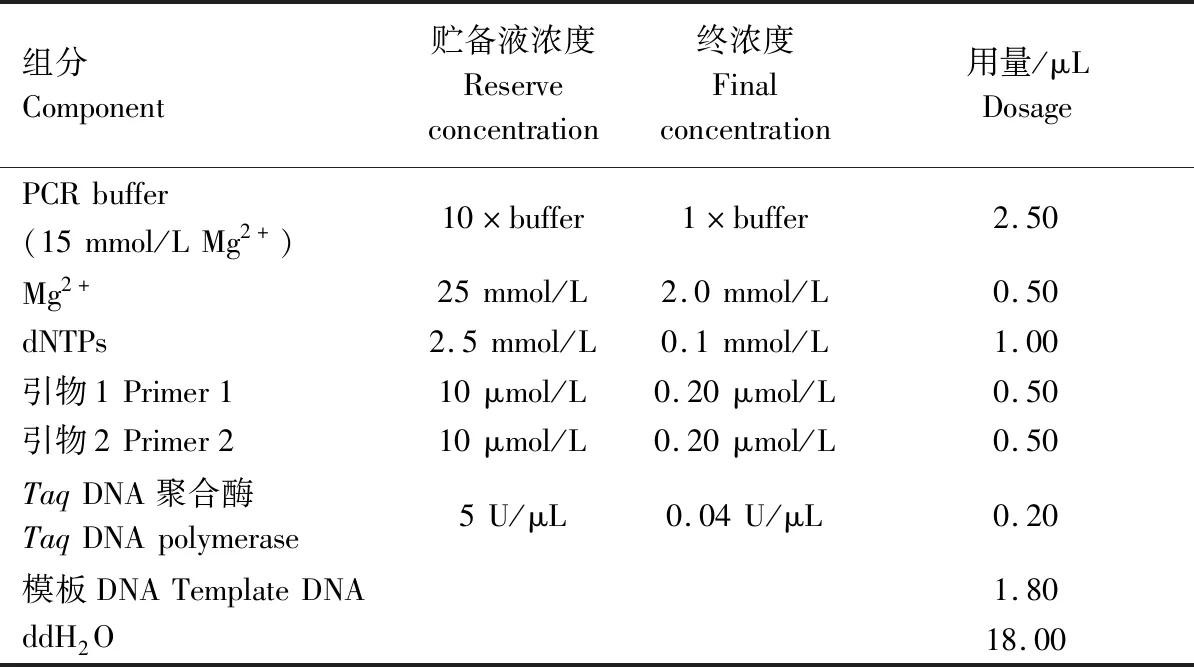
表2 苦瓜SSR-PCR反應體系
PCR擴增程序:94 ℃變性4 min;94 ℃變性40 s,55 ℃退火45 s,72 ℃延伸40 s,35次循環;72 ℃延伸7 min;4 ℃保存[22]。
1.2.3 苦瓜SRAP-PCR反應體系 SRAP-PCR體系參照王國莉等[22,24]建立的體系,并進一步優化而成,PCR反應體積25 μL,成分及用量見表3。
PCR擴增程序:94 ℃變性5 min;94 ℃變性1 min、35 ℃復性1 min、72 ℃延伸1 min,5次循環;94 ℃變性1 min、50 ℃復性1 min、72 ℃延伸 1 min,35次循環;72 ℃延伸10 min;4 ℃保存[22]。
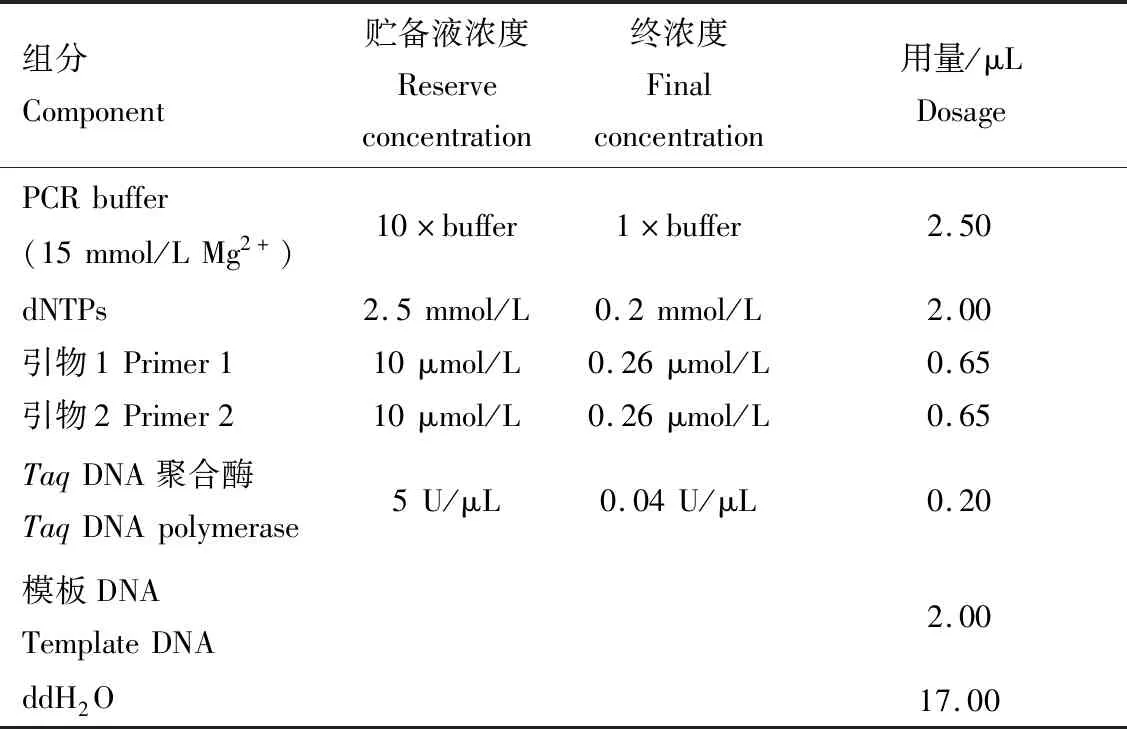
表3 苦瓜SRAP-PCR 反應體系
1.2.4 SSR標記擴增引物 SSR標記擴增引物參照WANG[20]設計的引物序列,11對SSR引物序列如表4所示。
1.2.5 SRAP標記擴增引物 13對SRAP標記擴增引物組合和序列如表5所示。
1.2.6 PCR產物的檢測 選用6%聚丙烯酰胺凝膠電泳分離PCR產物,0.1% AgNO3溶液染色,顯色后拍照記錄結果。
1.3 數據處理
電泳得到的條帶代表基因位點,采用二元性狀對每一個基因位點進行編碼,用“1”表示等位基因存在,用“0”表示等位基因不存在,形成矩陣。
利用軟件NTSYS-pc2.10e計算供試苦瓜材料之間的遺傳相似系數并進行聚類分析。

表4 SSR標記擴增引物

表5 SRAP標記擴增引物
2 結果與分析
2.1 SSR和SRAP標記的擴增結果
采用一管式植物DNAout試劑盒法,可以從苦瓜種子中快速提取基因組DNA,相比于CTAB(十六烷基三甲基溴化銨)、SDS(十二烷基苯磺酸鈉)等傳統的DNA提取方法,提取步驟簡單、耗時短,在1個離心管內,只需20 min左右即可提取完畢。但是,該方法提取的DNA因濃度較低不適宜直接用電泳檢測,所以濃度存在未知性。
2.1.1 SSR標記擴增結果 部分SSR引物擴增結果見圖1。從圖1可知,擴增條帶的分子質量主要介于100~1 000 bp。利用11對SSR引物擴增10份苦瓜材料并進行條帶統計,結果見表6。從表6可知,11對SSR引物共擴增出195條條帶,其中,多態性條帶164條,每對引物擴增的條帶數介于12~28條不等,平均每對引物擴增17.7條,各對引物擴增的條帶多態性比率介于66.7%~100.0%,平均多態性條帶比率為85.7%,說明SSR分子標記的多態性較高。N6F/N6R擴增出22條多態性條帶,數量最多;S9F/S9R擴增出的多態性條帶最少,只有10條。擴增出多態性條帶比率最高的引物對為N1F/N1R、N5F/N5R和S24F/S24R,均為100.0%;擴增出多態性條帶比率最低的引物組合為S33F/S33R,僅為66.7%。
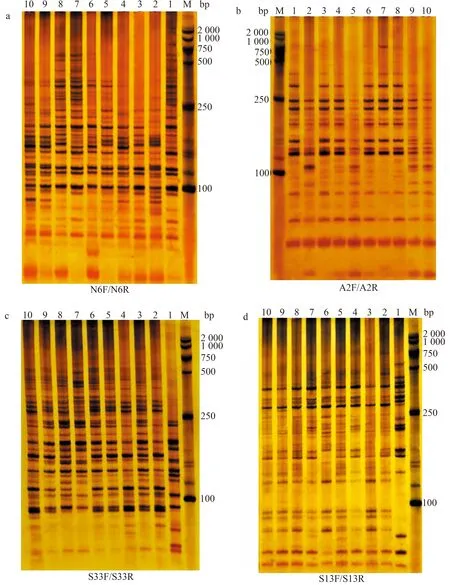
數字1—10代表苦瓜材料編號(表1),圖2—5同;M.DL2000 DNA marker;a、b、c、d分別代表不同引物的擴增結果,圖2同
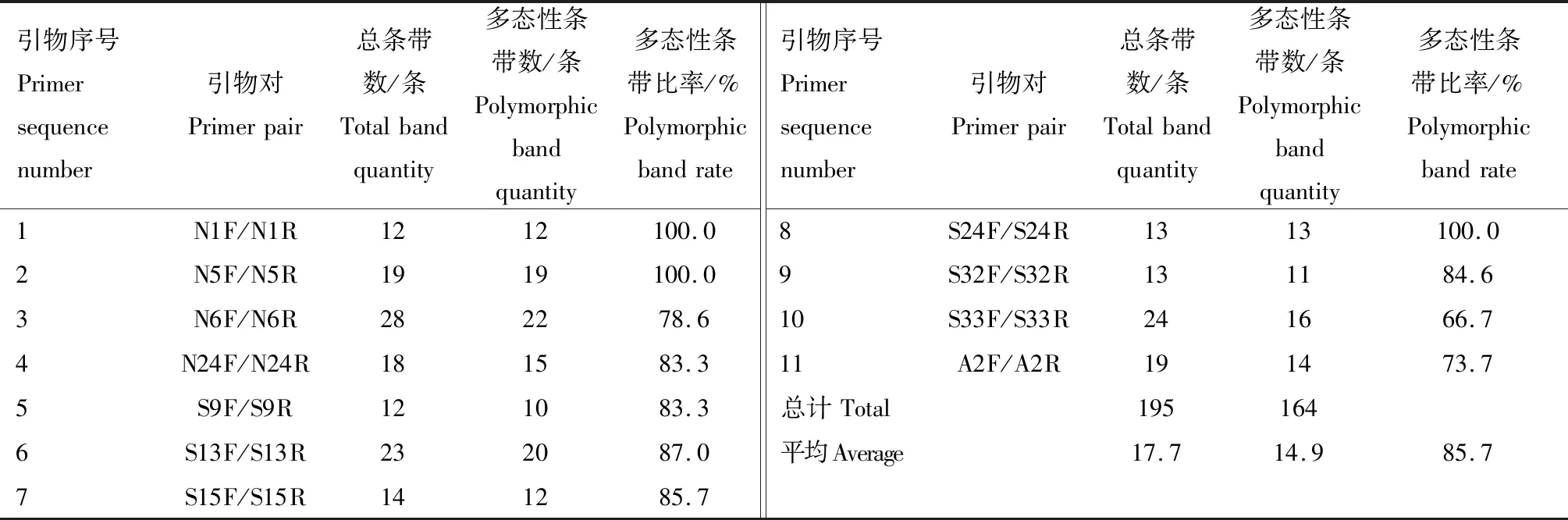
引物序號Primersequencenumber引物對Primerpair總條帶數/條Totalbandquantity多態性條帶數/條Polymorphicbandquantity多態性條帶比率/%Polymorphicbandrate引物序號Primersequencenumber引物對Primerpair總條帶數/條Totalbandquantity多態性條帶數/條Polymorphicbandquantity多態性條帶比率/%Polymorphicbandrate1N1F/N1R1212100.08S24F/S24R1313100.02N5F/N5R1919100.09S32F/S32R131184.63N6F/N6R282278.610S33F/S33R241666.74N24F/N24R181583.311A2F/A2R191473.75S9F/S9R121083.3總計Total1951646S13F/S13R232087.0平均Average17.714.985.77S15F/S15R141285.7
2.1.2 SRAP標記擴增結果 部分SRAP引物擴增結果見圖2。由圖2可知,擴增條帶的分子質量主要介于100~1 000 bp。利用13對SRAP引物擴增10份苦瓜材料并進行條帶統計,結果見表7。從表7可知,13對SRAP引物共擴增出231條條帶,其中,多態性條帶201條,每對引物擴增的條帶為13~23條,平均每對引物擴增17.8條,各對引物擴增的條帶多態性比率介于73.9%~100.0%,平均多態性條帶比率為87.5%,說明SRAP分子標記的多態性較高。me9/em11引物組合擴增出20條多態性條帶,多態性條帶數量最多,且多態性比率也最高,為100.0%;me5/em1和me6/em1引物組合僅擴增出12條多態性條帶,數量最少;多態性條帶比率最低的引物對為me9/em14,僅為73.9%。
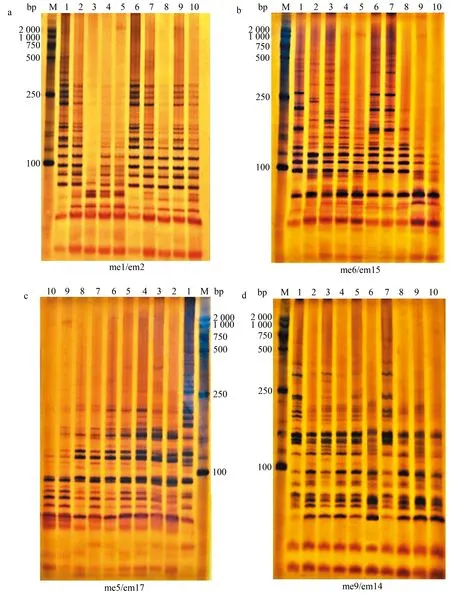
圖2 SRAP標記擴增結果
以上結果說明,采用優化后的SSR和SRAP反應體系對苦瓜材料進行擴增,均能獲得豐富的多態性條帶,說明此方法可以用于快速分析苦瓜的遺傳多樣性,提高分子標記輔助選擇的效率。
2.2 苦瓜材料的遺傳多樣性分析
2.2.1 基于SSR標記的苦瓜遺傳多樣性分析
2.2.1.1 遺傳相似系數 對SSR標記的擴增結果進行分析計算,得到10份苦瓜材料的遺傳相似系數,結果見表8。從表8可以看出,10份苦瓜材料的遺傳相似系數介于0.533~0.845,平均為0.690。苦瓜8114I(品種1)和苦瓜814D(品種2)的遺傳相似系數最小,為0.533;翡翠綠 A(品種9)和嘉多宅2號B(品種10)的遺傳相似系數最大,為0.845。
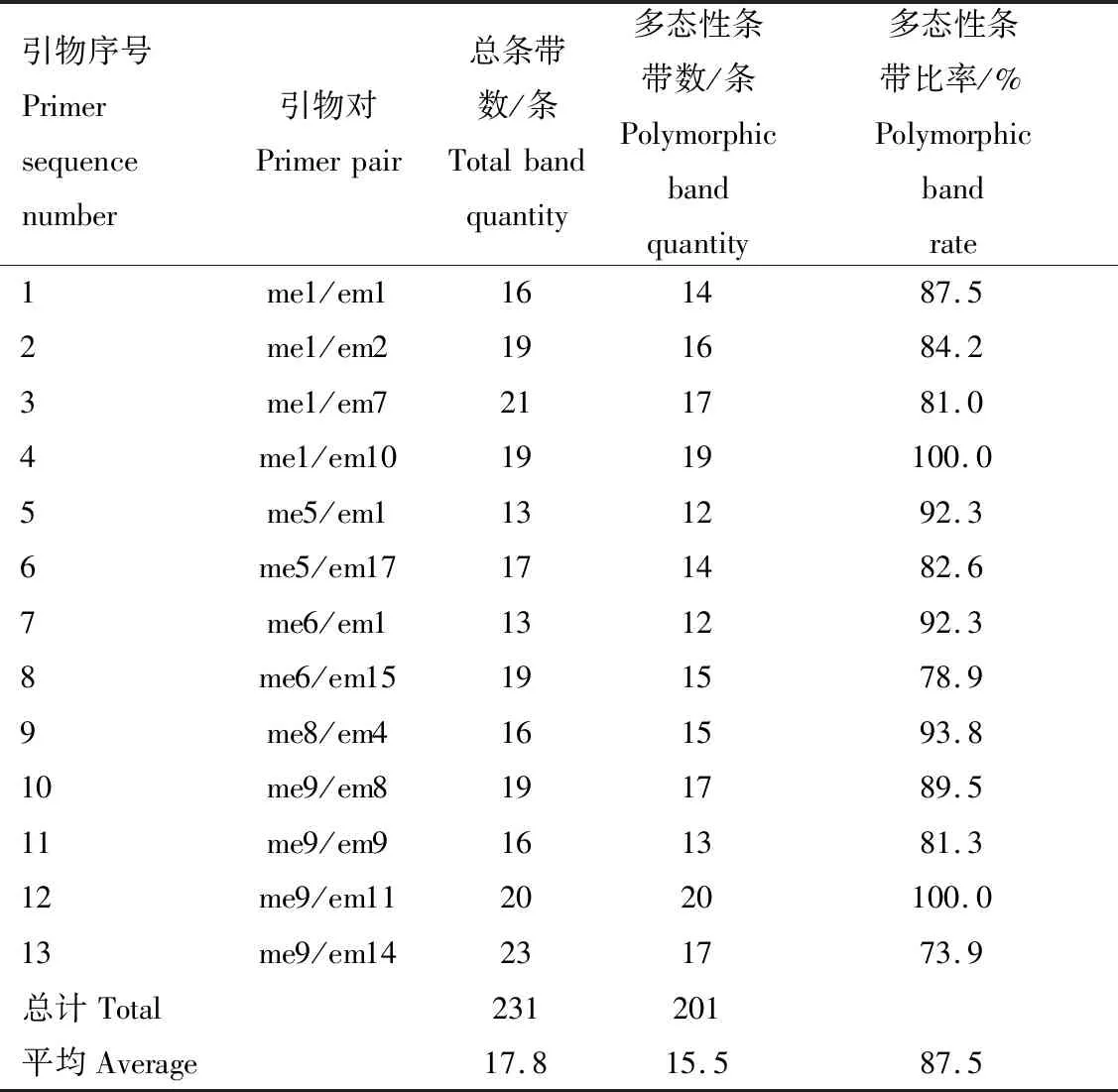
表7 SRAP引物擴增信息
2.2.1.2 聚類分析 如圖3所示,在閾值0.69處,可將10份苦瓜育種材料分為2大類群。第1類群有6個材料:苦瓜8114I(品種1)、商金農2號(品種3)、華藝6號A(品種5)、亞蔬12號A(品種6)、珍珠瓜B(品種8)、南山一號苦瓜C(品種7),此大類除南山一號苦瓜C的瓜頂形狀為鈍尖外,其余都為銳尖,除珍珠瓜B外,瓜瘤大小都表現為大瓜瘤。第2類群包含4個材料:苦瓜814D(品種2)、翡翠綠A(品種9)、嘉多宅2號B(品種10)、苦瓜8120C(品種4),此大類葉形均為掌狀,葉緣呈波狀,葉裂刻為深裂,瓜面有光澤。
在閾值0.75處,又可將第1類群和第2類群都歸為3個亞類。第1類群的苦瓜8114I為第1亞類;商金農2號和華藝6號A為第2亞類,其遺傳相似系數為0.751;第3亞類包含亞蔬12號A、珍珠瓜B和南山一號苦瓜C,而南山一號苦瓜C又與其他2個品種的親緣關系較遠。第2類群的第1亞類為苦瓜814D;第2亞類包含翡翠綠A和嘉多宅2號B,其遺傳相似系數高達0.845,親緣關系非常相近;苦瓜8120C單獨為第3亞類。
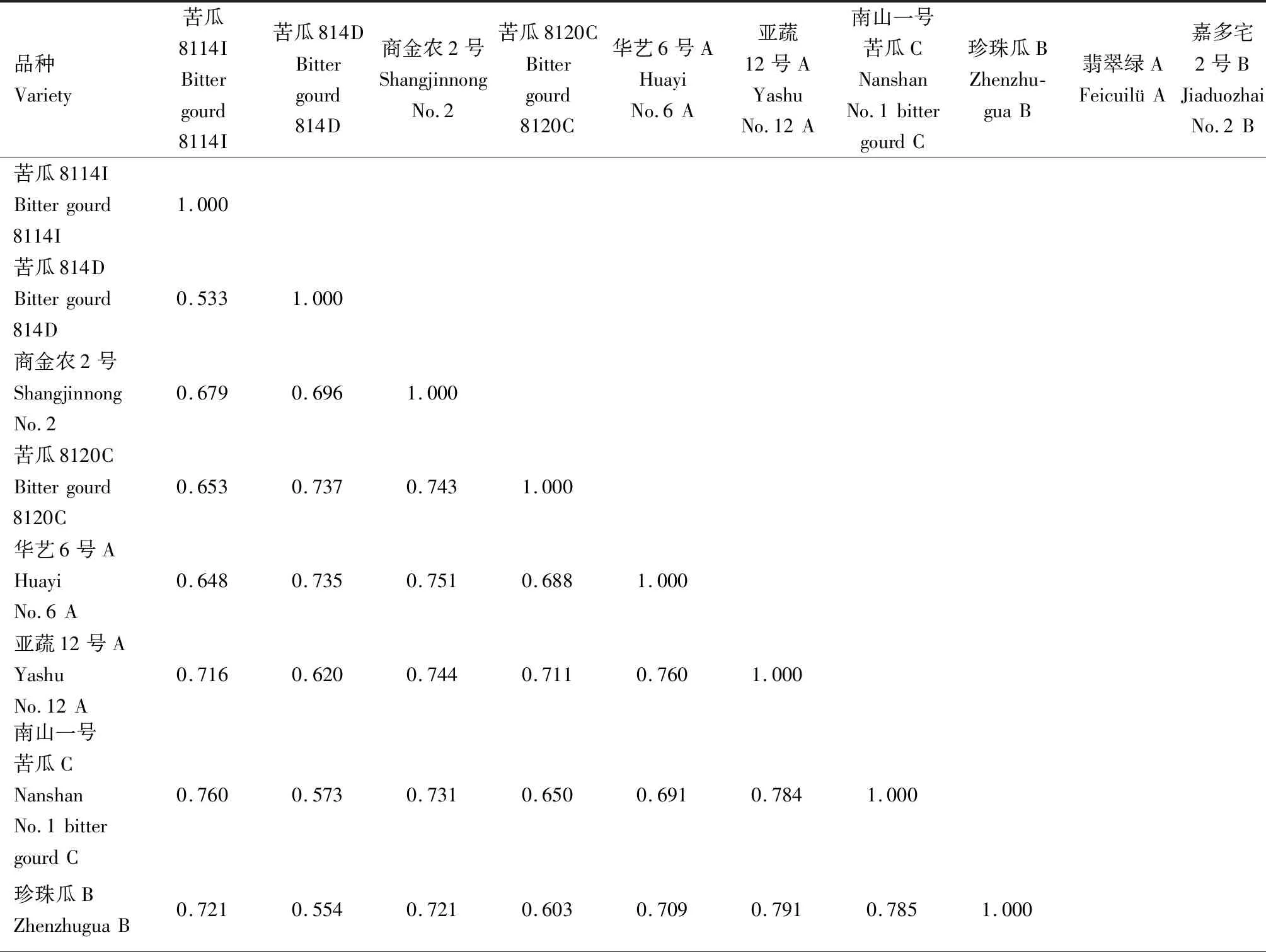
表8 基于SSR標記的苦瓜材料遺傳相似系數
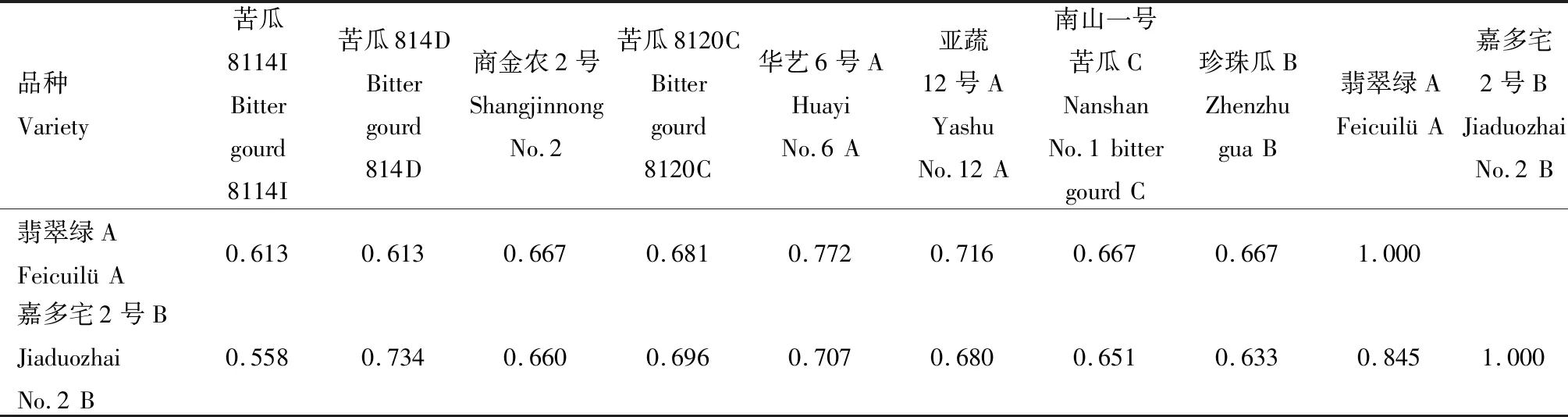
續表8 SSR標記的苦瓜材料遺傳相似系數
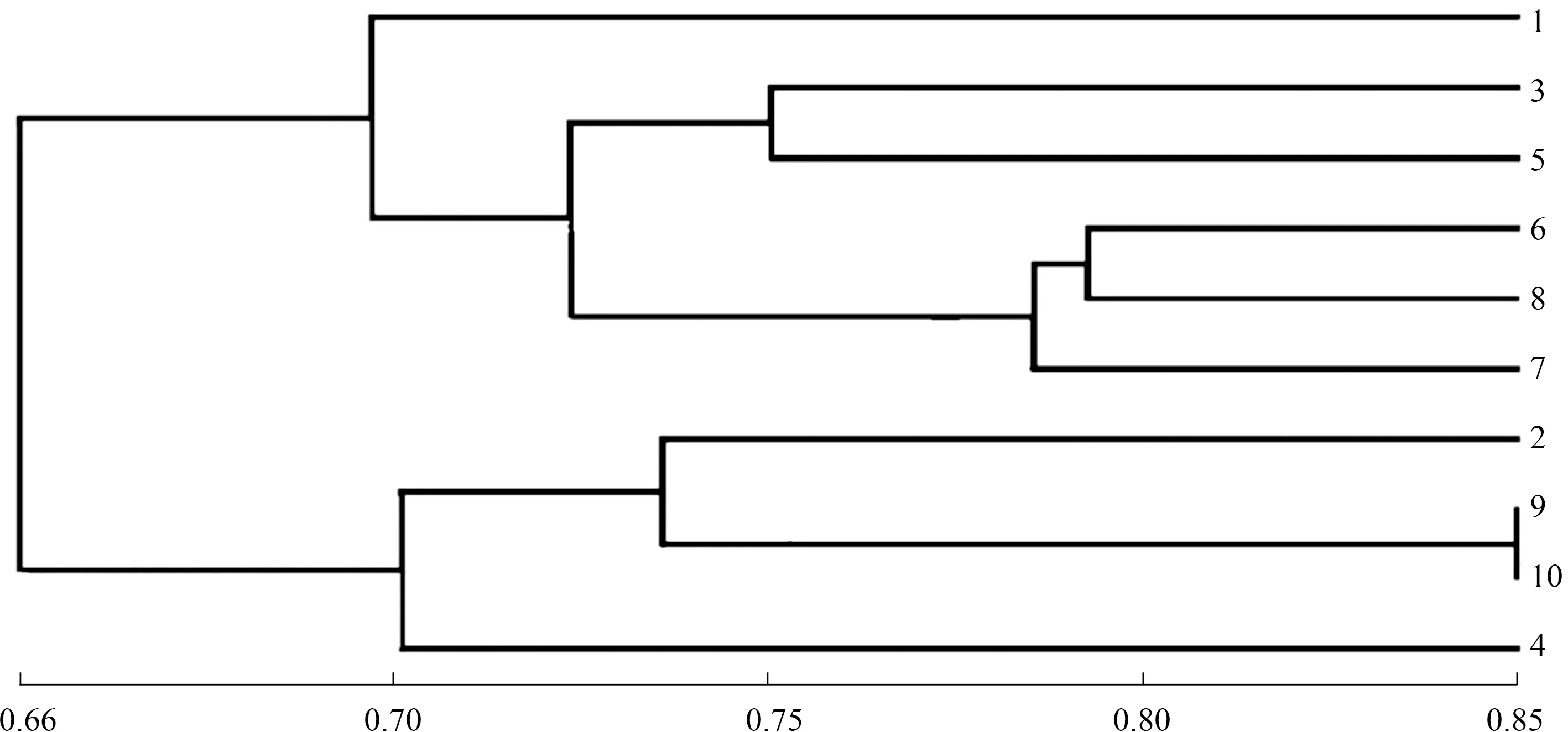
圖3 10份苦瓜材料的SSR聚類分析
2.2.2 基于SRAP標記的苦瓜遺傳多樣性分析
2.2.2.1 遺傳相似系數 對SRAP標記的擴增結果進行分析計算,得到10份苦瓜材料的遺傳相似系數,結果見表9。從表9可以看出,10份苦瓜育種材料的遺傳相似系數介于0.554~0.775,平均值為0.662。苦瓜8114I(品種1)和苦瓜814D(品種2)的遺傳相似系數最小,為0.554;翡翠綠A(品種9)和嘉多宅2號B(品種10)的遺傳相似系數最大,為0.775。
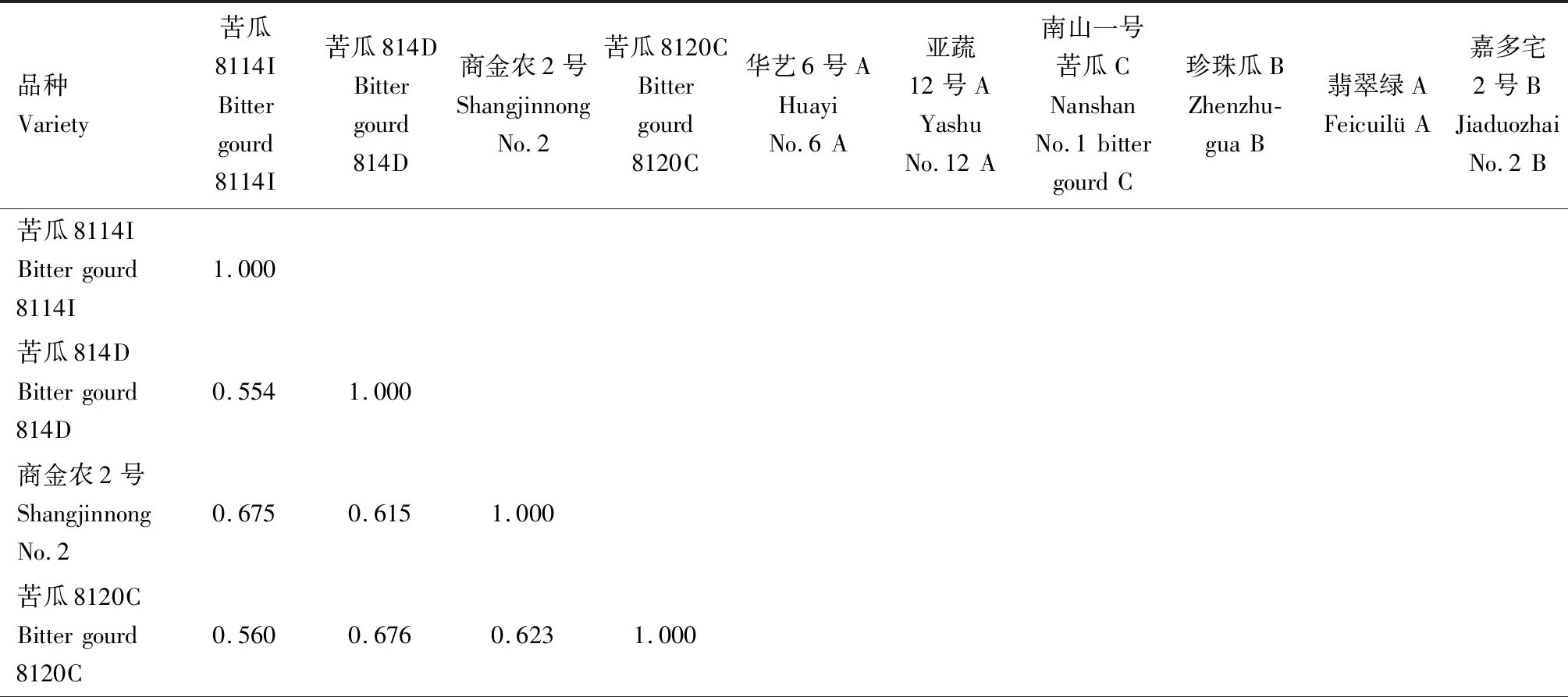
表9 基于SRAP標記的苦瓜材料遺傳相似系數
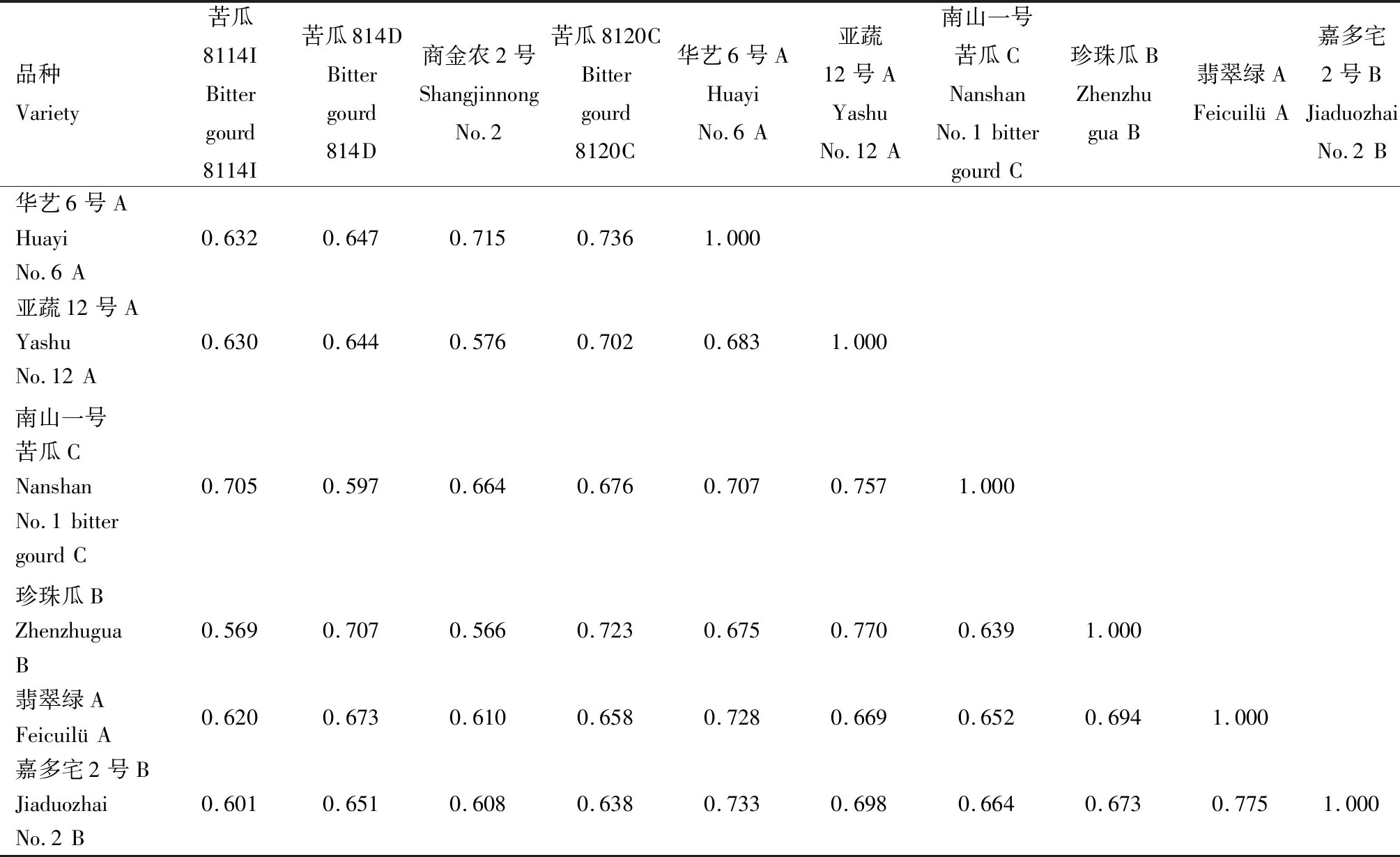
表9 SRAP標記的苦瓜材料遺傳相似系數
2.2.2.2 聚類分析 經過聚類分析,建立了基于SRAP的苦瓜材料之間的遺傳關系樹狀圖,結果如圖4所示。由圖4可以看出,在閾值0.66處,可將10份苦瓜育種材料歸為2大類群。第1類群包含苦瓜8114I(品種1)、南山一號苦瓜C(品種7)和商金農2號(品種3),其中,商金農2號與該類群其他2個品種的親緣關系較遠,此大類瓜瘤稀疏、大,且瓜瘤呈條狀,近瓜蒂端瓜面形狀平,瓜形為長圓錐;第2類群包含苦瓜814D(品種2)、苦瓜8120C(品種4)、華藝6號A(品種5)、亞蔬12號A(品種6)、珍珠瓜B(品種8)、翡翠綠A(品種9)、嘉多宅2號B(品種10),此大類葉色深綠,掌狀葉,葉裂刻為深裂。
在閾值0.70處,第1類群又可分為2個亞類,第1亞類包含苦瓜8114I、南山一號苦瓜C,其遺傳相似系數為0.705;第2亞類僅有商金農2號。遺傳相似系數為0.70時,第2類群可歸為4個亞類,苦瓜814D單獨為第1亞類;苦瓜8120C和華藝6號A聚為第2亞類;亞蔬12號A和珍珠瓜B為第3亞類,遺傳相似系數達到0.770;第4亞類包含翡翠綠A和嘉多宅2號B,遺傳相似系數高達0.775。
2.2.3 綜合SSR和SRAP標記分析苦瓜材料的遺傳多樣性 采用2種標記綜合分析10份苦瓜材料的遺傳多樣性結果見表10和圖5。從遺傳相似系數上看,SSR標記技術得到的遺傳相似系數在0.533~0.845,平均值為0.690;SRAP標記技術得到的遺傳相似系數在0.554~0.775,平均值為0.662。可見SSR檢測的遺傳距離變異幅度比SRAP大。結合SSR和SRAP 2種標記技術分析發現,遺傳相似系數介于0.554~0.808,與兩者單獨分析得到的結果非常接近。SSR和SRAP標記技術均檢測出亞蔬12號A和珍珠瓜B、翡翠綠A和嘉多宅2號B 2組品種間的遺傳相似系數較大,這與兩者綜合分析的結果是一致的,其中翡翠綠A和嘉多宅2號B的遺傳相似系數最大(SSR為0.845,SRAP為0.775),親緣關系最接近;且2種標記技術都檢測到苦瓜8114I和苦瓜814D的遺傳相似系數最小(SSR為0.533,SRAP為0.554),親緣關系最遠,同樣地,對表10中SSR和SRAP綜合分析得出了相同的結論。
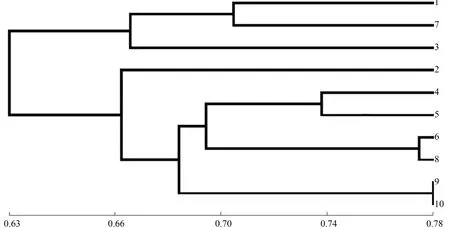
圖4 10份苦瓜材料的SRAP聚類分析Fig.4 Cluster analysis of 10 bitter gourd materials based on SRAP marker
從聚類結果看,SSR和SRAP標記技術的聚類結果有相同之處,在閾值0.66處,苦瓜8114I、商金農2號和南山一號苦瓜C均聚為一類,苦瓜814D、苦瓜8120C、翡翠綠A和嘉多宅2號B這4個品種也聚為一類,而且亞蔬12號A和珍珠瓜B聚為一個亞類,翡翠綠A和嘉多宅2號聚為一個亞類,充分說明這些苦瓜品種之間存在相似的遺傳背景。SSR和SRAP技術綜合分析得出的結論與每種標記單獨分析的結果一致,說明應用SSR和SRAP技術分析苦瓜的遺傳多樣性具有較高的一致性與可信度。但2種標記的聚類結果也存在差異,在閾值0.70處,SSR標記將苦瓜8114I單獨聚為一類,而SRAP標記則將苦瓜8114I和南山一號苦瓜C聚為一類;在閾值0.73處,SRAP標記將苦瓜814D單獨聚為一類,而SSR標記則將苦瓜814D和翡翠綠A、嘉多宅2號B聚為一類。這可能是因為SSR是對基因組的高度重復序列進行擴增,而SRAP是對啟動子或內含子區域進行擴增。從聚類分析的信息量考慮,采用SRAP標記獲得的遺傳距離和聚類結果更可靠。
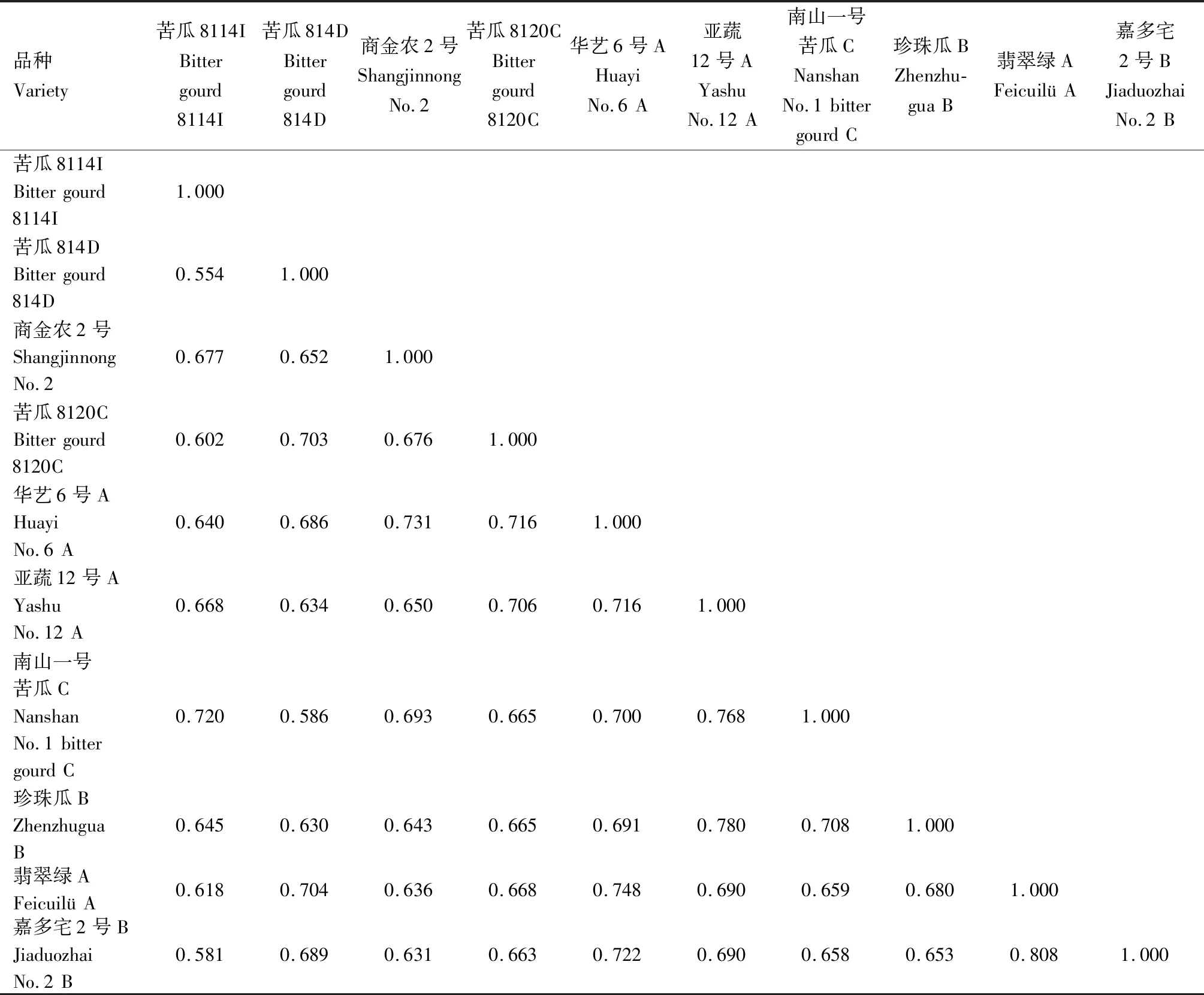
表10 綜合SSR和SRAP標記的苦瓜材料遺傳相似系數
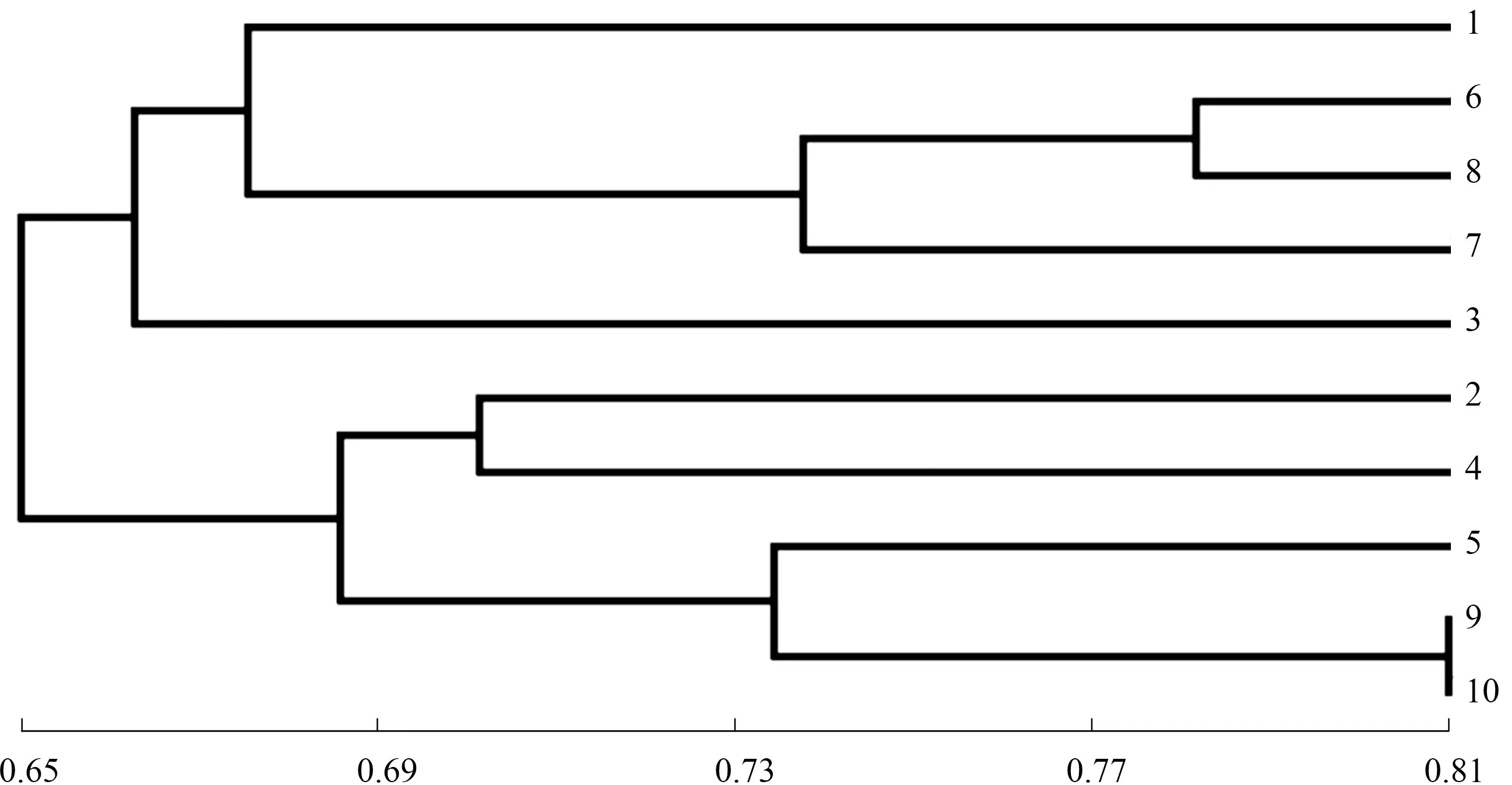
圖5 10份苦瓜材料的SSR和SRAP聚類分析
3 結論與討論
以往對于苦瓜的遺傳多樣性研究,大多為表型性狀的聚類分析,但苦瓜的遺傳背景非常復雜,傳統的形態學研究不能準確地分析苦瓜豐富的遺傳多樣性,因此采用分子標記技術開展苦瓜遺傳多樣性的研究不斷增加。陳禪友等[25]應用簡單序列間重復(Inter-simple sequence repeat,ISSR)技術分析30份苦瓜的遺傳多樣性,將供試苦瓜歸為6大類群,指出苦瓜的遺傳距離與形態學性狀相關聯,且在一定程度上受地域的影響。張景云等[17]研究表明,供試46份苦瓜含有豐富的遺傳信息,可用于遺傳改良和優勢品種的篩選;同時通過聚類分析將供試苦瓜歸為4大類群,與形態學性狀的聚類結果相同,說明SSR和SRAP技術應用于苦瓜遺傳多樣性分析具有可靠性。聚類后發現供試苦瓜的分布具有很強的地域性,與陳禪友等[25]的結論一致。此外,李光光等[23]用SSR標記,高山等[26]采用隨機擴增多態性DNA(Randomly amplified polymorphic DNA,RAPD)標記,王國莉等[22,24]用SSR和SRAP標記開展了苦瓜遺傳多樣性、品種鑒定方面的研究。
本研究采用一管式植物DNAout試劑盒法,從苦瓜種子中快速提取基因組DNA,并經過不斷的試驗優化,成功地獲得了擴增條帶清晰、條帶數量以及多態性豐富的SSR和SRAP擴增體系,為進一步實現2種分子標記技術輔助選擇苦瓜育種奠定了堅實的基礎。雖然本研究的苦瓜樣品僅為10份苦瓜材料,但使用11對SSR引物擴增出195條條帶,多態性條帶164條,平均多態性條帶比率高達85.7%,13對SRAP引物擴增出231條條帶,多態性條帶201條,平均多態性條帶比率高達87.5%,均高于王國莉等[22]、張景云等[17]的研究結果。對比SSR、SRAP、ISSR、RAPD標記技術的擴增結果發現,SSR和SRAP標記技術擴增產物的多態性高于ISSR和RAPD標記技術。當多態性條帶比率大于50%時,可以認為遺傳多樣性是豐富的。本研究揭示了10份苦瓜之間豐富的遺傳多樣性,表明SSR和SRAP技術可應用于苦瓜的遺傳多樣性分析,且結果具有較高的可信度。
本研究發現,SSR和SRAP技術均能擴增出較多的多態性條帶,SRAP擴增的總位點數高于SSR,平均每對引物擴增出的多態性條帶(15.5條)高于SSR(14.9條),且SRAP的平均多態性條帶比率(87.5%)也高于SSR(85.7%),說明SRAP 標記的多態性優于 SSR 標記。但SSR標記的遺傳距離的變異幅度大于SRAP。兩者的聚類分析結果大致相同,但也存在一定的差異,存在差異的原因可能是:(1)SSR擴增的是生物體基因組的高度重復序列,而SRAP是對啟動子、內含子區域進行擴增,兩者的擴增片段不同;(2)檢測位點不足,不能完整反映苦瓜基因組情況,導致譜系偏離;(3)在進行試驗或數據統計時存在誤差,導致聚類結果有偏差,可通過增加擴增引物數量獲得更多條帶來解決這一問題。
本研究建立了一種應用SSR和SRAP技術快速分析苦瓜材料遺傳多樣性的方法,通過對10份苦瓜材料的分析,得到了與形態學標記相關性較高、2種標記相對一致的分類結果,為分子標記輔助選擇苦瓜育種提供了理論和實踐的應用證據,對縮短苦瓜育種進程、推動新品種選育及品種改良研究應用是非常有益的。

