直腸癌組織中miR-144、ROCK-1 mRNA表達變化及其意義
宋志崗,劉帥,郭靜華,連彥軍,宋炳輝
(1 邢臺市第三醫院,河北邢臺054000;2 邢臺市第五醫院)
直腸癌是我國常見的消化系統惡性腫瘤,近年來隨著人們飲食結構的改變,發病率與死亡率有逐漸升高的趨勢,嚴重危害我國人民健康[1]。手術治療、化療等是目前主要治療方案,但直腸癌晚期患者的惡性程度高,治療效果不理想,預后較差,因而,有必要深入研究其發生發展的分子機制[2]。微小RNA(miRNA)是一類小型內源性非編碼RNA,長度約18~25 bp,參與細胞分化、細胞周期及凋亡調控,還可參與炎癥、免疫及腫瘤惡性進展等過程[3]。研究[4]發現,直腸癌組織中存在多種miRNA的異常表達,其可通過結合下游靶基因mRNA的3′端非翻譯區改變mRNA的穩定性,影響靶基因的表達,參與腫瘤細胞增殖、侵襲和遷移等惡性生物學過程。有研究[5]報道,檢測糞便中miR-144表達水平有助于早期診斷結直腸癌。研究[6]表明,miR-144是細胞分化、增殖、凋亡及浸潤轉移過程中的關鍵調節因子,可在轉錄后及翻譯水平調節多種靶基因的表達,而在高級別、進展期惡性腫瘤中,肺腺癌轉移相關轉錄本1作為一種內源競爭性RNA,可進一步抑制miR-144的表達,促進腫瘤細胞的增殖和遠處轉移,與患者不良預后密切有關。研究[7]結果發現,miR-144作為一種腫瘤抑制性miRNA,可抑制細胞增殖并誘導細胞凋亡和自噬。Rho相關卷曲螺旋形成蛋白激酶(ROCK)是一種絲氨酸/蘇氨酸激酶,在小GTP酶RhoA的下游起作用。ROCK的不同亞型與多種細胞功能有關,包括平滑肌收縮、細胞分裂、細胞黏附和運動,其中ROCK-1是介導RhoA信號的關鍵介質,參與細胞收縮、細胞凋亡、遷移和侵襲的信號傳導調節。有研究[8]表明,乳腺癌細胞中RhoA激活ROCK-1可促進腫瘤細胞的遷移和侵襲。因而,miR-144對直腸癌進展的抑制作用可能與ROCK-1有關。本研究通過檢測直腸癌組織中miR-144、ROCK-1 mRNA的表達情況,分析兩者間的相關性及與直腸癌患者臨床病理參數的關系,探討其臨床意義。
1 資料與方法
1.1 臨床資料 選取2016年5月~2018年10月在邢臺市第三醫院診治的直腸癌患者100例,其中男63例、女37例,年齡31~74歲,平均年齡(54.10±6.71)歲;伴遠處轉移者22例、無遠處轉移者78例,腫瘤直徑<5 cm者66例、≥5cm者34例,腫瘤分期Ⅰ期21例、Ⅱ期30例、Ⅲ期23例、Ⅳ期26例,病理分化為高分化者41例、中分化者32例、低分化者27例。所有患者均接受手術切除治療,術中留取癌組織及癌旁組織置于凍存管中,液氮速凍后,轉運至實驗室置于-80 ℃冰箱保存。納入標準[9]:①經腸鏡活檢和(或)術后病理檢查診斷為直腸腺癌。②所有患者均為首次診治,既往未接受過放化療及靶向藥物治療。③臨床病理資料完整,患者及家屬均知情同意并簽署知情同意書。排除標準:①患者有炎性腸病、胰腺炎等消化系統疾病病史。②合并感染性疾病,如急性泌尿系感染、結核菌感染等。③合并其他器官惡性腫瘤。④病理學診斷不明確或臨床病理資料不完整。本研究經本院倫理委員會審核批準通過。
1.2 直腸癌組織及癌旁組織中miR-144、ROCK-1 mRNA檢測方法 采用qRT-PCR法。取20~30 mg的組織標本,TRIzol法提取組織中總RNA。以總RNA為模板,用Taq Man反轉錄試劑盒進行逆轉錄合成cDNA,反應條件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min。實驗步驟嚴格按照反轉錄試劑盒說明書進行。PCR引物和探針均購自ABI生物公司。引物序列如下:miR-144正向引物為5′-GCTGGGATATCATCATATACTG-3′,反向引物為5′-CGGACTAGTACATCATCTATACTG-3′;ROCK-1正向引物為5′-AAG AGAGTGATATTGAGCAGTTGCG-3′,反向引物為5′-TTCCTCTATTTGGTACAGAAAGCCA-3′;內參基因β-actin正向引物為5′-GGTGATCCACATCTGCTGGAA-3′,反向引物為5′-ATCATTGCTCCTCCTCAGGG-3′。熒光定量PCR反應條件為:95 ℃ 20 s,95 ℃ 30 s,60 ℃ 30 s,40個循環。反應均在ABI7500實時定量PCR儀上完成,每個樣本重復3次。以2-ΔΔCt表示目的基因的相對表達量。

2 結果
2.1 直腸癌組織與癌旁組織中miR-144、ROCK1 mRNA表達比較 直腸癌組織中miR-144、ROCK-1 mRNA的相對表達量分別為0.48±0.06、0.96±0.20,癌旁組織中miR-144、ROCK-1 mRNA的相對表達量分別為0.98±0.07、0.24±0.12,兩者相比,P均<0.05。
2.2 直腸癌組織中miR-144、ROCK-1 mRNA表達的相關性 直腸癌癌組織中miR-144、ROCK-1 mRNA表達呈明顯負相關(r=-0.683,P=0.002)。
2.3 miR-144、ROCK-1 mRNA表達與直腸癌患者臨床病理參數的關系 結果見表1。miR-144、ROCK-1 mRNA表達與直腸癌患者腫瘤分化和腫瘤分期有關(P均<0.05)。
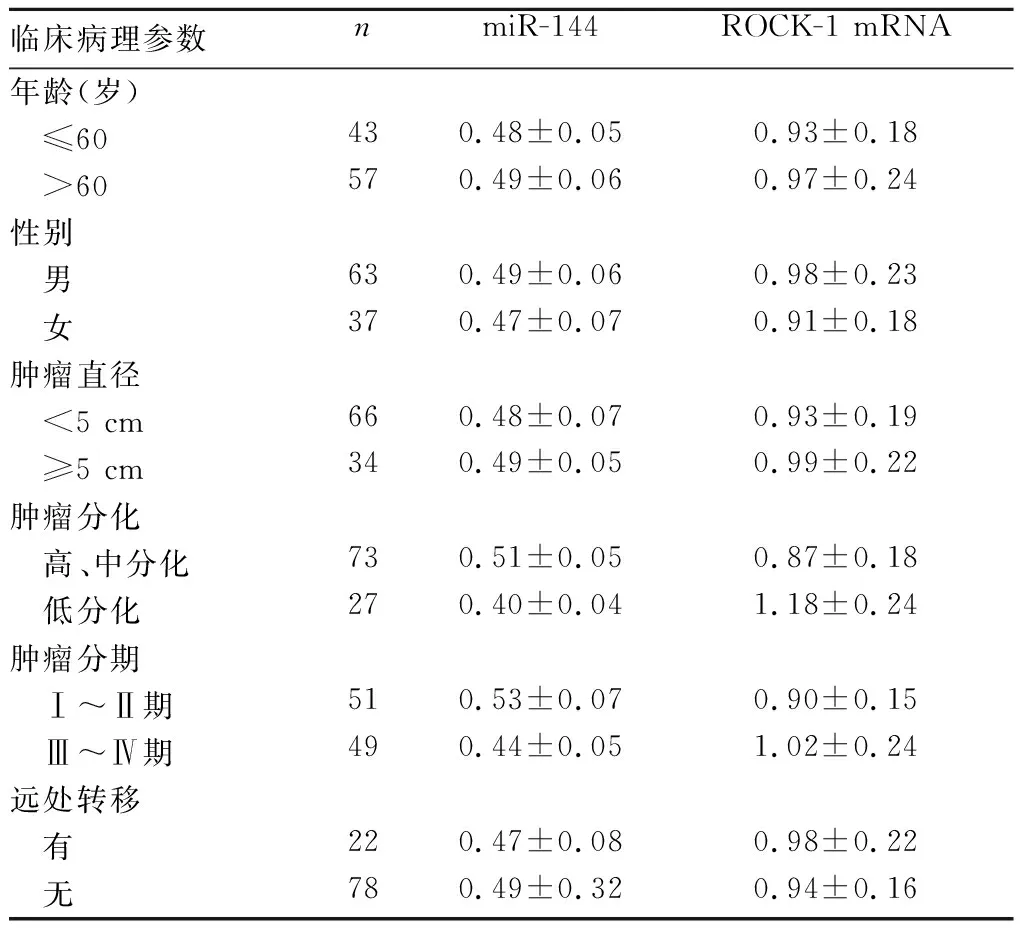
表1 miR-144、ROCK-1 mRNA表達與直腸癌患者臨床病理參數的關系
3 討論
結直腸癌是我國常見的惡性腫瘤之一,2012年我國結直腸癌發病人數達到25.3萬例。直腸癌晚期患者或直腸癌術后復發、轉移的患者腫瘤特異性死亡率較高,預后較差[10]。因此有必要對直腸癌的發生和發展機制進行深入探討。近年來研究[11]表明,直腸癌中存在多種miRNA的表達異常改變,但它們在直腸癌發展和進展中的潛在分子機制仍未完全闡明。因此,有必要研究參與直腸癌進展的miRNA的功能,尋找潛在的靶基因,以尋找調控腫瘤發展的關鍵節點,為直腸癌診斷和治療提供新的研究思路。
miR-144位于人類染色體17q11.2,其基因包含一個外顯子,最早在紅細胞中發現,其參與紅細胞譜系成熟的調節。此外,在胰腺癌[12]、胃癌[13]和甲狀腺癌[14]等多種腫瘤中也存在miR-144表達下調的現象,其可通過結合富含脯氨酸的蛋白11(PRR11)3′端非編碼區,抑制PRR11的表達。此外,miR-144還可通過絲裂原活化蛋白激酶途徑,促進Jun氨基末端激酶和p38的磷酸化,下調細胞外信號調節激酶的表達,最終抑制細胞凋亡和促進細胞增殖。在本研究中,直腸癌組織中miR-144的相對表達量顯著低于癌旁組織,與以往報道[15]一致。目前其具體機制尚不清楚,可能與miR-144基因位點雜合性缺失有關,也可能與miR-144基因表觀遺傳學修飾后功能失活有關。此外,本研究中miR-144的表達與直腸癌患者的腫瘤分化、腫瘤分期有關,提示miR-144表達與腫瘤的發生發展有關。
腫瘤細胞的浸潤和轉移能力是癌癥的重要標志,這個過程需要通過細胞骨架系統的重塑和細胞及細胞外基質的接觸來促進細胞運動。Rho家族的小GTP酶在調節肌動蛋白細胞骨架組織和運動中發揮了重要作用[16]。ROCK屬于絲氨酸/蘇氨酸激酶家族,其通過與Rho GTP酶的相互作用調節,通過磷酸化多種下游靶蛋白來促進肌動蛋白、肌球蛋白引起的收縮,進而控制細胞運動和轉移。ROCK信號在腫瘤、糖尿病腎病等疾病中發揮重要的作用,其中ROCK-1是介導RhoA信號的關鍵介質,參與細胞收縮、細胞凋亡、遷移和侵襲的信號傳導調節。本研究中,直腸癌組織中ROCK1 mRNA的相對表達量顯著高于癌旁組織,表明直腸癌發生時ROCK-1表達增加。我們認為,ROCK1 mRNA的表達升高可能與抑制其表達的miRNA表達下調有關,使ROCK-1 mRNA穩定性增加[17]。此外,本研究中直腸癌組織中ROCK-1 mRNA的表達與腫瘤分化和腫瘤分期有關,提示直腸癌組織中ROCK-1的表達參與腫瘤的發生發展。研究[18]表明,P53基因作為一種抑癌基因,其突變或缺失多發生于高級別、進展期惡性腫瘤中,ROCK-1可作為p53的生理調節因子,與p53結合并調節其穩定性及表達,p53基因突變后失去與ROCK-1結合的能力,導致ROCK-1水平升高。
在體外細胞實驗[19,20]中,通過在直腸癌細胞系SW837、SW1463細胞中過表達ROCK-1后,miR-144對腫瘤細胞的遷移和增殖的抑制作用得到逆轉。本研究進一步研究直腸癌癌組織中miR-144與ROCK-1 mRNA表達的相關性,結果表明兩者的表達呈負相關關系,其可能的機制是,miR-144通過下調ROCK-1的表達抑制直腸癌的增殖和轉移能力。
綜上所述,直腸癌組織中miR-144表達降低,而ROCK-1 mRNA表達升高,兩者共同參與直腸癌的發生發展,可能成為直腸癌診斷、治療及預后評估的新腫瘤標志物,但對于兩者之間具體作用途徑有待進一步研究。

