接受自體動靜脈內瘺術的兔動靜脈吻合口靜脈端頸外靜脈內膜厚度及自噬相關蛋白表達觀察
楊雄,曾保堯,左江偉
(廣西醫科大學第三附屬醫院,南寧530031)
血液透析是終末期腎病(ESRD)患者主要的治療與生存手段,而具有高通暢率、少并發癥等優勢的自體動靜脈內瘺(AVF)已經成為首選血液透析通路[1,2]。但研究[3]表明,AVF在建立1年后的狹窄率仍可達40%,這也是血透患者需要進行多次手術的主要原因所在,同時也給患者與社會帶來非常沉重的經濟負擔[4]。如何更好的解決AVF術后狹窄以建立更長久穩定的血透通路,已經成為專科醫生十分棘手的難題。自噬是細胞內自我降解過程,普遍存在于大部分真核生物細胞中,可平衡細胞能量來源并調節組織穩態。在生理條件下,自噬作用會將細胞質成分匯集到自噬溶酶體中進行降解,是細胞死亡行為的替代方式,在應激條件下,還可出現自身適應性反應,維持內環境穩定。自噬在動脈粥樣硬化等血管性疾病進展中有著重要作用,但自噬在AVF術后內膜增生中的表達情況目前尚不清楚。自噬相關蛋白Beclin-1、LC3-Ⅱ、P62的表達量可以體現自噬活性的高低。Beclin-1是參與調節自噬起始階段的重要蛋白,LC3-Ⅱ參與調節自噬體的形成,而P62作為自噬底物,在自噬過程中不斷被消耗。2018年8月1日~2019年1月1日,本研究對自體動靜脈內瘺術后新西蘭兔吻合口靜脈端頸外靜脈內膜厚度及自噬相關蛋白的表達進行觀察,并探討其相關性。
1 材料與方法
1.1 新西蘭兔、AVF手術方法及分組 30只雄性新西蘭兔,體質量2.0~2.5 kg,由廣西醫科大學動物實驗中心提供。將30只新西蘭兔用10%水合氯醛麻醉,呈仰臥位固定在操作臺上,剔除頸部兔毛、消毒、鋪無菌孔巾后切開皮膚,解剖分離出左側頸總動脈和頸外靜脈,分別用兩個小動脈和小靜脈血管夾將動靜脈的兩端進行夾閉,以水平約呈30 °角剪斷頸外靜脈,然后用尖刀沿左側頸總動脈長軸方向劃開約5 mm開口,用肝素鈉鹽水沖洗干凈,之后用7-0血管縫線進行端-側吻合,用絲線結扎頸外靜脈遠心端,記為實驗組;同時解剖分離右側頸總動脈和頸外靜脈,不予其它處理,記為對照組;最后縫合頸正中切口。分別于術后第1周(T1)、第2周(T2)、第4周(T3)時用上述同樣方法麻醉及固定動物,并沿同切口切開,實驗組在吻合口靜脈端取一段頸外靜脈,對照組在相對應位置取一段頸外靜脈。將取得的靜脈分成兩段,一段放置于4%多聚甲醛溶液中保存備檢,另一段-80 ℃保存備檢。
1.2 兔頸外靜脈內膜厚度測算 采用HE染色法。取4%多聚甲醛溶液中保存的頸外靜脈組織,常規無水乙醇脫水、二甲苯透明、石蠟包埋、切片、烤片、脫蠟,Harris氏蘇木素、1%水溶性伊紅染液染色,脫水、透明、風干后用中性樹膠封片,顯微鏡下觀察并測算頸外靜脈內膜厚度。
1.3 兔頸外靜脈Beclin-1、LC3-Ⅱ、P62蛋白檢測 采用Western blotting法。取-80 ℃保存的頸外靜脈組織剪碎后按比例加入裂解液充分裂解,離心后收集上清液,采用BCA法測定蛋白濃度并將所有樣品調至等濃度。每100 μL蛋白樣品中加入25 μL 5倍SDS-PAGE蛋白上樣緩沖液充分變性后,SDS-聚丙烯酸胺凝膠電泳,Beclin-1、P62用0.45 μm的PVDF轉膜1.5 h,LC3-Ⅱ用0.22 μm的PVDF轉膜30 min,將PVDF膜取出,用TBST漂洗后,常溫孵育1 h,用TBST漂洗后將膜正面朝下貼在一抗上,4 ℃孵育過夜,之后孵育二抗,在Oddsey掃描儀上掃描洗好的膜,用Oddsey v3.0軟件對掃描結果進行分析,以熒光強度表示目的蛋白的相對表達量。

2 結果
2.1 兔頸外靜脈內膜厚度比較 實驗組T1、T2、T3時兔頸外靜脈內膜厚度(見圖1)分別為(28.94±2.36)、(36.71±3.64)、(67.51±6.40)μm,對照組T1、T2、T3時分別為(16.96±3.76)、(17.20±3.68)、(17.12±3.59)μm,兩組同一時間點相比,P均<0.05;實驗組T2、T3時的頸外靜脈內膜厚度與T1時相比,P均<0.05;對照組內各時間點相比,P均>0.05。
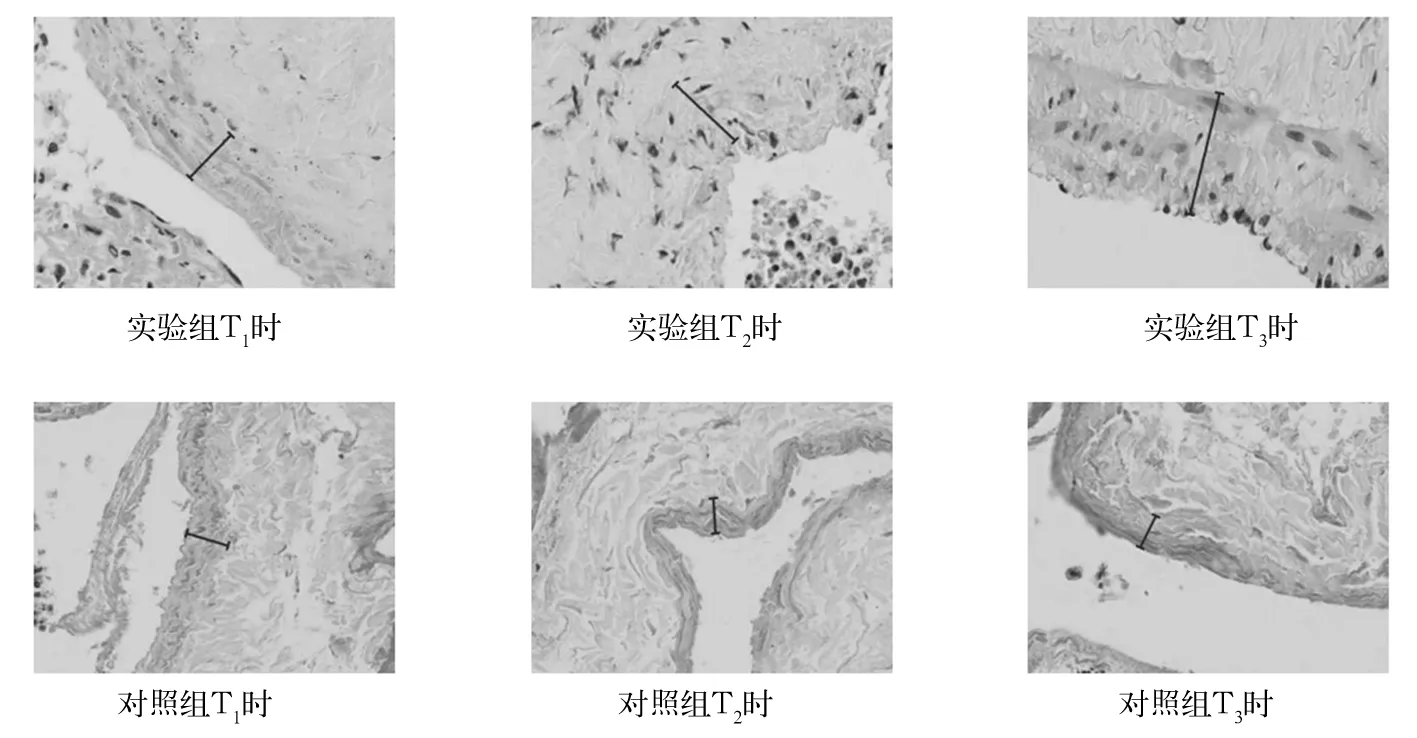
圖1 兔頸外靜脈內膜厚度(HE染色,400×)
2.2 兔頸外靜脈Beclin-1、LC3-Ⅱ、P62蛋白相對表達量比較 結果見表1。
表1 兔頸外靜脈Beclin-1、LC3-Ⅱ、P62蛋白相對表達量比較
注:與對照組同一時間點相比,﹡P<0.05;與本組內T1時相比,﹟P<0.05;與本組內T2時相比,△P<0.05。
2.3 實驗組兔頸外靜脈內膜厚度與自噬相關蛋白Beclin-1、LC3-Ⅱ、P62的相關性 實驗組兔頸外靜脈內膜厚度與Beclin-1、LC3-Ⅱ蛋白表達均呈正相關(r分別為0.887、0.919,P均<0.01),與P62蛋白呈負相關(r=-0.788,P<0.01)。
3 討論
研究[5]發現,AVF狹窄最主要機制是靜脈內膜增生,學者們通過對人體AVF狹窄的內膜進行分析得出,在增生內膜細胞的構成當中,肌成纖維細胞為主要組成因素。Li等[6]通過對動物AVF模型分析得知,靜脈內膜里的肌成纖維細胞是從外膜中的成纖維細胞轉化并遷移而來。但外膜細胞如何遷移到內膜,以及成纖維細胞怎樣轉化為肌成纖維細胞的具體機制尚不明確,目前認為,這一轉移過程與血管內皮細胞損傷、血流動力學改變、炎癥及氧化應激等有著密切的關系,并且這些因素之間相輔相成,產生的眾多細胞因子間構成了復雜的調節網絡系統,聯合推動內膜組織細胞數目的增加[7]。
自噬是溶酶體對于細胞當中已經衰老破損的蛋白質及其相關物質進行自然分解,從而保持細胞穩定的一種狀態,主要有兩方面的體現。其一,自噬在基礎水平下對細胞內物質進行更新,維持細胞功能;其二,在外界環境改變,如氧化應激、損傷等條件下,自噬被激活上調,通過清除這些受損的細胞器以及回收可利用的產物等途徑來維持細胞功能,減少損傷。如果在外界持續強烈的刺激下,可能會導致細胞出現過度自噬而發生程序性的死亡,造成細胞功能障礙,參與疾病的發展[8,9]。Beclin-1-Ⅲ型胞內磷脂酰肌醇激酶(PI3K)是一條對自噬有著非常重要作用的調節通路,此通路表現的上增性調節能夠對自噬起到推動作用[10];LC3-Ⅰ在自噬體形成過程中能夠轉化為在自噬體膜的LC3-Ⅱ,提示自噬活性的程度高低與LC3-Ⅱ表達程度密不可分[11];自噬底物P62在自噬活動中會被分解,提示自噬活性與P62表達程度呈負相關[12]。因此,自噬水平高低可通過自噬蛋白Beclin-1和LC3-Ⅱ以及自噬底物P62表達程度來加以判斷。
Xie等[13]在研究心肌缺血再灌注損傷中發現,心肌細胞的自噬現象在缺血缺氧的環境中被激活上調,通過增強的自噬作用可使心肌細胞免于外界損傷,最終讓心梗面積減少。Karim等[14]在研究抗動脈粥樣硬化中,通過腺苷酸活化蛋白激酶(AMPK)通路使自噬水平上調來抑制平滑肌細胞增殖。Liu等[15]在研究動物腎病模型中,通過外界干預措施使得自噬作用增加,能顯著抑制系膜細胞的增殖。總而言之,當機體遭受外來刺激,細胞自噬現象增強或者通過其他途徑上調自噬水平能對機體起到保護作用,延緩疾病的發展。在AVF建立后,靜脈壁會長期處于高壓高氧的動脈血中,造成細胞的損傷,導致細胞內環境的紊亂,為使細胞免于損傷以維護細胞功能的穩定,自噬現象能否被激活上調來發揮保護作用目前尚不確定。當前對于AVF狹窄與自噬現象的研究甚少,最近有學者[15]提出自噬參與了AVF狹窄的過程,但未能進一步闡述內膜增生與自噬之間的關系。本研究中,對照組各時間點之間對比,頸外靜脈內膜厚度以及Beclin-1、LC3-Ⅱ、P62蛋白表達均無差異,說明在未進行動靜脈吻合時,無論暴露時間長短,靜脈內膜細胞均無增生及自噬現象的增強。通過實驗組與對照組各時間點之間進行對比,實驗組各時間點的頸外靜脈內膜厚度均有明顯增加,提示AVF術后頸外靜脈內膜出現了增生;Beclin-1、LC3-Ⅱ蛋白在T1、T2、T3時表達均增高,表明了AVF術后自噬現象被激活上調,而P62蛋白表達均顯著下降,從而更進一步證實了AVF術后自噬水平的上升。本研究結果顯示,在AVF術后同時出現了靜脈內膜增生與自噬表達上調,說明了自噬參與了AVF術后內膜增生過程。進一步通過實驗組各時間點之間的對比,我們發現,從第1周到第4周,靜脈內膜逐步增厚,Beclin-1、LC3-Ⅱ蛋白的表達均呈遞增趨勢,P62蛋白的表達呈遞減趨勢,提示自噬水平逐漸增強。由此可知,在AVF術后靜脈內膜增生與自噬強度呈現出正相關,即自噬活性越強,內膜增生越顯著,推測自噬與靜脈內膜增生存在由因及果的關系。
在內瘺建立后,如果可以通過外界干預來抑制自噬的活性的前提下,能否預防內膜增生,最終使得內瘺壽命更長久,尚無法下這樣的結論。首先,本研究只是推測兩者存在因果關系;其次,自噬有助于內瘺的成熟,如果對自噬干預過早,可能會更快的造成內瘺失活。在AVF形成之后,靜脈壁所面對的刺激是持續的,因此可能存在過度自噬的現象,自噬反而參與介導內膜細胞進一步增生,加速內瘺狹窄的步伐。因此,想通過對自噬的調節來防治內瘺狹窄,不僅需要更進一步證實兩者間的因果關系,還需要對內瘺成熟的過程和狹窄形成中的過度自噬現象等有更深的研究。
綜上所述,自噬不僅參與了AVF術后靜脈內膜增生的過程,并且兩者表現出正相關,即自噬活性增強過程中內膜增生顯著。本研究對更深入的研究自噬在AVF術后內膜增生中的作用提供一種方向和依據,也為內瘺狹窄的防治闡述了一種新思路。

