推拿手法對神經病理痛大鼠背根神經節和脊髓背角NMDAR2B表達的影響*
陳水金 江 煜 陳樂春 陳進城 林志剛△
神經病理痛(Neuropathic pain,NP)是由軀體感覺神經系統的損傷或功能紊亂而造成的以痛覺過敏為主要表現的疼痛綜合征,臨床常見、多發[1~3]。臨床觀察發現推拿能有效干預神經病理痛,但作用機制尚不明確。近年來,研究發現以N-甲基-D-天冬氨酸(NMDA)受體為代表的一類離子型谷氨酸(Glu)受體,尤其是2B亞單位(NR2B)的NMDA受體與NP關系密切,在NP的發生和發展過程中發揮重要作用[4]。有學者采用坐骨神經慢性壓迫性損傷大鼠模型(CCI)研究NP大鼠脊髓背角NMDA受體NR2B亞基表達,發現NR2B蛋白表達增加是導致大鼠神經病理痛的原因之一[4~6]。本研究通過觀察推拿手法對CCI大鼠背根神經節和脊髓背角NMDAR2B的表達,探討推拿手法鎮痛的機制。
1 材料與方法
1.1 動物與分組清潔級雄性SD大鼠,體質量為180~220 g,購自上海斯萊克實驗動物有限責任公司,許可證:SCXK(滬2014-0002),單籠適應性飼養3 d后按照隨機數字表法分成空白組、假手術組(分離坐骨神經但不進行結扎)、CCI模型組、CCI模型+推拿組,每組8只。
1.2 主要儀器與試劑von-Frey纖毛(美國Stolting公司)、無線觸覺力測量指套(美國Finger TPS公司)、熱痛儀(美國IITC Life Science)、高速冷凍離心機(美國Beckman公司)、超聲波細胞破碎儀(美國BRANSON公司)、垂直電泳槽(美國Bio-Rad公司)、電轉儀(美國Bio-Rad公司)、Automatic凝膠成像系統(美國Bio-Rad公司)、Image La成像及分析軟件(美國Bio-Rad公司)、兔抗NR2B多克隆抗體(美國Santa Cruz公司)、小鼠抗β-actin單抗(美國Jackson公司)、羊抗兔HRP IgG二抗(美國Jackson公司)、BCA蛋白定量試劑盒、ECL反應液(美國Millipore公司)。
1.3 實驗方法
1.3.1 神經病理痛模型的建立參照Bennett G J的方法稍作改進建立大鼠CCI模型[7]。大鼠腹腔注射戊巴比妥鈉(35 mg/kg)麻醉后,側臥位固定,消毒備皮,于大鼠右股骨中段后方約1 cm處平行于股骨切開皮膚、暴露肌肉,鈍性分離肌肉,暴露坐骨神經主干,用4-0鉻制羊腸線分3道結扎坐骨神經,每道間隔約1 mm,然后逐層縫合,腹腔注射硫酸阿米卡星(10 mg/kg)預防感染。
1.3.2 神經病理痛模型的驗證本實驗采用Von-Frey方法測試機械足反射閾值(PWT)及Hargreaves方法測試熱縮足反射潛伏期(PWL),以驗證CCI模型是否為疼痛行為表現穩定的動物模型,測定時間、次數及方法等同之前的文獻報道[8]。
1.3.3 推拿干預方法推拿組于造模后第4~17天實施每天1次、每次10 min的推拿干預。術者用右手對大鼠右后肢腓腸肌局部進行推拿指揉法操作。為了規范指揉法操作時的刺激量,手法操作過程中右手拇指帶上美國Finger TPS公司生產的無線觸覺力指套進行推拿手法操作,壓力5 N、頻率2 Hz。
1.4 檢測指標及方法用Western blot檢測背根神經節和脊髓背角組織NR2B蛋白的表達:療程結束后,所有組別大鼠麻醉后斷頭放血,立即于冰盤上用無菌器械迅速切取右側L4、L5背根神經節及右側脊髓背角,分別置于1.5 ml離心管中,稱重。加入裂解液(按組織重量與RIRA組織裂解液體積比為1∶80 mg/μl),超聲細胞破碎儀機勻漿,冰上裂解30 min,然后以14000 r/min,4 ℃離心10 min,取上清,用BCA試劑盒測定蛋白濃度。經SDS-PAGE電泳后冰冷轉膜(280 mA∶90 min),5%脫脂奶粉封閉1 h,分別在NR2B(1∶500)和β-actin抗體(1∶2000)中孵化過夜,TBST液洗膜,加入HRP標記二抗(1∶2000)室溫(37 ℃)孵育1 h,ECL發光法試劑盒顯色,使用Bio-Rad Automatic凝膠成像系統成像,Image Lab軟件對蛋白條帶進行灰色值分析。
1.5 統計學方法應用SPSS 23.0軟件對數據進行統計分析。計數資料采用χ2檢驗;計量資料采用t檢驗或秩和檢驗。當P≤0.05時,差異有統計學意義;當P≤0.01時,則表示差異有顯著統計學意義;而P>0.05則表示差異無統計學意義。
2 結果
2.1 造模成功CCI造模后第10天,CCI模型組和CCI+推拿組大鼠的PWT值、PWL值達最低水平,并保持在穩定的水平,有明顯的機械痛覺過敏及熱痛覺過敏現象,為疼痛行為表現穩定的動物模型。
2.2 Western blot法檢測背根神經節NMDAR2B表達的改變與空白組、假手術組相比,CCI模型組、CCI+推拿組的背根神經節NMDAR2B的表達量均上調(P<0.01);CCI模型組、CCI+推拿組的背根神經節NMDAR2B的表達量的差異無統計學意義(P>0.05)。見表1。
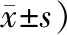
表1 4組大鼠右側L4、L5背根神經節NMDAR2B表達量比較 (例,
2.3 Western blot法檢測脊髓背角NMDAR2B表達的改變與空白組、假手術組相比,CCI模型組的脊髓背角NMDAR2B的表達量上調(P<0.01);與CCI模型組比較,CCI+推拿組的脊髓背角NMDAR2B的表達量被逆轉(P<0.05)。見表2。
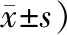
表2 4組大鼠右側脊髓背角NMDAR2B表達量比較 (例,
3 討論
NP是常見的疼痛,相當部分頸肩腰腿痛屬于NP范疇,如頸、腰椎間盤突出癥或外周神經干或神經分支卡壓綜合征等引起的疼痛[9]。中醫將此類疾病歸為“經筋病”范疇,推拿對“經筋病”有很好的效果,如《黃帝內經太素·卷第十九》云:“痛生筋脈皮膚之間,為痹不仁,故以按摩醪醴。” 及《醫宗金鑒·正骨心法要旨》曰:“因跌撲閃失,以至骨縫開錯,氣血郁滯,為腫為痛,宜用按摩法”等,但目前其機制尚不明確。
本研究參照Bennett G J的方法稍作改進建立的大鼠CCI模型造模后引起的疼痛與臨床神經損傷后神經病理痛最為貼切。本實驗結果發現,CCI模型建立后,大鼠有明顯的機械痛覺過敏及熱痛覺過敏等痛覺過敏現象。有研究顯示,CCI模型引起疼痛是由其受損部位傳入神經異位放電產生異位敏感度提高所致,外周敏化由此產生;但Julius D用電刺激麻醉的受損部位后仍出現痛覺過敏,由此并不是單純外周敏化起作用,脊髓及脊髓以上神經元對疼痛刺激的敏感性(即中樞敏化)亦起作用[10~12]。
背根神經節(dorsal root ganglia,DRG)作為痛覺傳入的第一級神經元,在痛覺的外周敏化機制中起著重要的作用[13]。研究表明,外周敏化的持續興奮性沖動經DRG的Aδ和C纖維傳入脊髓背角,引起脊髓背角釋放谷氨酸增加,激活N-甲基-D-天冬氨酸(NMDA)受體,加強脊髓背角突觸后反應、增多異位放電,引起中樞敏化[14~16]。
NMDA受體由NR1、NR2(A、B、C、D)、NR3(A、B)亞單位組成的聚合體。不同的亞基因其結構及部位的不同介導不同的生理功能,目前有研究發現NR2B亞基與疼痛密切相關,認為疼痛刺激經外周感覺纖維傳入DRG,調控DRG合成NR2B蛋白,再分布于脊髓背角,使脊髓背角NMDA受體激活,引起中樞敏化[13,17];本研究發現CCI模型DRG和脊髓背角NR2B表達量高于空白組、假手術組,與報道吻合;DRG和脊髓背角的含有NR2B亞基的NMDA受體在NP的產生和維持中起到重要作用。有研究發現神經損傷后大鼠脊髓背角NR2B表達明顯增加,本研究CCI模型脊髓背角NR2B表達量高于假手術組,與上述相關報道一致;虞雪融等[5]運用NR2B拮抗劑能降低脊髓NR2B的表達,減輕疼痛;本研究發現推拿手法對DRG中NR2B蛋白表達沒有影響,但可抑制脊髓NR2B蛋白表達,由此推測推拿手法通過抑制脊髓NR2B蛋白表達,抑制脊髓背角中樞敏化,從而起到鎮痛的效應。
綜上所述,背根神經節和脊髓背角NMDA受體亞單位NR2B參與大鼠神經病理痛的形成和維持,推拿手法可通過抑制脊髓NR2B蛋白表達,從而抑制脊髓背角中樞敏化以發揮鎮痛的作用。

