轉(zhuǎn)染試劑Vigofect對HeLa細胞轉(zhuǎn)染的方案優(yōu)化
李思琦 李春雅 翁夢露 楊 悅 張健翔 劉 進 商 瑜 張曉嫣
(北京師范大學生命科學學院 北京 100875)
0 前言
“轉(zhuǎn)染試劑Vigofect 對 HeLa 細胞轉(zhuǎn)染的方案優(yōu)化”是為生物學一年級研究生開設的細胞及組織培養(yǎng)課程中,學生做的開放實驗課題。在學習了轉(zhuǎn)染技術(shù)基本原理與操作、熒光顯微鏡成像技術(shù)、蛋白印跡技術(shù)后,學生綜合運用以上技術(shù),使用轉(zhuǎn)染試劑,對HeLa 細胞的轉(zhuǎn)染條件進行研究,分析影響轉(zhuǎn)染效率的因素,探究轉(zhuǎn)染條件的優(yōu)化方案,以便為自己今后的實驗工作提供借鑒。同時,這種問題導向性實驗的設置,是為培養(yǎng)學生的創(chuàng)新性思維,改進研究生教學工作進行的探索。
轉(zhuǎn)染是采用除病毒感染外的其他方法將外源核酸(DNA 或者 RNA)人工導入真核細胞的過程。通過轉(zhuǎn)染能改變細胞內(nèi)蛋白表達,改變細胞特性,是研究基因或其產(chǎn)物功能和調(diào)控機制的一種非常重要的技術(shù)手段[1]。將外源基因?qū)胝婧思毎姆椒ㄓ泻芏喾N,例如:DEAE-葡聚糖轉(zhuǎn)染法、磷酸鈣轉(zhuǎn)染法、脂質(zhì)體法、顯微注射法及電穿孔法等[2]。
目前常用的轉(zhuǎn)染試劑是陽離子脂質(zhì)體和陽離子聚合物,它們?nèi)菀淄高^細胞膜,其中陽離子脂質(zhì)體在體外基因轉(zhuǎn)染中有很高的效率。但由于陽離子脂質(zhì)體易被血清清除,有高水平毒性,因此陽離子聚合物轉(zhuǎn)染試劑被日益廣泛地研發(fā)與使用。陽離子非脂質(zhì)體轉(zhuǎn)染試劑以陽離子聚合物為主要成分,其高度的分支結(jié)構(gòu)確保了正離子電荷的高密度,使與帶有負電荷的外源基因結(jié)合更有效,容易被細胞吸收,適合多種類型的細胞系,可廣泛用于瞬時轉(zhuǎn)染和穩(wěn)定轉(zhuǎn)染[3]。Vigofect 采用陽離子非脂性物質(zhì)為主的配方,是一種高效真核轉(zhuǎn)染試劑,可與 DNA 形成穩(wěn)定的復合物,透過細胞膜進入細胞內(nèi),并保護 DNA 免受核酸酶的降解。
HeLa 細胞是現(xiàn)代生命科學研究中經(jīng)常使用的一種細胞,是種源自一位美國婦女海莉耶塔·拉克斯(Henrietta Lacks)的子宮頸癌細胞的細胞系。HeLa 細胞是生物學研究中非常重要的實驗材料,該細胞形態(tài)規(guī)則,生長速度較快,易于培養(yǎng),且較易攝入外源質(zhì)粒 DNA,是檢測轉(zhuǎn)染試劑效果的合宜材料。
轉(zhuǎn)染過程中影響轉(zhuǎn)染效率的因素包括:細胞狀態(tài)、細胞密度、DNA 與轉(zhuǎn)染試劑比例、轉(zhuǎn)染前細胞培養(yǎng)時間、轉(zhuǎn)染試劑孵育時間、培養(yǎng)液體積等。實驗室將長期使用Vigofect 對Hela 細胞進行細胞轉(zhuǎn)染,但轉(zhuǎn)染流程沿用原有方法,未做過轉(zhuǎn)染條件的優(yōu)化,希望通過此次實驗,能在質(zhì)粒使用跟細胞轉(zhuǎn)染時間上進行優(yōu)化,既得到最大轉(zhuǎn)染效率,又能節(jié)省試劑,更合理地安排實驗時間。
1 實驗材料與方法
1.1 實驗材料與試劑 人子宮頸癌細胞(HeLa,由北京師范大學生命科學學院商瑜實驗室提供)、GFP 質(zhì)粒、CHIP 過表達質(zhì)粒(HA-CHIP)。
150 mmol/L NaCl(超純水配制,高壓或過濾滅菌)、Vigofect 轉(zhuǎn)染試劑(威格拉斯)、牛奶(伊利脫脂奶粉配制)、Anti-CHIP(本實驗室保存)、Anti-βactin(Sigma)、山羊抗小鼠 lgG/辣根酶標記(中杉金橋)、山羊抗兔 lgG/辣根酶標記(中杉金橋)、曝光試劑盒(顯色底物,Thermo Scientific)、DMEM basic(gibco)、PBS(gibco)、胎牛血清 FBS(康源生物)。
1.2 實驗儀器(表1)

表1 實驗儀器及來源
1.3 實驗步驟
1.3.1 細胞培養(yǎng) 將HeLa 細胞培養(yǎng)在含 10%胎牛血清的 DMEM 中(按 1∶1000 加入雙抗),37℃,5% CO2培養(yǎng)箱中培養(yǎng)。
1.3.2 細胞轉(zhuǎn)染及轉(zhuǎn)染效率分析 轉(zhuǎn)染前一天鋪細胞于12 孔板,使細胞在轉(zhuǎn)染當天達到指定匯合度(本實驗中涉及匯合度為40%~100%)。
轉(zhuǎn)染試劑為威格拉斯公司的Vigofect,根據(jù)該公司提供的產(chǎn)品說明步驟進行轉(zhuǎn)染。
配制 Vigofect 工作液,1 μL Vigofect 加入 49 μL 150 mmol/L NaCl 溶液中。輕輕混勻,靜置 5 min。工作體積每孔50 μL。
配制 DNA 工作液,工作體積為每孔50 μL。
將Vigofect 工作液分別逐滴加入DNA 工作液中,混勻后靜置15 min。將混勻后的液體加入細胞培養(yǎng)體系中,輕輕混勻,置于 37℃,CO2培養(yǎng)箱中培養(yǎng)。
1.3.2.1 DNA 與轉(zhuǎn)染試劑比例對轉(zhuǎn)染效率的影響 轉(zhuǎn)染前一天鋪細胞于12 孔板,使細胞在轉(zhuǎn)染當天達到匯合度70%。12 孔板中,固定Vigofect用量(1 μL),DNA 轉(zhuǎn)染用量分別為 0.4 μg、1 μg、2.5 μg 和 6.25 μg。
1.3.2.2 細胞密度對轉(zhuǎn)染效率的影響 12 孔板中,轉(zhuǎn)染前一天調(diào)整鋪入皿中的細胞數(shù)量,使細胞在轉(zhuǎn)染當天分別達到40%、70%、100%的匯合度。固定 Vigofect 用量(1 μL),DNA 用量為 2.5 μg。
1.3.2.3 接種后培養(yǎng)時間對轉(zhuǎn)染效率的影響分別在轉(zhuǎn)染前16 h 及11 h 在12 孔板中鋪入一定數(shù)量 HeLa 細胞,使兩者細胞在轉(zhuǎn)染當天分別達到 70%匯合度。固定 Vigofect 用量(1 μL),DNA用量為 2.5 μg。
以上轉(zhuǎn)染操作均在轉(zhuǎn)染試劑孵育5 h 后更換新鮮培養(yǎng)基。轉(zhuǎn)染36 h 后觀察細胞,用倒置熒光顯微鏡拍照,每孔細胞選取3 個視野,進行拍照,通過GFP 熒光表達量,判斷細胞轉(zhuǎn)染效率。利用Image J 軟件統(tǒng)計轉(zhuǎn)染效率。
1.3.3 Western Blot 檢測
1.3.3.1 收集細胞樣品 棄掉培養(yǎng)基,每個孔中加入 500 μL PBS,清洗細胞,每孔洗 2 遍。每孔中加入 200 μL 2×loading buffer,將細胞刮下,置于1.5 mL EP 管中,100℃煮 10 min,放入-20℃?zhèn)溆谩?/p>
1.3.3.2 SDS-PAGE 凝膠電泳
1)清洗膠槽,組裝。
2)按照表2 配制分離膠和濃縮膠。

表2 分離膠和濃縮膠的配制
取出制備好的樣品上樣量為10 μL,電泳儀設定為 140 V 恒壓,30 min,160 V,1 h 30 min,至溴酚藍跑出膠底邊即可停止電泳。
1.3.3.3 轉(zhuǎn)膜及麗春紅染色 配制轉(zhuǎn)膜緩沖液1 L:100 mL 10×transfer buffer(250 mmol/L Tris-HCl,192 mmol/L甘氨酸 ,ddH2O 中 加 入 30.2 g Tris-HCl,144 g 甘氨酸)+700 mL ddH2O+200 mL無水甲醇。
將PVD 膜置于甲醇中激活5 min。
制作“三明治”轉(zhuǎn)膜結(jié)構(gòu):濾紙→膠→PVD 膜→濾紙按順序疊放,在其表層輕輕加transfer buffer。將轉(zhuǎn)膜裝置放入冰水混合物中,轉(zhuǎn)膜2 h。
轉(zhuǎn)膜完畢后,將膜取出,浸泡在配制好的麗春紅染色液(2%麗春紅,30%三氯乙酸,30%磺基水楊酸)中,直至條帶顏色完全顯現(xiàn)出來,后轉(zhuǎn)入清水中洗去浮色。
1.3.3.4 裁膜及封閉 裁下β-actin [相對分子質(zhì)量(Mr)≈4.3×104]作為內(nèi)參,將要檢測的蛋白放在膜的中心位置,將膜剪裁至合適大小并標記好所需抗體名稱。放入清水中。
配 制 1 L TBST buffer:900 mL ddH2O 加 入100 mL 10×TBS (5 mol/L NaCl 275 mL,pH=7.6 的Tris-HCl 100 mL 補齊至1 L)再加入1 mL 吐溫。
配制封閉使用的牛奶(10%):稱 10 g 奶粉,加 TBST 至 100 mL,攪拌 5~10 min 至溶解。
將洗好的膜按照與封口垂直的方向放入自封袋中,加入配好的牛奶,沒過膜,塑封機封住開口,37℃ 1 h 或 4℃過夜。
1.3.3.5 孵育一抗、二抗 用牛奶按照1∶1 000的比例配制一抗。封閉結(jié)束后,倒掉牛奶,加入一抗,封膜。4℃過夜或 37℃ 1~2 h。TBST 洗膜 4 遍,每遍5 min。
用 TBST 按照 1∶10 000 的比例配制二抗。將洗膜盒里的TBST 倒干凈,直接在洗膜盒里加入適量二抗,37℃ 1 h 或者室溫 2 h。TBST 洗膜 5遍,每遍 5 min。
1.3.3.6 曝光(化學發(fā)光儀) 將膜移入化學發(fā)光儀中。避光配制化學顯影液。將顯影液滴加到膜上,設置自動曝光參數(shù)(不顯示 marker,曝光 15次),曝光結(jié)束后選擇最合適曝光強度的照片,根據(jù)上樣順序按規(guī)范制作成實驗結(jié)果圖留存。
2 結(jié)果與討論
2.1 DNA 與轉(zhuǎn)染試劑比例對轉(zhuǎn)染效率的影響DNA 轉(zhuǎn)染用量為 0.4 μg、1 μg、2.5 μg 和 6.25 μg。實驗結(jié)果顯示,從表達GFP 細胞數(shù)目(圖1、表1)和蛋白表達水平上看(圖2),隨著DNA 對轉(zhuǎn)染試劑比例的增加,轉(zhuǎn)染效率會逐漸提高,但超過一定限度,隨著DNA 量的增加,轉(zhuǎn)染效率不再提高。這也說明Vigofect 在轉(zhuǎn)染時存在 DNA 轉(zhuǎn)染量的限制,并不是轉(zhuǎn)染的DNA 量越多轉(zhuǎn)染效率越高。對于該實驗體系,DNA 與 Vigofect 的最佳比例為1 μL Vigofect 轉(zhuǎn)染 2.5 μg DNA。
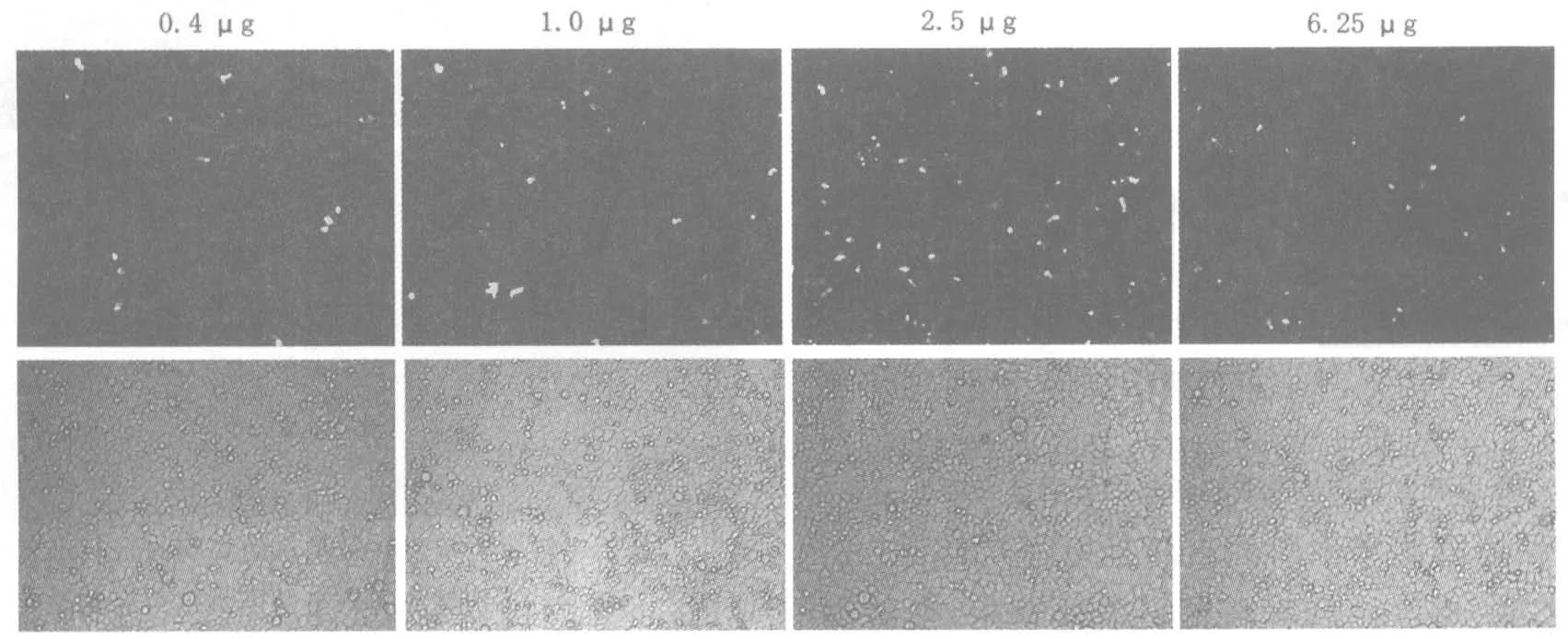
圖1 不同質(zhì)粒轉(zhuǎn)染量對轉(zhuǎn)染效率的細胞水平觀察
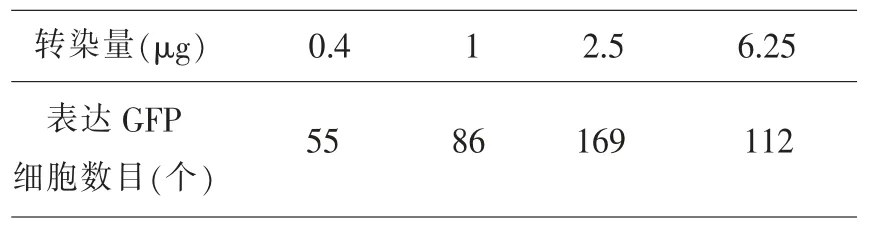
表1 不同質(zhì)粒轉(zhuǎn)染量條件下細胞熒光數(shù)量統(tǒng)計
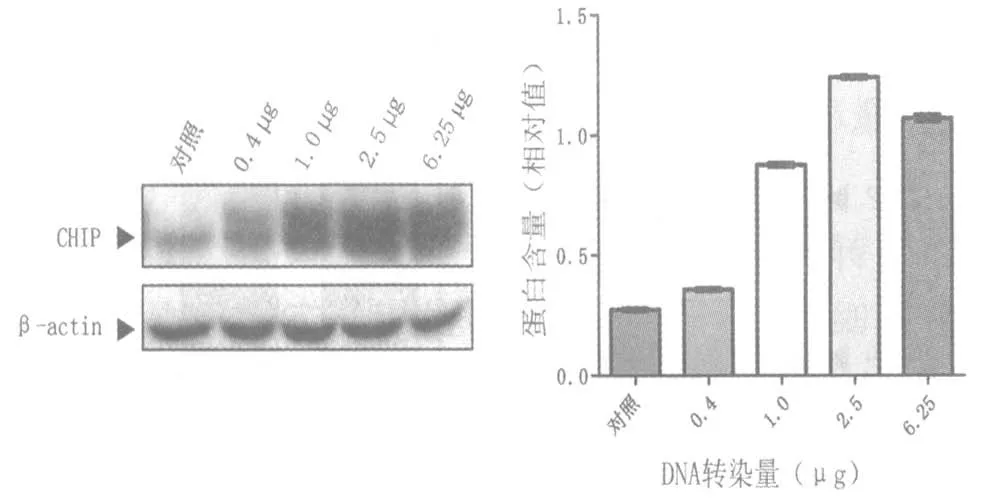
圖2 不同質(zhì)粒轉(zhuǎn)染量對轉(zhuǎn)染效率的蛋白水平檢測
2.2 細胞密度對轉(zhuǎn)染效率的影響 實驗室原有固定的轉(zhuǎn)染流程都是在細胞匯合度達到70%時進行轉(zhuǎn)染,因此預測此時轉(zhuǎn)染效率應該最高。但出乎意料的是,實驗結(jié)果提示細胞密度達到 40%時進行轉(zhuǎn)染效率最高(圖3、表2、圖4)。經(jīng)分析發(fā)現(xiàn),實驗室原有流程選擇在70%細胞匯合度轉(zhuǎn)染是為了削減轉(zhuǎn)染試劑的細胞毒性作用,在保證細胞處于指數(shù)增長的前提下盡可能獲得更多存活細胞。此次實驗發(fā)現(xiàn),對HeLa 細胞利用Vigofect 進行轉(zhuǎn)染時,選用40%的細胞匯合度其轉(zhuǎn)染效率更高:固定合適的轉(zhuǎn)染試劑與質(zhì)粒DNA 比例后,其細胞毒性比較小;40%的細胞匯合度,細胞狀態(tài)更好,生長旺盛,攝取外源DNA 的能力也比較強。

圖3 細胞密度對轉(zhuǎn)染效率的影響的細胞水平觀察

表2 不同細胞轉(zhuǎn)染密度條件下細胞熒光數(shù)量統(tǒng)計
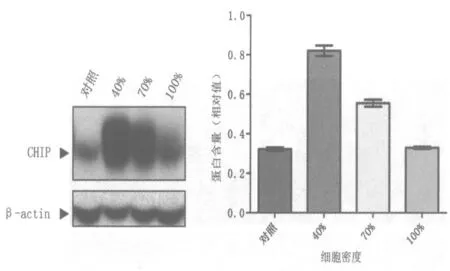
圖4 細胞密度對轉(zhuǎn)染效率的影響的蛋白水平檢測
2.3 轉(zhuǎn)染前細胞培養(yǎng)時間對轉(zhuǎn)染效率的影響在孵育之前,通常選擇較高密度接種細胞,在鋪細胞后的16 h 進行轉(zhuǎn)染,因為這樣細胞能以比較好的狀態(tài)貼壁生長且進入指數(shù)增長期,并通常都能達到常用的轉(zhuǎn)染匯合度。但16 h 是否是最佳條件并未驗證。
在本實驗中為了探討細胞接種后培養(yǎng)多長時間進行轉(zhuǎn)染比較好,并能盡量縮短轉(zhuǎn)染實驗的時間,分別選擇了16 h 后轉(zhuǎn)染和11 h 后轉(zhuǎn)染進行對比實驗。分別于轉(zhuǎn)染前 16 h 及11 h 在12 孔板中鋪入相應數(shù)量HeLa 細胞,使細胞在進行轉(zhuǎn)染時匯合度均達到 70%左右。固定 Vigofect 用量(1 μL),DNA 轉(zhuǎn)染用量 2.5 μg。從實驗結(jié)果來看,鋪入細胞11 h 后進行轉(zhuǎn)染的效率略高于16 h 轉(zhuǎn)染的效率(圖5、表3、圖6)。

圖5 轉(zhuǎn)染時間對轉(zhuǎn)染效率的影響的細胞水平觀察

表3 不同轉(zhuǎn)染時間條件下細胞熒光數(shù)量統(tǒng)計
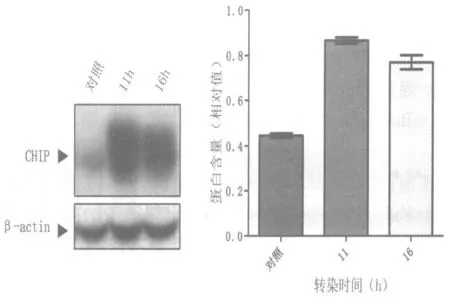
圖6 轉(zhuǎn)染時間對轉(zhuǎn)染效率的影響的蛋白水平檢測
3 總結(jié)與評述
學生所在實驗室經(jīng)常會用轉(zhuǎn)染技術(shù)研究基因和蛋白的功能及調(diào)控機制。實驗室固有流程為細胞接種后16 h,細胞匯合度達到70%時,進行轉(zhuǎn)染實驗,轉(zhuǎn)染質(zhì)粒DNA 時傾向于增加用量,但為什么這樣做,學生并不清楚。
本次探究實驗針對固有流程,以HeLa 細胞為實驗材料,通過調(diào)整轉(zhuǎn)染過程中DNA 與轉(zhuǎn)染試劑比例、轉(zhuǎn)染前細胞培養(yǎng)時間、細胞密度等因素,比較不同條件下轉(zhuǎn)染效率的變化,實現(xiàn)對細胞瞬時轉(zhuǎn)染的條件優(yōu)化的目的。通過之前測試確定,轉(zhuǎn)染試劑孵育時間,以孵育4~6 h 換液轉(zhuǎn)染效率最佳,因此不再考察。
通過這種探究性實驗,學生發(fā)現(xiàn)細胞轉(zhuǎn)染時不一定要按照實驗室的原有經(jīng)驗,轉(zhuǎn)染時細胞密度一定要達到70%,轉(zhuǎn)染一定要等接種后16 h。可適當降低細胞密度,適當提前轉(zhuǎn)染時間,選擇合適的轉(zhuǎn)染試劑與質(zhì)粒DNA 的比例。本實驗中用Vigofect 轉(zhuǎn)染HeLa 細胞時最優(yōu)條件為以合適密度接種細胞后培養(yǎng)11 h 進行轉(zhuǎn)染,轉(zhuǎn)染時細胞匯合度在 40%~50%,每孔的質(zhì)粒用量為 2.5 μg。既節(jié)省了時間、試劑,還提高了轉(zhuǎn)染效率。
通過本次的探究性實驗,學生體會到方法不是一成不變的,需要不斷探索和優(yōu)化。在繁忙的科研活動中,偶爾做一次簡單的方法優(yōu)化小實驗,不僅可幫助提高科研效率,而且也為科研生活增添了樂趣。

