甜瓜半粒干種子DNA提取方法的優化
夏玲 梁昕景 王學林 楊小鋒
摘要:【目的】優化甜瓜半粒干種子DNA提取方法,為甜瓜相關分子研究提供技術支持。【方法】以甜瓜半粒干種子為材料,比較改良CTAB法、SDS法、高鹽低pH法和尿素法4種提取方法的DNA提取效果,并對改良CTAB法中的提取液CTAB濃度、裂解時間、苯酚抽提次數等進行優化,以瓊脂糖凝膠電泳和紫外分光光度計分別檢測DNA的質量和純度。最后通過SSR分析驗證優化后改良CTAB法提取DNA的效果。【結果】4種提取方法中,改良CTAB法提取的DNA提取率最高,且DNA質量和純度均高于其他提取方法。優化得到改良CTAB法的最佳提取條件為:提取液CTAB濃度2%,裂解時間20 min,苯酚抽提1次[先用苯酚/氯仿/異戊醇(25∶24∶1)抽提1次,再用氯仿/異戊醇(24∶1)抽提 1次]。在此條件下,提取的甜瓜半粒干種子DNA質量和純度較好,以此為模板進行SSR分子標記分析時,電泳條帶穩定、清晰,基本無雜帶,可清楚區分品種間的差異。【結論】優化后的改良CTAB法提取甜瓜半粒干種子DNA效果較好,可滿足甜瓜種子分子標記和遺傳多樣性分析等分子實驗需求。
關鍵詞: 甜瓜;干種子;DNA提取;CTAB法;優化
0 引言
【研究意義】甜瓜屬于葫蘆科(Cucurbitaceae)黃瓜屬(Cucumis)一年生草本植物,是我國重要的經濟作物之一。近年來,隨著分子育種技術的發展,甜瓜分子育種日益受到廣大研究者的關注。DNA提取是分子育種和分子生物學研究的基礎,其質量和純度對要求較高的分子實驗具有重要影響(王振東等,2008;陳汝等,2017)。同時,高質量的DNA是基因克隆及SRAP、RAPD、AFLP等分子標記技術的前提條件。因此,優化DNA提取方法對提高研究結果的準確性具有重要意義。【前人研究進展】目前,有關甜瓜不同組織基因組DNA提取方法的研究報道較多。陳金體和王曉峰(2007)采用CTAB法提取甜瓜幼苗的DNA,從DNA分子水平對甜瓜純度進行鑒定。李菊芬等(2008a)采用尿素提取法提取甜瓜子葉的DNA,從DNA分子水平對甜瓜雜種的純度進行鑒定。馬海財等(2010)采用改良CTAB法提取甜瓜幼嫩葉片DNA,并構建甜瓜后代群體的DNA遺傳圖譜。李超等(2017)采用改良CTAB法提取甜瓜葉片DNA,從DNA分子水平對甜瓜新品種純度和真實性進行鑒定研究。趙光偉等(2017)采用CTAB法提取甜瓜品種眾天翠雪葉片DNA,從DNA分子水平進行品種純度鑒定等。以上研究主要采用幼苗、子葉、嫩葉等為材料,需經過浸種、催芽、育苗等前期處理過程,不但周期長,而且提取方法費時費力,工作效率較低。至今,僅李菊芬等(2008a)研究發現,以甜瓜干種子為材料可提取到質量較好的DNA。【本研究切入點】以甜瓜半粒干種子為材料,無需育苗,隨時可提取其DNA,不僅節省育苗時間、減少投入成本,還不傷及種胚,種子仍保持活力可育成苗用于后續試驗,具有簡便、快速、經濟等優點,但目前鮮見對甜瓜半粒干種子DNA提取方法進行優化的研究報道。【擬解決的關鍵問題】以甜瓜半粒干種子為材料,比較改良CTAB法、SDS法、高鹽低pH法和尿素法4種方法提取DNA的效果,并對改良CTAB法中的提取液CTAB濃度、裂解時間、苯酚抽提次數等進行優化,以瓊脂糖凝膠電泳和紫外分光光度計檢測DNA的質量和純度,最后通過SSR分析驗證優化后改良CTAB法提取DNA的效果,為甜瓜分子育種輔助標記開發、種質資源遺傳多樣性研究、種子純度鑒定等分子生物學研究提供技術支持。
1 材料與方法
1. 1 試驗材料
供試材料為甜瓜品種金蜜六號的半粒干種子,由三亞市南繁科學技術研究院保存提供。CTAB、SDS、尿素、乙酸、蛋白酶K、乙醇、異丙醇、Tris飽和酚、氯仿/異戊醇(24∶1)、異丙醇、6×Loading Buffer、TE、DL2000 DNA Marker和瓊脂糖等均購自生工生物工程(上海)股份有限公司。主要儀器設備:高速冷凍離心機(Eppendorf中國有限公司)、BiometraTAdvanced PCR儀(德國耶拿分析儀器股份公司)、Speed mix研磨儀(德國耶拿分析儀器股份有限公司)、超微量核酸蛋白測定儀(德國耶拿分析儀器股份有限公司)和瓊脂糖凝膠電泳儀設備(北京六一生物科技有限公司)等。
1. 2 試驗方法
1. 2. 1 樣品預處理 用已消毒的剪刀剪取甜瓜干種子的胚乳部分(約為種子的1/2處),去除種殼后備用。
1. 2. 2 不同提取方法比較試驗 采用改良CTAB法、SDS法、高鹽低pH法和尿素法4種方法提取甜瓜半粒干種子DNA。改良CTAB法:參照董永軍等(2017)的改良CTAB法,稍作改動,具體步驟:取準備好的樣品放入2 mL離心管,放入直徑8 mm的鋼珠,并加入1 mL CTAB提取液,用研磨儀研磨1~2 min。向研磨好的樣品中加入20 ng/mL蛋白酶K 5 μL,然后置于65 ℃水浴鍋中水浴30 min(期間不斷振蕩離心管)。取出離心管,冷卻至室溫,加入等體積的酚/氯仿/異戊醇(25∶24∶1),顛倒混勻,靜置5 min,12000 r/min離心12 min。取上清液,加入等體積的氯仿/異戊醇(24∶1)輕緩顛倒混勻,靜置5 min,12000 r/min離心12 min。取上清液,加入等體積的-20 ℃預冷異丙醇,輕緩顛倒混勻,于-20 ℃冰箱放置30 min以上,10000 r/min離心6 min后棄上清液。用70%乙醇洗滌沉淀2~3次,置于通風櫥風干后溶于30 μL TE中備用。加入終濃度50 μg/mL的RNase,37 ℃保溫30 min。最后將DNA樣品置于-20 ℃冰箱中保存備用。SDS法參照彭鎖堂等(2002)的研究方法進行操作,高鹽低pH法參照楊萍等(2004)、楊恩等(2005)的研究方法進行操作,尿素法參照李菊芬等(2008b)的研究方法進行操作。最后檢測DNA的質量和純度。
1. 2. 3 改良CTAB法提取甜瓜半粒種子DNA的優化試驗
1. 2. 3. 1 裂解時間優化 采用2% CTAB提取液提取甜瓜半粒干種子DNA,先用苯酚/氯仿/異戊醇(體積比25∶24∶1)抽提1次,再用氯仿/異戊醇(體積比24∶1)抽提1次,裂解時間設為10、20和30 min,其他條件同1.2.2。最后檢測DNA的質量和純度。
1. 2. 3. 2 CTAB提取液濃度優化 分別用1%、2%和3% CTAB提取液提取甜瓜半粒干種子DNA,裂解時間30 min,先用苯酚/氯仿/異戊醇(體積比25∶24∶1)抽提1次,再用氯仿/異戊醇(體積比24∶1)抽提1次,其他條件同1.2.2。最后檢測DNA提取質量和純度。
1. 2. 3. 3 苯酚抽提次數優化 用2% CTAB提取液提取甜瓜半粒干種子DNA,裂解時間30 min,抽提方法設以下3種:苯酚抽提0次,即僅用氯仿/異戊醇(體積比24∶1)抽提1次;苯酚抽提1次,即先用苯酚/氯仿/異戊醇(體積比25∶24∶1)抽提1次,再用氯仿/異戊醇(體積比24∶1)抽提1次;苯酚抽提2次,即先用苯酚/氯仿/異戊醇(體積比25∶24∶1)抽提2次,再用氯仿/異戊醇(體積比24∶1)抽提1次,其他條件同1.2.2。最后檢測DNA提取質量和純度。
1. 2. 4 DNA提取質量和純度檢測
1. 2. 4. 1 紫外分光光度法檢測 取2 μL DNA提取液,利用超微量核酸蛋白測定儀測定DNA的質量濃度(ng/μL)及純度(在260、280和230 nm波長處的吸光值),DNA含量(mg)=質量濃度×50×10-6;DNA提取率(mg/g)=DNA含量/半粒種子干重。DNA質量判定方法:純DNA的OD260/OD280≈1.8,當OD260/OD280為1.8~2.0時屬于正常范圍,<1.8說明有蛋白質污染,>2.0說明有RNA污染;OD260/OD230>2.0,說明無多糖、酚類和小分子雜質污染。
1. 2. 4. 2 瓊脂糖凝膠電泳檢測 提取的DNA用1.5%瓊脂糖凝膠電泳檢測(120 V,25 min),并用凝膠成像系統進行觀察拍照。
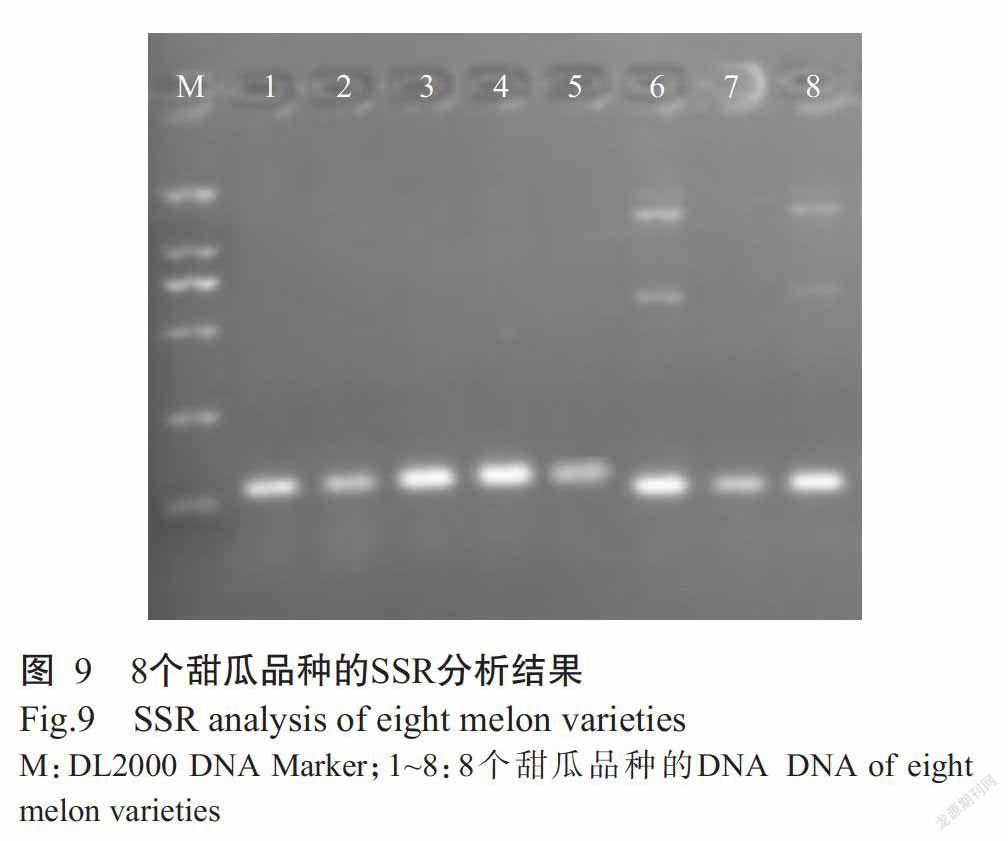
1. 2. 5 SSR分析驗證優化后改良CTAB法提取DNA的效果 采優化后的CTAB法提取8個甜瓜品種半粒干種子DNA,以其作為模板進行SSR分子標記分析,TJ10-F(5'-ACGAGGAAAACGCAAAATCA-3')和TJ10-R(5'-TGACGTGGACGACATTTTT-3')引物為甜瓜的SSR核心引物(宋海斌等,2012)。PCR反應體系20.0 μL:10×Buffer(含Mg2+)2.0 μL,dNTP 2.0 μL,TJ10F和TJ10-R引物各1.0 μL,Taq DNA聚合酶0.2 μL,DNA模板2.0 μL ddH2O補足至20.0 μL。擴增程序:94 ℃預變性5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,進行35個循環;72 ℃延伸10 min。PCR產物用2.0%瓊脂糖凝膠電泳檢測(120 V,25 min),并用凝膠成像系統進行觀察拍照。
2 結果與分析
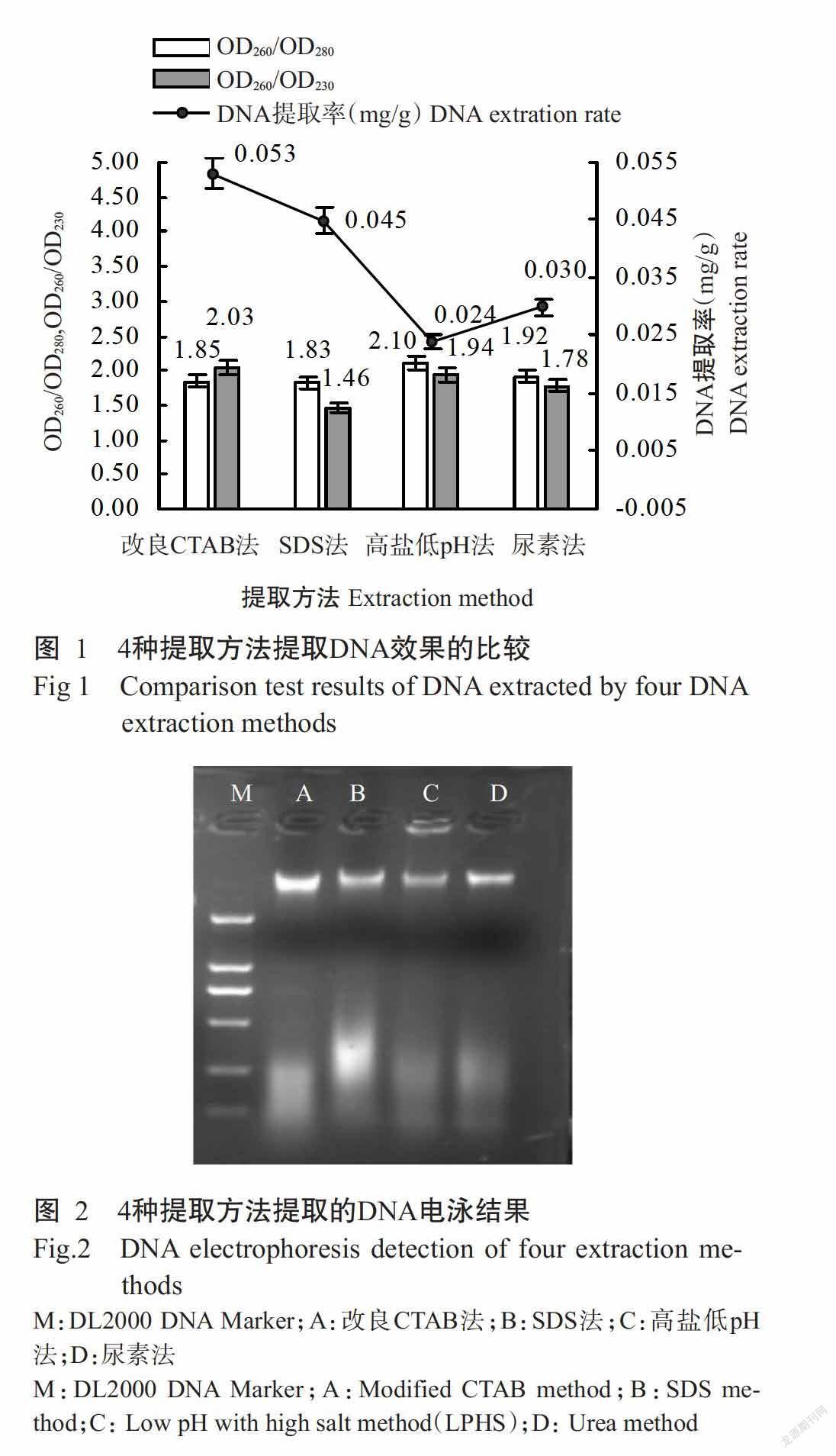
2. 1 不同提取方法的比較結果
以改良CTAB法、SDS法、高鹽低pH法和尿素法分別提取甜瓜半粒干種子DNA,并用紫外分光光度計和瓊脂糖電泳檢測DNA提取效果,結果如圖1和圖2所示。利用4種提取方法均能獲得甜瓜半粒干種子DNA,DNA條帶干凈,無明顯的RNA和蛋白污染,其中,改良CTAB法的DNA提取率最高,為0.053 mg/g,且DNA條帶最亮,其次是SDS法,高鹽低pH法的DNA提取率最低,僅為0.024 mg/g,DNA條帶較弱。4種提取方法提取的DNA OD260/OD280為1.83~2.10,其中SDS法和改良CTAB法提取的DNA OD260/OD280更接近1.80,表明這2種提取方法提取的DNA純度較高。僅改良CTAB法提取的DNA OD260/OD230>2.0,其他3種方法均小于2.00,說明SDS法和尿素法提取的DNA被酚類、多糖和小分子雜質污染。綜上所述,改良CTAB法為提取甜瓜半粒于種子DNA的最佳方法。
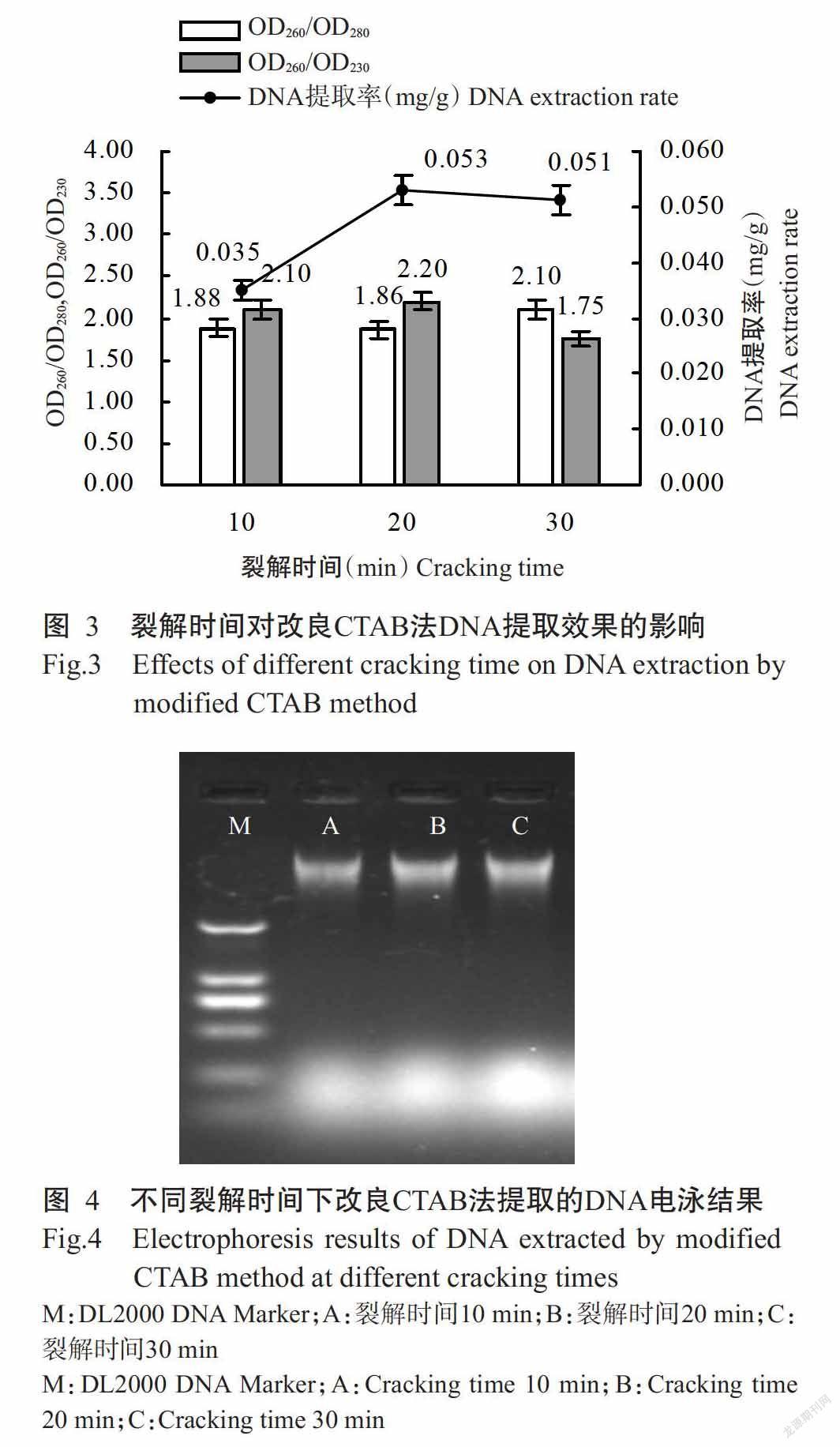
2. 2 裂解時間對改良CTAB法DNA提取效果的影響
由圖3可知,改良CTAB法DNA提取率隨裂解時間增加呈先升高后降低的變化趨勢,即裂解時間為20 min時DNA提取率達最大值,其原因是細胞裂解釋放DNA是一個緩慢溶出的過程,時間的延長有助于DNA溶出,但超過一定時間后樣品DNA不再溶出,即使裂解時間繼續增加,DNA提取率也不再升高。不同的裂解時間對提取的DNA質量同樣影響較大,當裂解時間為10和20 min時,提取的DNA質量無明顯差異,OD260/OD280和OD260/OD230均在正常范圍內,且DNA條帶清晰,無明顯拖尾現象,但裂解時間為20 min時,DNA條帶更亮(圖4)。當裂解時間為30 min時,提取的DNA質量明顯下降,OD260/OD280達2.10,說明其被RNA污染,OD260/OD230為1.75,說明其被酚類、多糖和小分子雜質污染,其電泳圖(圖4)也表現出該問題。綜上所述,采用改良CTAB法提取甜瓜半粒干種子DNA時,最佳裂解時間為20 min。
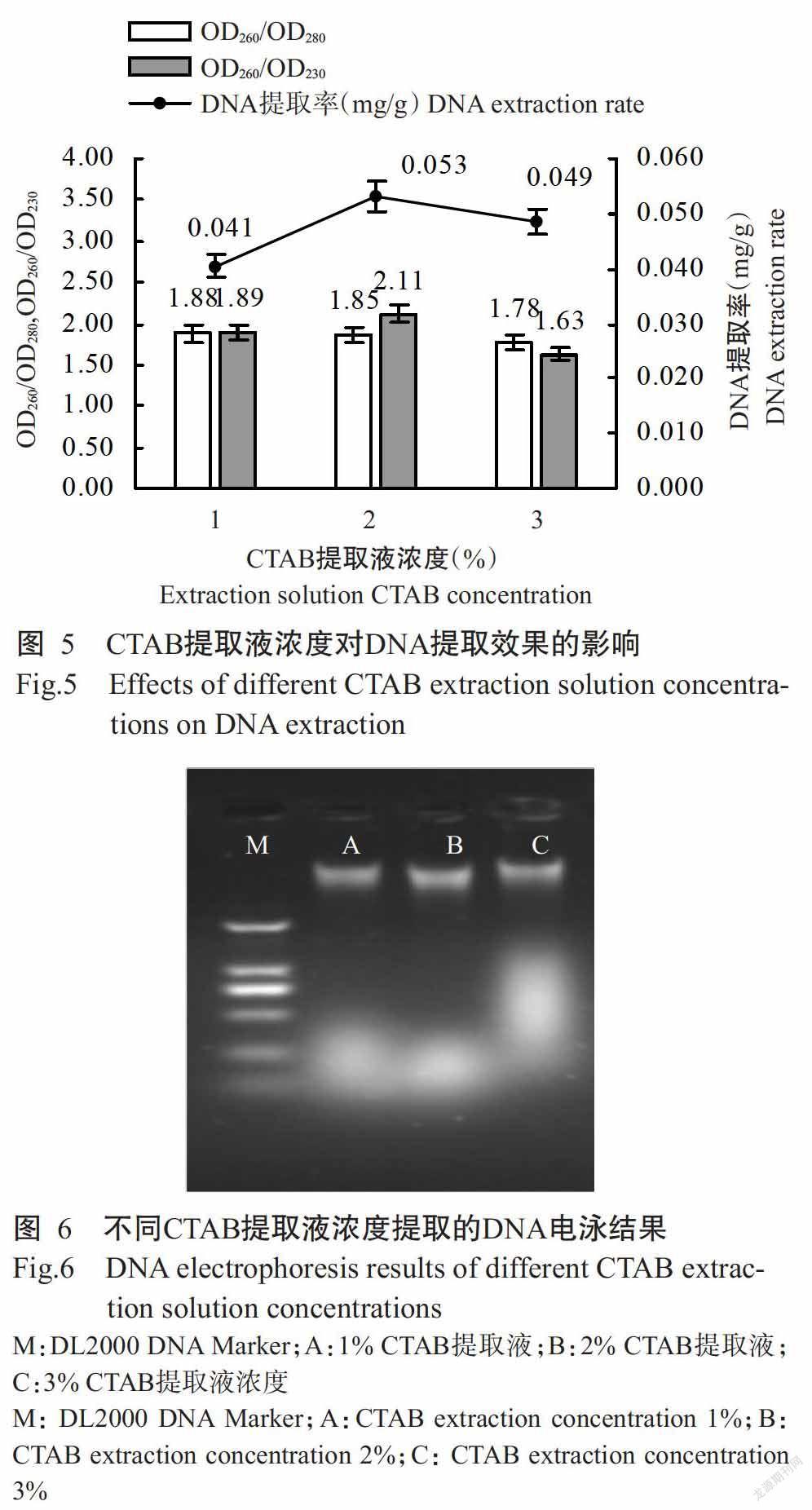
2. 3 CTAB提取液濃度對DNA提取效果的影響
由圖5和圖6可知,隨CTAB提取液濃度的增加,DNA提取率呈先增加后降低的變化趨勢,即2% CTAB提取液的DNA提取率達最大值,且DNA條帶最亮,分布集中,無拖尾現象,OD260/OD280為1.85,OD260/OD230為2.11,而另外兩個CTAB提取液濃度提取的DNA OD260/OD230均小于2.00;3% CTAB提取液的DNA提取率略有降低,且DNA的質量和純度均降低,OD260/OD280為1.78,OD260/OD230為1.63。綜上所述,1%和3% CTAB提取液提取的甜瓜半粒干種子DNA易被多酚、糖類和小分子雜質污染,2% CTAB提取液提取甜瓜半粒干種子DNA的效果最佳。
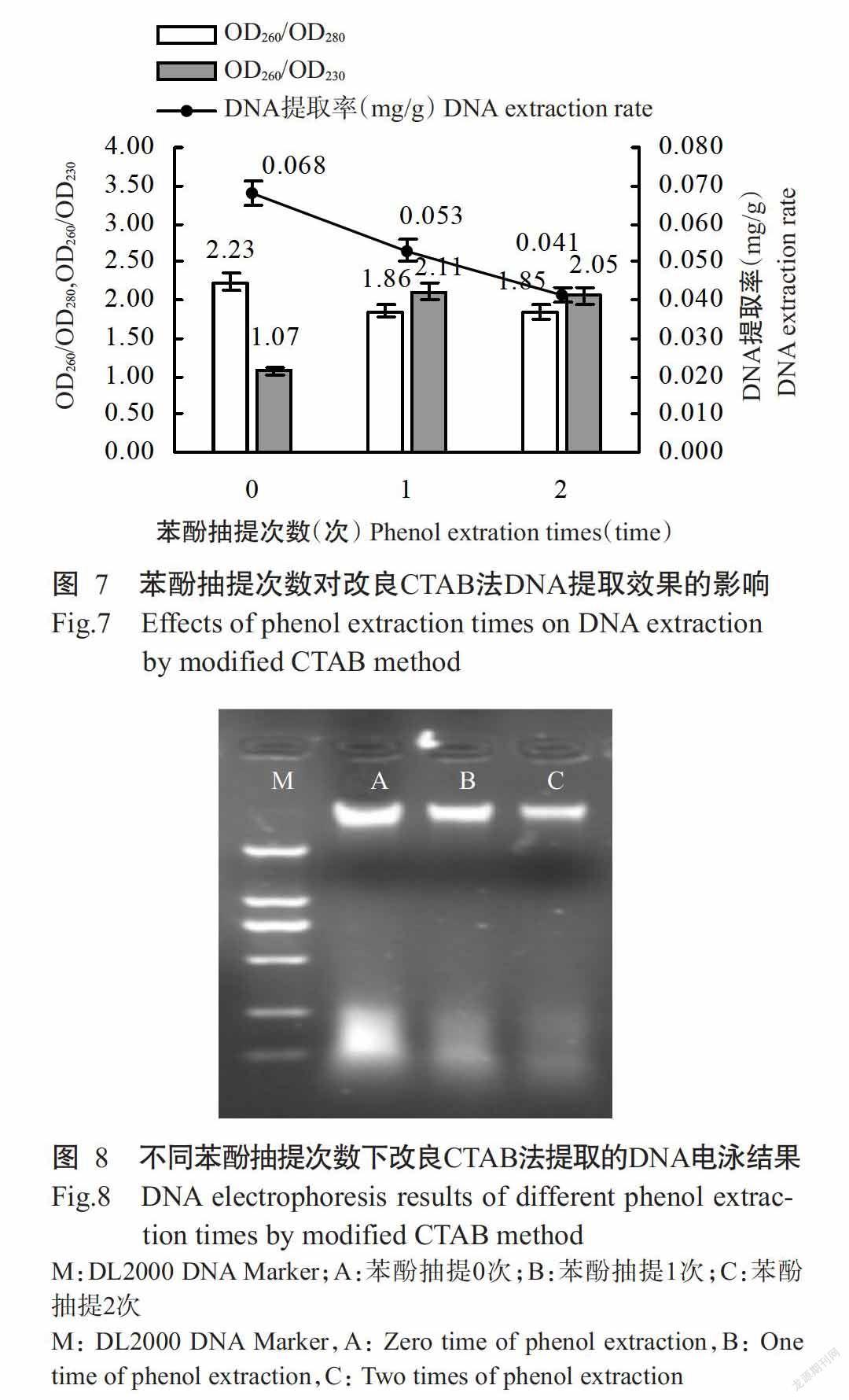
2. 4 苯酚抽提次數對改良CTAB法DNA提取效果的影響
由圖7和圖8可看出,隨著苯酚抽提次數的增加,改良CTAB法DNA提取率明顯降低,當用苯酚抽提2次時,提取的DNA質量較好,OD260/OD280為1.85,OD260/OD230為2.05,但DNA提取率僅為0.041 mg/g;而未經苯酚抽提時,雖然DNA提取率最高,但DNA質量較差,OD260/OD280為2.23,OD260/OD230為1.07,說明被較多的蛋白、多糖和酚類物質污染。由圖8也可看出,不用苯酚抽提時,提取DNA條帶最亮,但有明顯拖帶,而用苯酚抽提過1次或2次的DNA條帶表現較集中,拖尾少。因此,從實際操作和成本綜合考慮出發,DNA最佳抽提方式為先用苯酚/氯仿/異戊醇抽提1次,再用氯仿/異戊醇抽提1次。
2. 5 優化后的改良CTAB法提取DNA質量驗證結果
以優化后的改良CTAB法提取甜瓜半粒干種子DNA,以此為模板進行SSR分子標記分析,結果如圖9所示。電泳條帶穩定、清晰、基本無雜帶,可清楚區分品種間的差異,表明從優化后的改良CTAB法提取甜瓜半粒干種子DNA中能擴增得到穩定的譜帶,完全滿足SSR分子標記分析的要求。
3 討論
前人研究多以甜瓜幼苗、子葉、嫩葉等為材料提取基因組DNA(陳金體和王曉峰,2007;馬海財等,2010;李超等,2017)。本研究以半粒干種子為材料提取甜瓜基因組DNA,結果表明,改良CTAB法的提取效果優于SDS法、高鹽低pH法和尿素法,與李菊芬等(2008a)研究認為尿素法提取甜瓜種子DNA最佳的結論不一致。本研究中,改良CTAB法和尿素法均能提取獲得較好的DNA,但尿素法提取的DNA被苯酚、多糖和小分子雜質污染,且DNA提取率相對較低。目前,CTAB法已廣泛應用于提取大豆(姚丹等,2009)、水稻(李炫麗等,2011;王惠等,2013)、小麥(丁海燕和丁晨,2016)、玉米(董永軍,2017)等作物種子DNA,提取效果較好。
本研究通過分析改良CTAB法中CTAB提取液濃度對DNA提取效果的影響,結果發現,CTAB提取液濃度不宜過高,否則會明顯影響DNA的質量,與姚丹等(2009)的研究結論一致,其原因可能是CTAB具有較強去污能力,其溶解細胞膜后結合核酸,并與蛋白和多聚糖形成復合物,使核酸更容易分離,但若樣品量較少,過高濃度的CTAB不易去污,造成DNA提取質量下降。因此,適宜的CTAB提取液濃度對提取高質量的DNA非常重要。
DNA提取過程中水浴裂解時間對DNA的釋放至關重要,裂解時間過短,DNA釋放不完全導致難以獲得DNA;但時間過長,會增加DNA降解的風險。本研究通過分析不同裂解時間對改良CTAB法DNA提取效果的影響,結果發現,裂解時間為20 min時DNA提取率最高,且DNA條帶清晰,無明顯的拖尾現象,說明采用改良CTAB法提取甜瓜半粒干種子DNA時,最佳裂解時間為20 min,比以甜瓜幼苗、子葉、嫩葉等為材料的裂解時間短(陳金體和王曉峰,2007;馬海財等,2010;李超等,2017),其原因可能是本研究以半粒干種子為材料提取的DNA較少,所以所需的時間較少。
本研究僅初步優化改良CTAB法提取甜瓜半粒干種子DNA的相關影響因素,為了保證后續甜瓜分子標記分析的順利開展,還應根據不同的實驗要求做進一步改進,有效提高DNA質量,為甜瓜分子育種研究打下基礎。
4 結論
優化后的改良CTAB法提取甜瓜半粒干種子DNA效果較好,可滿足甜瓜種子分子標記和遺傳多樣性分析等分子實驗需求。
參考文獻:
陳金體,王曉峰. 2007. RAPD分子標記鑒定甜瓜種子純度試驗[J]. 廣東農業科學,(10):17-20. [Chen J T,Wang X F. 2007. Genetic purity test of Cucumismelo L. seeds by RAPD markers[J]. Guangdong Agricultural Sciences,(10):17-20.]
陳汝,王金政,薛曉敏,王貴平. 2017. 蘋果炭疽菌DNA改良提取法及PCR體系的優化[J]. 江西農業學報,29(4):69-71. [Chen R,Wang J Z,Xue X M,Wang G P. 2017. Comparison of several modified DNA extraction methods and optimization of PCR system for Colletotrichum gloeosporioides in apple[J]. Acta Agriculturae Jiangxi,29(4):69-71.]
丁海燕,丁晨. 2016. 小麥籽粒DNA提取方法的比較及SSR反應體系的優化研究[J]. 麥類作物學報,36(3):287-291. [Ding H Y,Ding C. 2016. Comparison of DNA extraction methods from wheat grain and the optimization of SSR system[J]. Journal of Triticeae Crops,36(3):287-291.]
董永軍,王陸軍,郝建平. 2017. 玉米干種子基因組DNA提取方法的改進[J]. 山西農業科學,45(12):1903-1906. [Dong Y J,Wang L J,Hao J P. 2017. Improvement of genomic DNA extraction method from maize dry seeds[J]. Journal of Shanxi Agricultural Science,45(12):1903-1906.]
李超,孫玉萍,楊英,徐暢,張瑞,廖新福. 2017. 應用SSR標記鑒定甜瓜新品種純度與真實性研究[J]. 分子植物育種,15(8):3088-3096. [Li C,Sun Y P,Yang Y,Xu C,Zhang R,Liao X F. 2017. Application of SSR markers in purity and authenticity identification for melon new hybrid cultivars[J]. Molecular Plant Breeding,15(8):3088-3096.]
李菊芬,史蕾蕾,張偉,許玲,馬國斌. 2008a. 甜瓜總DNA提取方法比較研究[J]. 上海農業學報,(1):32-35. [Li J F,Shi L L,Zhang W,Xu L,Ma G B. 2008a. Comparison of methods to extract total DNA from melon(Cucumismelo L.)[J]. Acta Agriculture Shanghai,(1):32-35.]
李菊芬,許玲,馬國斌. 2008b. 應用SSR分子標記鑒定甜瓜雜交種純度[J]. 農業生物技術學報,16(3):494-500. [Li J F,Xu L,Ma G B. 2008b. Identification of melon hybrid purity by SSR markers[J]. Journal of Agricultural Biotechnology,16(3):494-500.]
李炫麗,王世才,許雙全. 2011. 水稻單粒種子DNA提取及SSR-PCR反應體系的正交設計優化[J]. 中國種業,(8):46-49. [Li X L,Wang S C,Xu S Q. 2011. Orthogonal design optimization of single seed DNA extraction and SSR-PCR reaction system for rice[J]. China Seed Industry,(8):46-49.]
馬海財,馬雄,柳劍麗,鞏紅冬. 2010. 利用SSR分子標記構建甜瓜遺傳圖譜[J]. 福建農林大學學報(自然科學版),39(1):47-52. [Ma H C,Ma X,Liu J L,Gong H D. 2010. Construction of a molecular genetic map from melon with SSR markers[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition),39(1):47-52.]
彭鎖堂,顏啟傳,王學德,張春榮. 2002. 水稻單粒種子DNA提取及RAPD程序優化研究[J]. 上海交通大學學報(農業科學版),20(1):35-41. [Peng S T,Yan Q C,Wang X D,Zhang C R. 2002. DNA extraction from single seeds and optimizing RAPD procedure in rice[J]. Journal of Shanghai Jiaotong University(Agricultural Science),20(1):35-41.]
宋海斌,崔喜波,馬鴻艷,朱子成,欒非時. 2012. 基于SSR標記的甜瓜品種(系)DNA指紋圖譜庫的構建[J]. 中國農業科學,45(13):2676-2689. [Song H B,Cui X B,Ma H Y,Zhu Z C,Luan F S. 2012. Construction of DNA fingerprint database based on SSR marker for varieties(lines) of Cucumismelo L.[J]. Scientia Agricultura Sinica,45(13):2676-2689.]
王惠,郭峰,關超,段玉璽,白洪志. 2013. 適用于SSR分析的半粒水稻干種子DNA快速提取[J]. 科技導報,31(25):58-60. [Wang H,Guo F,Guan C,Duan Y X,Bai H Z. 2013. Rapid DNA extractionfrom half-grain rice dry seeds for SSR analysis[J]. Science and Technology Herald,31(25):58-60.]
王振東,孫倉,王惠. 2008. 不同方法從大豆不同組織中提取基因組DNA效果的比較[J]. 大豆科學,27(1):42-45. [Wang Z D,Sun C,Wang H. 2008. Comparison of geno-mic DNA extracted from different tissues of soybean by different methods[J]. Soybean Science,27(1):42-45.]
楊恩,陳少瑜,張雨,范志遠,習學良. 2005. 漾濞核桃葉片基因組DNA的兩種提取方法效果比較[J]. 西部林業科學,34(4):73-75. [Yang E,Chen S Y,Zhang Y,Fan Z Y,Xi X L. 2005. Comparison on effect between two methods of DNA extraction from leaves of Juglans sigillata[J]. Journal of West China Forestry Science,34(4):73-75.]
楊萍,胡永萍,王正加. 2004. 擬單性木蘭種子DNA提取方法的研究[J]. 浙江林業科技,24(1):25-26. [Yang P,Hu Y P,Wang Z J. 2004. Study on DNA extraction method of pseudomono genetic magnolia seeds[J]. Journal of Zhe-jiang Forestry Science & Technology,24(1):25-26.]
姚丹,張揚,曲靜,張迪,王丕武. 2009. 用于SSR分析的大豆干種子DNA提取條件的優化[J]. 安徽農業科學,37(23):10917-10921. [Yao D,Zhang Y,Qu J,Zhang D,Wang P W. 2009. Optimization of the conditions for extracting DNA for SSR analysis from dry soybean seeds[J]. Journal of Anhui Agricultural Sciences,37(23):10917-10921.]
趙光偉,歐點點,賀玉花,徐志紅,孔維虎,張健,王平勇,徐永陽. 2017. SSR標記對甜瓜雜交種‘眾天翠雪’純度的鑒定[J]. 中國農學通報,33(9):37-40. [Zhao G W,Ou D D,He Y H,Xu Z H,Kong W H,Zhang J,Wang P Y,Xu Y Y. 2017. Purity identification of ‘Zhongtian cuixue’melon hybrid with SSR markers[J]. Chinese Agricultural Science Bulletin,33(9):37-40.]
(責任編輯 陳 燕)

