產吡咯喹啉醌的生絲微菌內參基因的篩選和驗證
劉孟粟 鐘璐芳 柯崇榕 高敏 夏華平 任洋 黃建忠

摘 要:篩選生絲微菌表達調控研究中最適合的內參基因,為后續大幅度提高吡咯喹啉醌(PQQ)產量打下基礎。利用實時熒光定量PCR(Realtime quantitative PCR, RTqPCR)技術分析生絲微菌基因組中6個候選內參基因的相對表達情況,通過Bestkeeper、geNorm和NormFinder軟件分析,評價各個生長時期候選內參基因的表達穩定性,確定最合適的內參基因。結果表明:通過對生絲微菌4個不同生長時期的6個候選內參基因(16S rRNA、gapdh、recA、ldh、rpoB和S5)的轉錄情況進行分析和評估,6個候選內參基因均表現出較強的穩定性和特異性,依據3款軟件的綜合評價,確定gapdh、recA這兩個內參基因在兩株菌株不同時期均能穩定表達。從6個候選內參基因中篩選出兩個表達穩定的內參基因gapdh基因和recA基因,用于后續生絲微菌的基因表達調控研究。
關鍵詞:吡咯喹啉醌;生絲微菌;內參基因;實時熒光定量PCR
中圖分類號:Q93 ? 文獻標志碼:A ? 文章編號:0253-2301(2019)11-002
DOI: 10.13651/j.cnki.fjnykj.2019.11.002
Screening and Validation of Internal Reference Genes of Hyphomicrobium of Pyrroloquinoline Quinone
LIU Mengsu, ZHONG Lufang, KE Chongrong, GAO Min, XIA Huaping, REN Yang, HUANG Jianzhong*
Abstract:The screening of the most suitable internal reference genes for the study on the regulation of the expression of Hyphomicrobium has laid a foundation for greatly increasing the yield of Pyrroloquinoline Quinone (PQQ). The Realtime quantitative PCR technology was used to analyze the relative expression of 6 candidate reference genes in the genome of Hyphomicrobium. And the softwares of Bestkeeper, geNorm and NormFinder were used to evaluate the expression stability of candidate reference genes in each growth period and determine the most appropriate reference genes. The results showed that through the analysis and evaluation on the transcription situation of the six candidate reference genes (16S rRNA、gapdh、recA、ldh、rpoB and S5) at four different growth periods of Hyphomicrobium, the six candidate reference genes all showed a greater stability and specificity. And according to the comprehensive assessment of the three softwares, it was determined that the two internal reference genes gapdh and recA could be expressed stably in the two strains at different periods. Therefore, the genes gapdh and recA with stable expression were selected from the six candidate reference genes for further study on gene expression regulation of Hyphomicrobium.
Key words: Pyrrologuinoline quinone; Hyphomicrobium; Internal reference gene; Realtime fluorescence quantitative PCR
吡咯喹啉醌(pyrroloquinoline quinone,PQQ)是NAD/NADP和FMN/FAD之后的第三類氧化還原輔因子,是一類重要的醒蛋白輔基[1]。其廣泛存在于植物、動物和人體組織器官中,具有明顯的抗氧化特性,被廣泛地認為是一種高附加價值的生物基化學品[2-3]。生絲微菌作為PQQ的主要生產菌株之一,有必要分析PQQ合成基因的功能,更好的理解PQQ生物合成途徑及調控機制,深入探究其生物合成途徑中基因表達調控對PQQ產量的提高有重要的意義。
實時熒光定量PCR(RTqPCR)已成為定量研究功能基因組學中基因表達的重要研究工具,可以用于分析細菌、真菌、真核生物等不同生物體中特定基因的轉錄水平[4]。RTqPCR具有著精確的定量和靈敏度、特異性和可重復性的優點,但要使用RTqPCR分析基因表達,最重要的是選擇合適的內參基因[5-7]。目前,已有研究結果表明,RTqPCR結果受到許多因素的影響。例如,反轉錄效率、所提取RNA的質量、內參基因的穩定性和RTqPCR的擴增效率都將影響試驗結果的準確性[8-10]。因此,合適和穩定的內參基因的篩選是保證試驗數據可靠的前提。近期研究表明,PQQ更可能是一種抗神經變性、抗癌和藥理劑,并且可以作為信號分子起作用[11-12]。PQQ是哺乳動物生長發育和繁殖的必需生長因子,但是其自身并不能合成,只能從外界攝取[13-14]。目前能夠生產PQQ的物種包括Klebsiella pneumonia、Acinetobacter calcoaceticus、Methylobacterium extorquens、Gluconobacter oxydans、Enterobacter intermedium、Pseudomonas fluorescens和Pantoea ananatis[15],但是產量較低,生絲微菌是目前發現生產PQQ產量較高的菌株[16]。此外, PQQ是通過一個特殊的Pqq操縱子基因合成的,研究表明,PQQ生物合成所必需的基因包括PqqA、PqqB、PqqC、PqqD和PqqE[17]。PQQ的合成步驟基本解釋清楚,但是PQQ合成基因調控機制還不清楚,并且對于其內參基因的篩選和穩定性表達還鮮有報道。本研究以不同時期生長的生絲微菌作為材料,利用實時熒光定量PCR分析6個候選內參基因,通過Bestkeeper、NormFinder和geNorm綜合評估和分析,篩選出合適的內參基因,為后期試驗奠定基礎。
1 材料與方法
1.1 試驗材料
劉孟粟等:產吡咯喹啉醌的生絲微菌內參基因的篩選和驗證2019年第11期
2019年第11期劉孟粟等:產吡咯喹啉醌的生絲微菌內參基因的篩選和驗證
1.1.1 試驗菌株 生絲微菌FJNU6(Hyphomicrobium denitrificans FJNU6 )不同發酵時間(20、60、100、140 h)的2OD(OD650)菌液(每組3個平行),用DEPC水清洗2遍,用液氮速凍后保存在-80℃冰箱,用于提取RNA。此菌株由福建師范大學發酵工程研究中心分離保藏。
1.1.2 主要試劑與儀器 (1)主要試劑:總RNA提取試劑盒(廣州東盛生物科技有限公司),反轉錄試劑盒ProtoScript Ⅱ First Strand cDNA Synthesis Kit[NEB(北京)有限公司],Trizol、DNaseI酶[寶生物工程(大連)有限公司],熒光定量試劑盒FastStart Esswntial DNA Green Master(上海羅氏制藥有限公司)。(2)主要儀器:恒溫搖床(上海智城分析儀器制造有限公司)、5 L發酵罐系統(上海國強生化)、微量分光光度計(Denovix)、紫外可見分光光度計UV 1800(島津)、BeckMan冷凍離心機(BeckMan Coultek)、Mini T金屬浴(Allsheng)、LghtCycler@96羅氏熒光定量PCR儀(Roche)、Analytikjena PCR儀(Analytikjena)等儀器設備。
1.2 試驗方法
1.2.1 RNA提取和cDNA的合成 按RNA提取試劑盒說明書提取總RNA,經1%瓊脂糖凝膠電泳和Denovix微量分光光度計檢測RNA的質量和濃度,用DNA酶消化RNA中殘留的基因組,驗證無基因組污染后,取5 μg純化后的RNA根據逆轉錄試劑盒說明書將RNA逆轉錄成cDNA。反應體系(100 μL):d(T)23 VN 10 μL;ProtoScript Ⅱ Enzyme Mix (10×)10 μL;ProtoScript Ⅱ Reaction Mix (2×)50 μL;模板RNA 5 μL;最后用Nucleasefree H2O補足體積到100 μL,42℃金屬浴孵育1 h,然后在80℃條件下加熱5 min使酶失活,反轉出的cDNA于-20℃保存用于后續試驗,剩余的RNA于-80℃保存。
1.2.2 內參基因選擇與引物設計 根據文獻,選取6個常用的內參基因:16S rRNA、gapdh、recA、ldh、rpoB、S5作為候選基因[17-19]。結合生絲微菌FJNU6全基因組為模板,用AlleleID 6.0軟件設計引物。引物序列、長度和用途見表1。
1.2.3 實時熒光定量PCR 以每個內參基因的cDNA溶液依次稀釋10倍、20倍、30倍、40倍后為模板,進行RTqPCR試驗。采用羅氏實時熒光定量PCR儀與熒光染料,反應體系(25 μL):SYBR Premix Ex TaqⅡ(2×)12.5 μL、PCR Forward primer 1 μL、PCR Rorward primer 1 μL、RT反應液1 μL、ddH2O 9.5 μL。擴增條件:預變性95℃ 600 s;變性95℃ 10 s;解鏈58℃ 10 s;延伸72℃ 10 s,進行45個循環,重復3次。
1.2.4 數據處理和分析 使用羅氏的LightCycler
○R 96SW1.1程序分析出引物的擴增效率(表1)。利用Bestkeeper[20]、NormFinder[21]和geNorm[22]軟件對6個候選內參基因的穩定性進行評估。BestKeeper程序通過平均Ct值的方差系數(CV)和標準偏差(SD)兩個因素確定參考基因的穩定性等級。geNorm是通過統計候選基因的M值大小進而分析候選基因表達穩定性。NormFinder使用基于建模的方法計算組內和組間差異,檢測到穩定性最高的參考基因。根據公式(Q=2Ctmax-Ctsample,Q為相對表達量,Ctmax為各樣品中最大Ct值,Ctsample為各樣品Ct值)計算出相對表達量,最后根據權重重新排列。此外,Ct值的顯著性差異采用SPSS的ANOVA(單因素)分析。
2 結果與分析
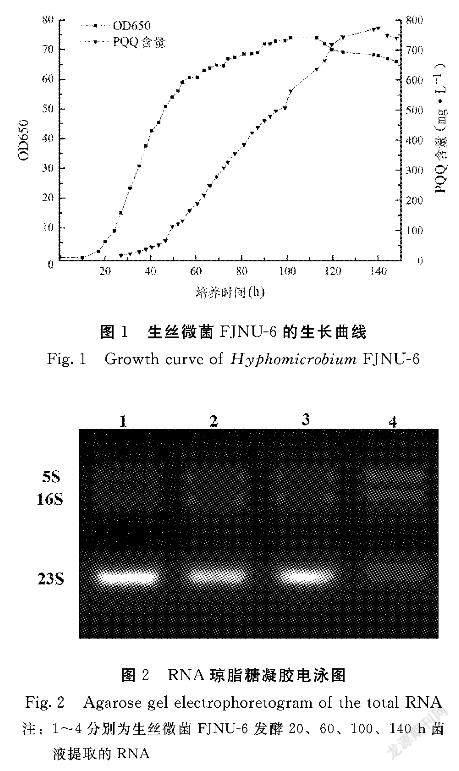
2.1 生絲微菌FJNU6生長曲線
在5 L罐中發酵培養FINU6,繪制的生長曲線如圖1所示(時間為橫坐標,OD650為縱坐標)。該曲線描述了絲狀微生物在發酵過程中的生長和PQQ合成。從圖1可以看出,0~24 h為滯后期,細胞基本處于未生長狀態,PQQ沒有合成。24~56 h為生絲微菌的對數生長期,菌體開始快速繁殖,PQQ初步合成。56~112 h是菌體進入穩定期,菌體的生長已經趨于平緩,此時PQQ大量合成。112 h后,細菌開始分解進入衰變期。因此,以培養過程中的24 h(細胞生長階段,PQQ未合成)、48 h(對數生長期、PQQ合成初期)、80 h(細胞生長穩定期)和120 h(細菌衰變期)為培養過程中提取RNA的關鍵點。
2.2 生絲微菌不同發酵時間總RNA提取
用Denvoix微分光光度計測定提取RNA濃度,A260/A280為1.9~2.0,表明樣品純度高。用1%瓊脂糖凝膠電泳法檢測總RNA。圖2結果表明,所提取的總RNA完整性較好,且未發生降解,符合以下試驗要求。
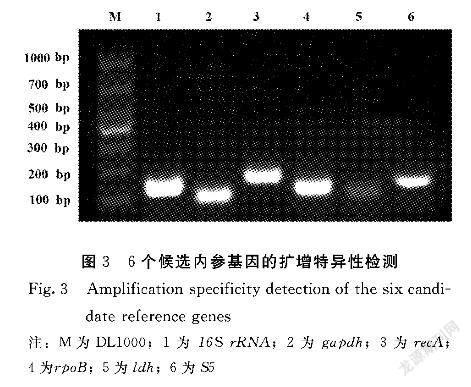
2.3 內參基因引物特異性及熒光定量PCR分析
將各樣品的cDNA等體積混合,混合溶液作為模板,通過PCR和凝膠電泳驗證內參基因引物的特異性。如圖3所示,PCR帶是單一的,沒有特異性擴增,沒有引物二聚體,片段大小與靶片段的大小一致。利用各樣品的cDNA作為模板,對6個候選內參基因進行RTqPCR,從圖4可以看出,6個候選內參基因的溶解曲線是尖銳的單一信號峰。另外,6個內參基因的特異性更好,反應特異性高,同時,6個內參基因的標準曲線R2大于0.99,表明Ct值與不同濃度cDNA的線性關系良好。另外,同一基因中不同曲線代表不同濃度的cDNA的定量反應后的溶解曲線(圖4中的左側),可見rpoB和16S的差異較小,使得這些基因對濃度的影響較小。gapdh、S5、recA和ldh基因的差異明顯,說明模板濃度的大小會影響gapdh、S5、recA和ldh的變化,并且在隨后的熒光定量試驗中應注意cDNA的濃度。因此,可以用于隨后的試驗。
2.4 6個候選內參基因穩定性分析
2.4.1 Bestkeeper分析 各候選內參基因的Ct值如表2所示,16S基因的表達水平較高(Ct值低,在6~8),不適合用作內參基因。由表2所得的Ct值,利用Bestkeeper軟件分析出Ct值的標準差std(Standard Deviation)和相關性系數r(coeff.of corr)。r值與基因間的相關性有關(r值越大,相關性越高);而std值與基因穩定性相關(std越小,穩定性越好)。由表3可知,r值:
gapdh>S5>16S>ropB>recA>ldh,std值:gapdh=recA<16S 2.4.2 geNorm分析 根據geNorm軟件分析,M值越小,說明候選內參基因在樣品中的表達越穩定。圖5所示,MS5>MrpoB>Mgapdh>Mldh>M16S=MrecA。其中16S和recA的M值最小,表明在不同時期這兩個基因表達最平穩。 通過配對差異值(Vn/Vn+1)確定內參基因數目,Vn/Vn+1的值越小,則差異越小,此時的n值即為所需內參基因的最佳數目。由圖6可知,V2/3的值最小,表明最適內參基因數目為2。 通過geNorm軟件的統計和分析,根據所得的M值和配對差異值V。16S和 recA可以用作生絲微菌內參基因的最優選擇。 2.4.3 NormFinder分析 NormFinder軟件是通過計算組內和組間差異來分析基因的表達穩定性。穩定性值(Stability value)越小,表明基因表達越穩定。NormFinder分析結果顯示:16S(0.014)、S5(0.021)、rpoB(0.029)、gapdh(0.030)、recA(0.034)、ldh(0.041),所有候選基因的隨機表達穩定值(S)均低于參考閥值,都可以作為內參基因使用。 綜合Bestkeeper、geNorm和NormFinder分析結果,最終選擇gapdh與recA作為生絲微菌的雙內參基因。 2.4.4 不同樣品中兩內參基因表達穩定性分析 進一步選用兩株生絲微菌FJNU6和FJNUY菌株分別以gapdh和recA作為內參基因,在4個不同發酵時間點的表達穩定性進行檢測和驗證。如圖7所示,gapdh和recA擴增的Ct值都在23~27,顯示出較高的表達水平。SPSS單因素方差分析統計結果為:gapdh基因的P值(Pvalue )為0.79>0.05,recA基因的P值為0.28>0.05。說明這兩個內參基因在不同發酵時間點和不同菌株之間的表達穩定。因此,gapdh和recA可以作生絲微菌的雙內參基因。 3 討論與結論 實時熒光定量PCR(RTqPCR)是對常規 PCR技術的進一步補充和發展,可以準確地分析基因在不同時期的表達差異性,已經成為分子生物學中研究基因表達的主要方法[23-24]。理想的內參基因的表達穩定性可以根據試驗條件而不同,不同的環境條件下,內參基因的表達水平可能存在差異[25-26]。目前,關于內參基因的篩選,許多都是通過分析和評估單個基因的穩定性[27-29],單個內參基因的應用可能會導致試驗結果的準確性差等風險。所以對于內參基因的篩選,為了達到最好的效果,需要考慮候選基因的穩定性和重復性,還要考慮內參基因的個數[30]。 研究表明,pqq合成基因的表達差異與PQQ產量有著直接關系[31],低pH和有限的氧氣環境也會影響pqq合成基因的表達[32],因此對pqq合成基因的表達研究對提高PQQ產量是很有必要的。我們通過查閱文獻并結合FJNUR6全基因組分析,選取了16S、gapdh、recA、ldh、rpoB、S5這6個基因作為候選內參基因。16S在大部分細菌中其序列都是保守的,常被用作內參基因,但是,16S在生絲微菌中的Ct值在6~8,表達量過高,不適合做生絲微菌的內參基因。雖然NormFinder分析結果表明6個候選內參基因都可以用作生絲微菌的內參基因使用,但是結合Bestkeeper和geNorm軟件的評估,gapdh和recA在樣品中穩定性好,適合用于多個內參的選擇。Gapdh是作為糖酵解過程中的關鍵酶,recA是參與DNA修復的recA蛋白的編碼基因,兩者與生物的生命活動息息相關,且表達相對穩定,常用作內參基因[33]。 由三款軟件分析并確定最終的內參基因為gapdh和recA,并進一步在兩株生絲微菌中驗證,這兩個內參基因在不同發酵時間點和不同發酵菌株中均穩定表達,可作為生絲微菌的內參基因。 利用Bestkeeper、geNorm和NormFinder 軟件的評估和分析,最終確定了gapdh和recA基因作為生絲微菌FJNU6實時熒光定量PCR的雙內參基因,同時使用兩個內參基因使試驗結果更加精確,這一研究結果為后續生絲微菌PQQ合成基因調控試驗提供了理論基礎。 參考文獻: [1]SUN Y H,WEI D,SHI J P,et al.TwoStage Fermentation for 2ketogluconic Acid Production by Klebsiella pneumoniae[J].Journal of microbiology and biotechnology,2014,24(6):781-787. [2]WEI P L,CHEN J,LU Y H,et al.High density cultivation of Dictyostelium discoideum in a rotating polyurethane foambed bioreactor[J].World Journal of Microbiology and Biotechnology,2010,26(6):1117-1123. [3]Zhang H L,Zhu J Z,Zhu X C,et al.Highlevel exogenous glutamic acidindependent production of poly(γgammaglutamic acid)with organic acid addition in a new isolated Bacillus subtilis C10[J].Bioresource Technology,2011,116:241-246. [4]LYU J,YANG C,ZHANG Y,et al.Selection of Reference Genes for the Normalization of RTqPCR Data in Gene Expression Studies in Insects:a Systematic Review[J].Frontiers in Physiology,2018,9:1560. [5]SUZUKI T,HIGGINS PJ,CRAWFORD D,et al.Control selection for RNA quantitation[J].Bio Techniques,2000,29(2):332-337. [6]VANDESOMPELE J,PRETER K D, PATTYN F,et al.Accurate normalization of realtime quantitative RTPCR data by geometric averaging of multiple internal control genes[J].Genome Biology,2002,3:0034. [7]SHAKEEL M,RODRIGUEZ A,TAHIR U B,et al.Gene expression studies of reference genes for quantitative realtime PCR:an overview in insects[J].Biotechnology Letters,2018,40(2):227-236. [8]肖翠,嚴什文,龍桂友,等.柑橘內參基因的穩定性評價[J].果樹學報,2012,29(6):978-984. [9]涂冬萍,莫長明,馬小軍,等.羅漢果實時熒光定量PCR內參基因的選擇[J].中國中藥雜志,2015,40(2):204-209. [10]HELLEMANS J,MORTIER G,DE P A,et al.QBase relative quantification framework and software for management and automated analysis of realtime quantitative PCR data[J].Genome Biology,2007,8:R19. [11]YU Y,WEI P L,ZHU X C,et al.Highlevel production of soluble pyrroloquinoline quinonedependent glucose dehydrogenase in Escherichia coli[J].Engineering in Life Sciences,2012,12(5):574-582. [12]RUCKER R,STORMS D,SHEETS A,et al.Is pyrroloquinoline quinone a vitamin[J].Nature,2005,433(7025):10-20. [13]KASAHARA T,KATO T.A new redoxcofactor vitamin for mammals[J].Nature,2003,422(6934):832. [14]ANDREEVA I G,GOLUBEVA L I,KUVAEVA T M,et al.Identification of Pantoea ananatis gene encoding membrane pyrroloquinoline quinone (PQQ)dependent glucose dehydrogenase and pqqABCDEF operon essential for PQQ biosynthesis[J].FEMS Microbiology Letters,2011,318(1):55-60. [15]URAKAMI T,YASHIMA K,KOBAYASHI H,et al.Production of pyrroloquinoline quinone by using methanolutilizing bacteria[J].Applied and environmental microbiology,1992,58(12):3970-3976. [16]CHOI O,KIM J,KIM J,et al.Pyrroloquinoline quinone is a plant growth promotion factor produced by Pseudomonas fluorescens B16[J].Plant Physiology,2008,146(2):657-668. [17]SAVARD P,ROY D.Determination of Differentially Expressed Genes Involved in Arabinoxylan ?Degradation ?by Bifidobacterium longum NCC2705 ?Using RealTime RTPCR[J].Probiotics and Antimicrobial Proteins,2009,1(2):121-129. [18]MARCO M L,KLEEREBEZEM M.Assessment of realtime RT PCR for quantification of Lactobacillus lantarum gene expression during stationary phase and nutrient starvation[J].Journal of applied microbiology,2008,104(2):587-594. [19]SPINSANTI Q,FANTI C,MARSILI L,et al.Selection of reference genes for quantitative RTPCR studies in striped dolphin(Stenella coeruleoalba)skin biopsies[J].BMC Molecular Biology,2008,66(1):141-141. [20]PFAFFL M W,TICHOPAD A,PRGOMET C,et al.Determination of stable housekeeping genes,differentially regulated target genes and sample integrity:BestKeeperExcelbased tool using pairwise correlations[J].Biotechnology Letters,2004,26(6):509-515. [21]ANDERSEN C L,JENSEN J L,RNTOFT T F,et al.Normalization of realtime quantitative reverse transcriptionPCR data: a modelbased variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer data sets[J].Cell and Tumor Biology,2004,64(15):5245-5250. [22]XU Y Y,LI H,LI X G,et al.Systematic selection and validation of appropriate reference genes for gene expression studies by quantitative realtime PCR in pear[J].Acta Physiologiae Plantarum,2015,37(2):40. [23]陳旭,齊鳳坤,康立功,等.實時熒光定量PCR技術研究進展及其應用[J].東北農業大學學報(自然科學版),2010,41(8):148-155. [24]RADONIC A,THULKE S,MACKAY I M,et al.Guideline to reference gene selection for quantitative realtime PCR[J].Biochemical and Biophysical Research Communications,2004,313(4):856-862. [25]CAPPELLI K,FELICETTI M,CAPOMACCIO S,et al.Exercise induced stress in horses:Selection of the most stable reference genes for quantitative RTPCR normalization[J].BMC Molecular Biology,2008,9(1):1-8. [26]SANG J,WANG Z N,LI M,et al.ICG:a wikidriven knowledgebase of internal control genes for RTqPCR normalization[J].Nucleic Acids Research,2018,46(D1):D121-D126. [27]COURTNEY E J,CHARKOWSKI A O,WILLIS D K.Evaluation of isolation methods and RNA integrity for bacterial RNA quantitation[J].Journal of Microbiological Methods,2008,75(2):318-324. [28]WANG Y Z,DAI M S,CAI D Y,et al.Characterizing the expression of translation elongation factor gene EF1α in pear(Pyres)fruit:evaluation of EF1α as a housekeeping gene[J].Tree Genetics & Genomes,2018,14(4):62. [29]TAO Y X,PEER A F V,HUANG Q H,et al.Identification of novel and robust internal control genes from Volvariella volvacea that are suitable for RTPCR in filamentous fungi[J].Scientific Reports,2016,6:29236. [30]BUSTIN S A,BENES V,GARSON J A,et al.The MIQE Guidelines:Minimum Information for Publication of Quantitative RealTime PCR Experiments[J].Clinical chemistry,2009,55(4):611-622. [31]PUEHRINGER S,METLITZKY M,SCHWARZENBACHER R,et al.The pyrroloquinoline quinone biosynthesis pathway revisited:a structural approach[J].BMC Biochemistry,2008,9:1471-1482. [32]GE X,WANG W X,DU B H,et al.Multiple pqqA genes respond differently to environment and one contributes dominantly to pyrroloquinoline quinone synthesis[J].Journal of Basic Microbiology,2013,55(3):312-323. [33]張慧琴,謝鳴,肖金平,等.獼猴桃實時熒光定量PCR分析中內參基因的篩選[J].浙江農業學報,2015,27(4):567-573. (責任編輯:林玲娜) 收稿日期:2019-11-02 作者簡介:劉孟粟,男,1993年生,碩士研究生,主要從事微生物代謝工程調控研究。 共同第一作者:鐘璐芳,女,1992年生,碩士研究生,主要從事微生物生理生化研究。 通信作者:黃建忠,男,1966年生,教授,主要從事微生物功能基因和工業酶制劑的研發工作(Email:hjz@fjnu.edu.cn)。 基金項目:國家自然科學基金項目 (21807011);福建省自然科學基金項目 (2018J01673);福建省省屬高校科研專項(JK2017012)。

