磁共振成像在評價肝癌射頻消融術療效中的應用及其相應影像學特征分析
李齊云,馬東東,張珍珍
1.上海國際醫學中心影像中心(上海200210);2.安徽省亳州市人民醫院影像中心(亳州236800)
一直以來,肝癌(HCC)發病率及死亡率位居惡性腫瘤前5位,每年約有60萬人死于肝癌[1-2]。肝癌射頻消融治療術(Radiofrequency ablation,RFA)為臨床局部治療靶區癌變組織的最有效方法,因具有微創、安全性好、副作用少等優點目前已成為臨床首選治療方式。其主要借助超聲、CT或MRI等影像學方法進行引導,通過物理消融方法,利用10kHz以上的高頻電流使活體組織中組織離子隨電流方向的變化產生物理震動,進而通過產生的熱量引起組織凝固性壞死,其5年生存率與開腹手術相近[3],但由于技術條件受限其常會由于不完全消融導致腫瘤無法完全消除,仍有局部進展的可能。因此進行RFA治療后,臨床CT或MRI動態增強進行隨訪仍有重要的意義。
資料與方法
1 一般資料 收集2013年1月至2017年12月于本院及安徽省亳州市人民醫院收治的行射頻消融治療患者75例,男41例,女34例,年齡55~72歲,平均(59.1±6.9)歲;Eggel分型為:巨塊型35例,結節型21例,彌漫型19例。上腹部悶痛、黃疸、乏力或食欲減退等臨床癥狀發現患病52例,常規體檢發現23例。實驗室檢查HBsAg升高患者75例,AFP升高患者73例,CEA升高患者21例。原發性肝癌52例,轉移性肝癌23例(乳腺癌轉移10例,結腸癌轉移9例,直腸癌轉移4例)。患者于首次進行射頻消融術前2 d進行MRI檢查,術后1、3、6、12個月隨訪復查。
2 治療方法 射頻消融治療根據腫瘤大小采用相應規格的射頻針(RITA 1500×多級射頻),通過CT(西門子雙源螺旋CT)定位穿刺的角度及深度后,采用靜脈鎮靜(或長時間手術采用全身麻醉)結合穿刺點2%利多卡因局部麻醉后經皮經肝穿刺。穿刺進針后重復CT掃描,觀察穿刺針與肝臟之間的位置關系,避開大血管、肝膽管及重要臟器,繼續進針至瘤體內部近側,再次復查CT,射頻針定位后由大至小逐步展針,超出腫瘤范圍1 cm左右正常肝組織,退針時消融。
3 儀器與檢查方法 消融術后,采用西門子3.0T超導型MRI進行平掃及動態增強掃描。患者檢查前常規禁食禁水6 h。掃描前對患者進行呼吸訓練,掃描過程中指導檢查者閉氣。平掃序列為橫斷位T1WI(SE序列,TR109ms,TE4.76ms,矩陣384×512,FOV263×350 mm)及T2WI(快速自旋回波序列,TR1500ms,TE100ms,矩陣480×640,FOV263×350 mm;軸位脂肪移植序列,TR1500ms,TE100ms,矩陣480×640,FOV263×350mm),DWI(擴散加權成像)。增強掃描采用高壓注射器經肘部靜脈注入對比劑(釓噴酸葡胺注射液2ml/s,0.15mmol/kg);三維容積內插快速擾相GRE T1WI(VIBE)行三期動態掃描,在22 s、55 s、3 min行動脈期、門靜脈期和平衡期動態掃描,層厚3~5 mm,無間隔。
4 研究方法 所有影響資料依托Syngo工作站展開,選取2名有10年以上獨立閱片經驗的診斷醫師對所有MR平掃及增強掃描圖像、DWI序列圖及ADC值進行獨立分析,對各影像學資料中的組織顯影信號進行判讀。避開壞死區域選擇病灶實質信號均勻一致的地方作為ROI(興趣區)進行測量,相同部位連續層面選取3層ROI,其平均值即作為病灶實質ADC值;避開壞死區、周圍血管及肝、膽管結構,相同部位連續層面選取3層ROI,其平均值記為過渡區ADC值;除去周圍血管、肝膽管,相同部位連續選取3層,測定平均值為正常肝臟ADC值。
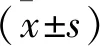
結 果
1 MRI表現 術后掃描RFA區域可見完整環形T1WI高信號改變,術后96.23%病灶較術前增大,術后12個月90.57%的病灶縮小。復發患者表現為T1、T2長改變,DWI信號為高強度信號,增強掃描發現為結節樣增強。見表1(圖1)。
2 術后12個月復發情況 術后1個月T1WI高信號環完整共100個病灶,術后12個月15個病灶復發,復發率為15%;高信號環不完整共6個病灶,復發率為66.67%,兩者比較差異有統計學意義(P<0.05)。見表2(圖1)。

表175例患者106個病灶變化情況(病灶數)

表2術后1個月T1WI高信號環完整情況(病灶數)
3 治療后ADC值變化 治療前病灶區ADC平均值最小,正常區ADC值最大,三個位置ADC值比較差異均有統計學意義(P<0.05),治療后,三個位置ADC值略有差異,但差異無統計學意義(P>0.05),見表3。對于邊緣殘留及復發病灶與完全消融過渡區、正常肝臟組織、消融壞死病灶的ADC值比較發現,邊緣殘留及復發病灶ADC值均有下降,差異有統計學意義(P<0.05),見表4(圖1)。

表3射頻消融前后不同部位ADC值比較(×10-6/mm2)

表4邊緣復發病例的ADC值比較(×10-6/mm2)
討 論
射頻消融技術作為醫學常用非手術治療手段,從20世紀初開始應用于臨床,一直以來在小肝癌治療方面效果顯著,同時能夠提高患者5年生存率,并延長患者存活時間。RFA主要通過一定頻率的電磁波產生局部高溫,在超聲或CT引導下,通過插入瘤體內的電極發熱,凝固瘤體及周圍臨近組織。由于RFA具有良好的靶向性,能夠直接作用于腫瘤細胞,針對中晚期腫瘤患者具有一定的治療意義。特別對于小肝癌的治療有較好的效果,有報道稱,直徑在3 cm以下的小肝癌通過RFA完全消融率可達93%。
MRI技術具有無創傷、無輻射等副作用,對人體組織分辨率高[4],能夠通過T1WI、T2WI、動態增強及擴散加權成像(DWI)等方式作為肝癌的確定性診斷及術后隨訪的有效手段,目前普通影像學技術難以對術后再生結節與復發肝癌進行有效鑒別診斷,但MRI技術的應用對肝癌的早期診斷及預后檢測有著重要的應用價值,其組織分辨能力及敏感度可達90%以上。肝癌的MRI表現為T2WI部分或全部高信號、T1WI低信號,但不具有特異性,臨床上加掃DW序列及動態增強掃描進行鑒別診斷。在進行動態增強掃描影像學表現與腫瘤的血供方式密切相關,其時間-信號曲線表現為速升速降型,易與肝內占位性良性病變進行鑒別,針對不同分型的肝癌血供型均具有特殊的信號表現,肝癌的具體分型能夠通過MRI動態增強掃描進行確定。因此,在肝癌的治療后療效確診方面,動態增強掃描具有一定的臨床意義,同時能夠對殘留瘤體及復發腫瘤進行有效診斷。
動態增強掃描雖然能夠有效進行肝癌病灶確定性診斷,但對于過敏體質和腎功能不全的患者有一定局限性。而DWI技術受血供的影響較小,在肝癌檢查中具有較高的敏感性;利用測定表觀彌散系數(ADC)值,可在不使用對比劑的情況下定性或定量評估組織細胞中的水分子擴散信息,從而尋找出發生病變的組織細胞。DWI則是通過自旋轉回波T2加權序列中施加一對梯度脈沖,進而通過不同的梯度敏感因子獲得DWI序列信號值,從而計算組織ADC。而惡性腫瘤細胞生長較為活躍,細胞繁殖能力強,相對正常組織而言,細胞密度總體偏高,腫瘤內部水分子運動較為局限,擴散作用不明顯,因此隨著腫瘤惡性程度的增加ADC值顯著降低。通過DWI影像結合ADC值能夠從微觀對肝臟腫瘤進行描述,同時不同位置及惡性程度的不同ADC值也有差別,臨床上已逐步通過病變組織的ADC值對肝臟占位性病變進行確定性診斷[5-6]。同時在RFA術后進行隨訪過程中,通過DWI觀察消融灶形態,計算ADC值定量確定消融灶組織成分,消融后病灶的組織T2WI信號與ADC值隨b值的增加而減少,消融性壞死組織信號最低、ADC值最小,肝臟正常組織信號最高,新生肉芽組織ADC值最大,因此,RFA治療后ADC值、DWI信號越高證明治療效果越顯著。
研究在RFA術后1、3、6、12個月分別進行隨訪并收集影像學資料可以看出,術后1個月由于消融區范圍超過病灶本身周圍0.5 cm左右,102個病灶顯示較術前增大,因高溫損傷細胞致脫水、凝固壞死,其MRI表現為病灶周邊環形T1WI高信號,病灶區增強掃描DWI并無高信號改變,并且由于病灶內液化、壞死、出血等情況存在[7],信號呈現復雜樣。 12個月隨訪時,96個病灶縮小,病灶周邊血管炎癥反應及肉芽組織增生[8-9],動態增強掃描可看出病灶部位環形薄層強化。
研究結果表明,RFA治療隨訪中,T1WI高信號環不完整的6個復發病灶中,復發部分存在于T1WI高信號環缺失處,腫瘤復發與T1WI高信號環的完整程度呈正相關,此時由于高信號缺失處腫瘤細胞仍有殘留,MRI表現RFA術后邊緣不規則結節樣,長T1/T2信號改變,DWI高信號,動脈期顯著強化,對于RFA術后殘留或復發病灶,通過12個月隨訪復查及影像學資料分析,腫瘤殘留或復發多數位于原病灶的邊緣部分,即為T1WI高信號環不完整區域,其 T1WI 信號低于消融壞死灶,尤其在 RFA 術后的邊緣出現稍長 T2信號往往提示復發,門靜脈期和延遲期相對低信號,動態增強掃描可見“快進快出”,隨著隨訪時間延長復發病灶范圍會增大,復發時間多為術后5個月;而射頻消融術導致的炎癥反應表現為逐漸強化,長期隨訪逐漸消散。雖然研究中100個T1WI高信號環完整的病灶中仍有15個復發,可能由于周圍組織再生性惡變結節累及,并非原病灶RFA施術不徹底。與明韋迪[10]相關研究結果一致。因此T1WI高信號環完整與否與患者RFA術后復發情況呈正相關,表明MRI在肝癌RFA術后隨訪的應用意義。也有學者認為復發灶的“快進慢出”型表現與典型肝癌的影像學表現略有不同,研究證實與患者肝靜脈受損回流受阻有直接關系,主要由于大血管血流流速較快,毗鄰區病灶消融針溫度降低,可能在RFA時造成病灶消融不徹底, RFA術后“熱沉降”效應[11],研究中5個復發灶動態增強掃描表現為持續強化。
通過全面分析所有納入研究病例病理學資料,結合影像學表現,RFA術前的病灶T1WI低信號,T2WI稍高信號,部分病灶液化壞死區域為較高信號;其中病灶位于肝動脈供血區域的動脈期結節狀強化,門靜脈期信號下降,平衡期表現相對其余肝組織為低信號;另由于門靜脈參加供血,5個病灶門靜脈期強化。
研究發現,RFA術前病灶細胞密集或核漿比率高、自由水活動受限,DWI序列均呈現高信號,ADC圖顯示低信號區,治療前病灶及邊緣部位、病灶以遠肝臟組織的ADC值逐漸增加,且差異有統計學意義;術后,由于消融灶成分復雜,部分病灶液化壞死灶或炎性反應,DWI 信號仍呈現高信號,因此單純的 DWI 圖像對于鑒別殘留或復發帶來困難。但是通過ADC值發現,完全消融灶、過渡部位、正常肝臟組織三部位的 ADC 值雖略有差異,但相比較差異無統計學意義;而在治療前后消融灶及其過渡部位的 ADC 值與治療前相比差異均有統計學意義;邊緣殘留及復發病灶的 ADC 值與復發前相應區域、壞死區、正常肝臟組織相比均有下降結果與DSA影像學提示相符。因此,ADC 值的定量有助于射頻消融術后療效的評估。
本研究樣本量較為單一。DWI圖像上信號變化的判斷仍需年資較長的影像學醫師進行辨認,可能存在一定的誤差。由于 ADC 圖病灶的邊緣部分清晰度欠佳,選擇 ROI 時有可能不夠準確,ADC值計算可能產生誤差。RFA術后患者很少進行有創傷的病理檢查,因此無法證實肝臟組織成分是否與研究相符,只能通過 DSA或長期隨訪觀察病灶的信號及范圍。
綜上所述,核磁共振技術組織分辨率高,多序列、多方位成像,獲得的診斷信息豐富。MRI結合DWI及ADC值的測量能夠更加準確定性原發性肝癌,辨別殘留、復發的腫瘤組織,為臨床治療提供有效支持。

