茶氨酸處理腦缺血后大鼠海馬血紅素加氧酶-1表達及細胞凋亡的影響研究
高 靜,邊步榮,高彥東,薛榮亮
1.延安大學第二附屬醫院(陜西省榆林市第一醫院)麻醉科(榆林 719000);2.西安交通大學第二附屬醫院麻醉科(西安 710004)
氧化應激損傷和細胞凋亡是腦缺血再灌注損傷的兩種主要機制[1]。血紅素加氧酶-1(Heme oxygennase-1,HO-1)具有潛在的細胞保護作用,也是目前發現最易受誘導的酶,能被各種引起氧化應激的因素所誘導而增加表達,其代謝產物具有強大的抗氧化能力[2-3]。而細胞凋亡具有主動性、選擇性、可逆性,大多發生在細胞壞死之后,如能采取恰當的處理措施,有效抑制和逆轉細胞凋亡,將有利于腦再灌注損傷的治療,改善神經系統轉歸[4-5]。茶氨酸屬于保健食材,本課題組前期的研究已證明其通過抗氧化作用、降低神經元的氧化水平對腦缺血再灌注損傷有保護作用[6-7]。本實驗擬探討茶氨酸腦保護作用的機制是通過上調HO-1的表達來進行,還是通過自身減少氧化應激損傷和抑制細胞凋亡來實現,報告如下。
材料與方法
1 實驗材料 健康清潔雄性SD大鼠270只,體重180~220 g,由西安交通大學醫學院動物中心提供。L-茶氨酸(美國genview公司),HO-1單克隆抗體(StressGen),SABC免疫組化試劑盒(武漢博士德生物試劑公司),原位細胞凋亡檢測試劑盒(美國SIGMA公司),HO-1引物(北京三博遠志生物有限公司),GAPDH引物(北京三博遠志生物有限公司),流式細胞儀(美國BD公司),PCR合成儀(美國ABI公司),多重實時定量熒光PCR儀(德國伯樂公司),GAPDH基因序列181 (cattgacctcaactacatggtctacatgttccagtatgactctacccacggcaagttcaa),241(cggcacagtcaaggctgagaatgggaagctggtcatcaacgggaaacccatcaccatctt),301(ccaggagcgagatcccgctaacatcaaatggggtgatgctggtgctgagtatgtcgtgga),121(ggttaccagggctgccttctcttgtgacaaagtggacattgttgccatcaacgacccctt),HO-1基因序列1021(tctcatgtagccttctctctgcaggggagaatcttgcctggctctcttttcttgggcctc),1081(taagaaagcttttggggttcctcgcccccttcctgtgtcttcctttgtctctctggaatg),1141(gaaggagatgcctggcacatttccctcaccaaaagcacagccaggggcctgaacttggaa)。
2 實驗方法 采用隨機數字表法,將大鼠分為三組:假手術組(PO組),腦缺血再灌注組(IR組),茶氨酸組(TH組)。采用四血管阻斷法建立大鼠全腦缺血再灌注損傷模型,茶氨酸干預組于全腦缺血模型建立后3 min經尾靜脈注射25%茶氨酸溶液4 ml/kg(即1000 mg/kg),其余兩組分別尾靜脈注射生理鹽水4 ml/kg。大鼠分別于再灌注后2 h、6 h、12 h、24 h、48 h處死取腦組織,HE染色觀察海馬結構形態變化;IHC免疫組化染色(一抗為小鼠IgG,濃度為1∶50)和實時定量PCR觀察HO-1蛋白在海馬各個時點的表達變化;TUNNEL染色和流式細胞儀觀察海馬各個時點細胞凋亡情況。
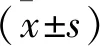
結 果
1 HE染色海馬CA1區形態學改變 光鏡下可見PO組各時點大鼠海馬CA1區椎體細胞3~4層排列整齊而緊密,胞質淡紅色,胞核藍色(圖1);IR組48 h,海馬椎體細胞失去正常結構,排列紊亂,細胞皺縮,數量減少(圖2);TH組在組織形態學上較IR組有改善,細胞數量也較IR組增加(圖3)。
2 免疫組化染色(IHC) PO組各時點海馬組織幾乎無棕黃色淡染的HO-1陽性細胞,齒狀回可見少量HO-1陽性的棕黃淡染細胞(圖4)。IR組24 h海馬HO-1陽性細胞增加,海馬齒狀回細胞幾乎均被棕染(圖5),HO-1蛋白大量表達。TH組與IR組比較24 h明顯可見棕黃淡染陽性細胞數量減少(圖6)。

3 原位細胞凋亡檢測 PO組各時點海馬組織幾乎無棕色淡染的凋亡細胞(圖7);IR組48 h齒狀回棕色淡染的陽性凋亡細胞遍布整個視野(圖8);TH組48 h齒狀回棕黃淡染的凋亡細胞明顯減少(圖9)。

4 流式細胞儀檢測凋亡 結果顯示PO組凋亡率較低(圖10),IR組凋亡率在缺血再灌注6 h后明顯上升(P<0.05),在再灌注48h后到達頂峰(圖11)。TH組凋亡率在各時間點均低于IR組(P<0.05),見表1。

表1大鼠全腦缺血再灌注后個時點海馬凋亡率比較(%)

組 別n2 h6 h12 h24 h48 hPO組614.73±1.3015.07±1.3815.37±0.6515.48±0.4115.58±0.32IR組619.83±0.52?21.32±0.83?24.58±0.86?25.31±0.63?27.79±1.18?TH組618.29±1.54#20.77±0.84#24.18±0.79#24.8±0.51#27.19±0.73#
注:PO組與IR組相比*P<0.01;IR組與TH組相比,#P<0.01
5 HO-1的時程表達 PO組HO-1 mRNA表達量低,IR組HO-1表達量與PO組比較,差異有統計學意義(P<0.01),2 h開始升高,持續到24 h,在48 h時表達水平稍有回落, IR組與TH組比較差異有統計學意義(P<0.05),TH組每個時間點HO-1 相對表達量均低于IR組。見表2、3。

表2海馬組織GAPDH、HO-1 real-time PCR CT值

表3海馬組織HO-1相對表達量
注:IR組與PO組相比,*P<0.05;TH組與PO組相比,#P<0.05
討 論
腦缺血再灌注損傷過程中,氧化應激反應、細胞凋亡均是參與其中的重要病生機制[7],盡管已取得了令人振奮的研究進展,但再灌注損傷仍然是臨床上棘手的病生現象,是對臨床醫生的嚴峻挑戰。
HO-1是血紅素分解代謝的起始酶和限速酶,分解血紅素產生一氧化碳(CO)、鐵離子和膽綠素,在受到氧化應激時被誘導表達,有潛在的細胞保護作用。其代謝產物之一膽綠素擁有強大的抗氧化能力,可以直接清除自由基,抑制脂質過氧化,阻斷氧化應激損傷;代謝產物之二CO,擴血管、抑制血小板聚集、增強血流灌注、穩定細胞膜,從而抑制氧化應激損傷;鐵離子調節包括HO-1自身在內的多種基因表達。離體實驗研究顯示,HO-1基因敲除的神經元對氧化應激損傷敏感性增加,而HO-1表達上調則增加神經元對氧化應激的耐受性。HO-1誘導表達是神經元對氧化應激損傷做出反應過程的重要事件[8-9]。
本實驗發現,全腦缺血再灌注后,24 hHO-1陽性細胞在海馬結構大量表達,齒狀回完全黃染,48 h表達量有所回落。實時定量PCR顯示,PO組HO-1 的表達較低,IR組HO-1的表達量從2 h開始升高,持續到24 h,48 h略有回落。這些結果均與現有研究發現相一致,進一步證實了腦缺血再灌注對大腦的應激刺激和HO-1的受誘導表達。
茶氨酸作為一種食品添加劑已廣泛用于點心、糖果、果凍、口香糖等,毒性實驗中未發現其毒性[10],既往的研究發現,茶氨酸具有抑制咖啡堿引起的興奮、舒緩神經、降血壓和增強免疫力等多種保健及藥用功能,開發應用前景廣闊。
在我們的實驗中,給予缺血再灌注大鼠茶氨酸干預后,在各個時間點HO-1陽性細胞在海馬結構表達減少,海馬組織HO-1 mRNA表達下降,且均低于IR組,所以推論,在受到腦缺血再灌導致的氧化應激刺激后,茶氨酸是通過其自身的抗氧化應激能力,減少缺血再灌注損傷,而非通過上調HO-1的表達來發揮其腦保護作用。
細胞凋亡是腦缺血再灌注損傷的一種主要機制,是一種由基因控制的細胞自主性死亡,具有主動性、選擇性和可逆性的。腦缺血再灌注后凋亡的發生較為滯后[11],因此,如能采取恰當措施有效抑制和逆轉細胞凋亡的發生,將有利于腦損傷的改善和治療。在本次實驗中,通過原位細胞凋亡檢測法(TUNEL)和流式細胞儀檢測法,發現在腦缺血再灌注發生后的2 h、6 h、12 h、24 h、48 h,細胞的凋亡率不斷增加,在48 h達到了凋亡峰值。且在各個時間點IR組凋亡率均高于PO組,在腦缺血再灌注后給予茶氨酸注射干預,TH組各個時間點的凋亡率均顯著下降。說明茶氨酸可以降低海馬組織的細胞凋亡,對全腦缺血再灌注損傷有改善作用。
本實驗還發現,腦缺血再灌注后,隨著時間增加,細胞凋亡率增加,HO-1表達降低,細胞凋亡率與HO-1表達呈負相關,所以,生理劑量的HO-1蛋白的抗氧化應激能力,并未達到降低細胞凋亡的作用。HO-1蛋白與細胞凋亡之間的劑量關系及相關機制,還有待進一步實驗加以探索。
綜上所述,在全腦缺血再灌注后給予茶氨酸干預,海馬結構組織細胞學得到改善,細胞凋亡減少,但HO-1蛋白表達降低,由此推論腦缺血再灌注損傷發生后,茶氨酸通過其自身抗氧化應激能力發揮腦保護作用,而不是通過上調HO-1蛋白的表達來發揮其保護作用,并進一步證明茶氨酸可通過抑制凋亡來發揮腦保護作用。

