縣級醫院開展腹腔鏡下保留腎單位手術的經驗體會
袁雪鋒,蔣旭平,秦振乾,周偉民
(江蘇大學附屬宜興醫院泌尿外科,江蘇宜興 214200)
CLAYMAN[1]在1991年首次報道腹腔鏡下腎輸尿管切除術,開啟腹腔鏡在泌尿外科中的應用。近年來,腎腫瘤保留腎單位手術(nephron sparing surgery,NSS)逐漸受到人們的重視,該技術不僅保證了腎腫瘤的完整切除,還最大限度地保護了腎臟功能[2]。而腹腔鏡下保留腎單位手術(laparoscopic partial nephrectomy,LPN)與開放手術相比術中出血量少、術后恢復快、切口美觀[3],但其專業性和技術性較強,對臨床醫生的內鏡操作和臨床經驗要求較高,對于縣級醫院醫生來說更是不小的挑戰。宜興市人民醫院(宜興為縣級市,故本院屬縣級醫院范疇)從2013年獨立開展LPN以來,已經完成了171例局限性腎腫瘤的治療。本文將對此做相應分析總結,分享該類手術在縣級醫院開展的經驗體會。
1 資料與方法
1.1 一般資料回顧性分析2013年1月至2018年7月宜興市人民醫院LPN患者171例。入組標準:①患者無合并重大器官功能障礙;②首次由于腎臟腫瘤住院治療;③排除孤立腎患者及雙側腎臟發生癌變的患者;④計算機斷層掃描(computed tomography,CT)檢查證實無靜脈癌栓,無臨近組織的侵犯和轉移;⑤RENAL評分≤9分。根據CT及腎動脈非創傷性血管成像技術(computed tomography angiography,CTA)等影像學資料,選擇經腹膜后途徑或經腹腔途徑手術。其中經腹膜后途徑組112例,年齡28~79歲,平均年齡61.2歲,11例患有糖尿病。經腹腔途徑組患者59例,年齡30~80歲,平均年齡61.0歲,其中有3例患有糖尿病。2組患者在性別、年齡等指標上無明顯差異(表1),均無明顯手術禁忌證。
表1 2組患者的一般資料
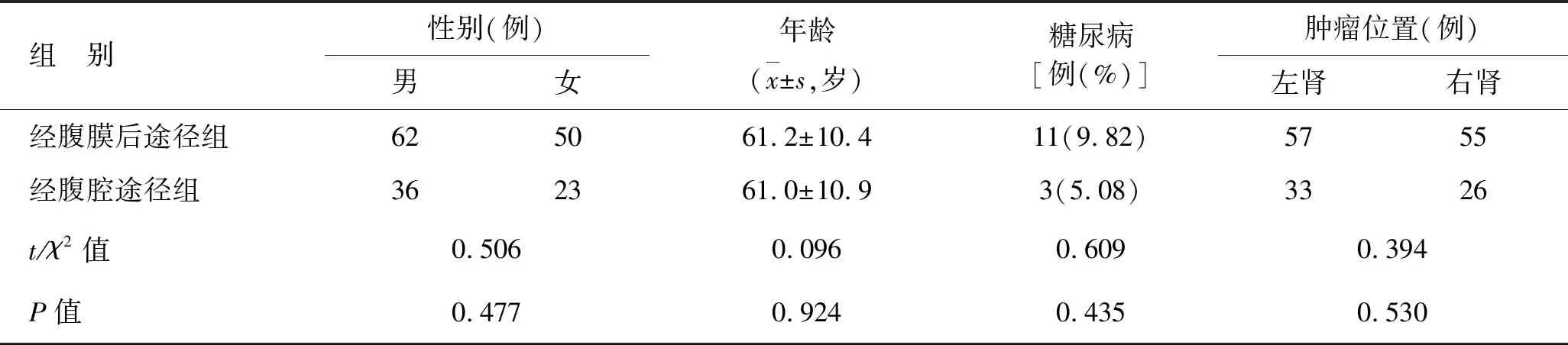
組 別性別(例)男女年齡(x±s,歲)糖尿病[例(%)]腫瘤位置(例)左腎右腎經腹膜后途徑組625061.2±10.411(9.82)5755經腹腔途徑組362361.0±10.93(5.08)3326t/χ2值0.5060.0960.6090.394P值0.4770.9240.4350.530
1.2 手術方法
1.2.1經腹膜后途徑 靜吸復合氣管內插管,全身麻醉,留置導尿,健側臥位,腰部墊高,升高腰橋,腋后線肋緣下切口2 cm,鈍性分離肌層至腰背筋膜下,食指剝離腹膜后間隙,置入自制球囊充氣約800 mL保留5 min,于腋前線肋緣下和髂嵴上2 cm分別切口置入5、10 mm鞘卡。腋后線留置12 mm鞘卡,7號絲線縫閉切口。超聲刀清除腹膜外脂肪,貼近腰肌縱行切開側錐筋膜和腎筋膜后層,進入腰大肌前間隙,平腎臟中部水平向內側游離至腰大肌內緣,尋及搏動的腎動脈,超聲刀切開腎動脈表面的束狀組織,打開腎動脈外鞘,直角鉗游離其主干長1~1.5 cm,有多支腎動脈則逐一分離。縱行切開腎筋膜前層,根據術前影像學資料游離腎臟的病變部位,顯露腎腫瘤及周圍腎實質,保留瘤體表面脂肪,必要時游離整個患腎。用“Bulldog”血管夾阻斷腎動脈并記錄熱缺血時間,距瘤體邊緣約0.5 cm剪開腎實質并切除腫瘤,保證腫瘤包膜完整。創面用雙極電凝或超聲刀慢擋止血或覆蓋止血紗布,2-0可吸收倒刺線連續全層縫合腎實質,用Hem-o-lok夾閉線尾。解除腎動脈阻斷,降低氣腹壓力,妥善止血,標本置入標本袋,留置腹膜后引流管,縫合切口。
1.2.2經腹腔途徑 全身麻醉,留置導尿,健側45°斜臥位,患側鎖骨中線肋緣下切口1 cm,切開腹壁各層,置入氣腹針并設置注氣壓力12~14 mmHg,穿刺10 mm鞘卡,腹腔鏡監視下于臍上3 cm患側腹直肌外緣、臍下3 cm患側腹直肌外緣和髂前上棘內上方3 cm分別置入10、10、5 mm鞘卡。左側用超聲刀于降結腸外側切開側腹膜,游離至脾臟外上方,將脾臟、結腸脾曲和降結腸推至內側,顯露后方的腎筋膜,游離至腎蒂水平。右側從升結腸旁溝向上游離至肝結腸韌帶,顯露腎筋膜后將十二指腸及結腸推向內側,顯露下腔靜脈和生殖靜脈。在腎下極水平,左側于腹主動脈外方,右側于下腔靜脈外方游離顯露輸尿管,將輸尿管及腎下極挑起,沿主動脈或下腔靜脈向腎蒂游離。顯露腎臟動脈,充分游離腎動、靜脈,并游離腎臟。分離腎周脂肪,暴露腫瘤,與經腹膜后途徑同樣步驟阻斷腎動脈并完整切除腫瘤,創面縫合止血,取出標本,留置腹腔引流管,縫合切口。
1.3 觀察指標比較2組患者的手術時間、熱缺血時間、出血量和并發癥的發生率,并根據患者術前及術后的血清肌酐,用適宜中國人群的腎臟病飲食改良(modification of diet in renal disease,MDRD)公式計算患者術后腎小球濾過率估值(estimated glomerular filtration rate,eGFR)的變化,具體公式如下:
eGFR=186×CRE-1.154×age-0.203[×0.742(女)][4]
公式中CRE為血清肌酐,單位“mg/dL”;age為年齡,單位“歲”;eGFR單位為“mL/(min×1.73 m2)”。
2 結 果
2.1 兩組手術時間、熱缺血時間、術中出血量及eGFR的變化兩組患者均順利完成手術,無中轉開放。經腹腔途徑組手術時間及熱缺血時間均長于經腹膜后途徑組,且差異有統計學意義(P=0.002),而兩組間的術中出血量沒有明顯差異(P=0.384)。經腹膜后途徑組術前eGFR為(101.78±29.56)mL/(min×1.73 m2),術后eGFR為(77.93±21.65)mL/(min×1.73 m2);經腹腔途徑組的術前eGFR為(105.72±26.26)mL/(min×1.73 m2),術后eGFR為(78.64±20.66)mL/(min×1.73 m2),兩組間的術后eGFR下降值未見明顯差異(P=0.215,表2)。
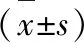
表2 2組患者圍手術期資料比較

項 目經腹膜后途徑組(n=112)經腹腔途徑組(n=59)t值P值腫瘤最大徑(cm)3.88±1.745.84±1.57-7.229<0.01手術時間(min)153.7±25.5193.0±32.2-8.723<0.01熱缺血時間(min)24.8±6.227.7±4.4-3.1820.002出血量(mL)111.4±51.3104.4±47.50.8720.384eGFR下降值[mL/(min×1.73 m2)]23.85±15.2527.08±17.61-1.2460.215
2.2 手術并發癥的發生率在術中,經腹膜后途徑組出現2例術中大出血,均得到有效控制,經腹腔組出現1例周圍臟器損傷和1例術中出血并在術中及時修補止血;在術后,經腹膜后途徑組出現3例皮下氣腫,1例切口感染,2例繼發性出血,其中并發切口感染者為糖尿病患者,經腹腔途徑組出現2例皮下氣腫,1例尿漏和2例繼發性出血,予對癥處理后均恢復。2組患者術中并發癥[1.8%(2/112)vs.3.4%(2/59),P=0.898]、術后并發癥[5.4%(6/112)vs.8.5%(5/59),P=0.644]以及總體手術并發癥的發生率[7.1%(8/112)vs.11.8%(7/59),P=0.299]差異均無統計學意義。
2.3 術后病理及隨訪結果經腹膜后途徑組和經腹腔途徑組術后病理測得腫瘤最大徑分別為(3.88±1.74)cm和(5.84±1.57)cm,差異具有統計學意義(P<0.05)。經腹膜后途徑組術后病理顯示:腎細胞癌95例(透明細胞癌92例,嫌色細胞癌2例,乳頭狀腎細胞癌1例)、腎血管平滑肌脂肪瘤17例。經腹腔途徑組術后病理顯示:腎透明細胞癌54例、腎血管平滑肌脂肪瘤5例。所有患者術后隨訪3個月~5年,經B超、胸腹部CT檢查均未見腫瘤復發或轉移。
3 討 論
隨著影像學技術的發展和人們健康意識的不斷增強,無癥狀腎癌的檢出率逐年上升[5]。多中心研究結果表明:單側局限性腎腫瘤行根治性腎切除術和NSS的生存率、復發率和遠處轉移率沒有明顯差異[6-7]。UZZO[8]的回顧性分析顯示,NSS術后總體的局部復發率為0%~10%,而腫瘤≤4 cm手術后局部復發率僅為0%~3%。越來越多的證據表明,只要技術可行,NSS的適應證可適當放寬,使患者獲得更高的生存質量[9-10]。NSS可經開放性手術或腹腔鏡手術進行,開放性腎部分切除術目前仍是腎部分切除術的標準治療技術,而腹腔鏡或機器人腹腔鏡腎部分切除術是可選擇的治療手段之一。目前腹腔鏡手術已被業界廣泛接受及采用,但主要在地級市以上三甲醫院開展,設施條件、醫生觀念及缺乏規范專業的腹腔鏡技術等是縣級醫院腹腔鏡手術開展的主要限制因素[11]。近年來,縣級醫院在硬件設施方面逐漸進步,如今開展腹腔鏡技術的關鍵就在于醫生的專業技術。我院先派送醫護人員到上級醫院進修學習,再請專家來本院教學示范,并逐漸轉為在專家指導下完成手術,最后由本院醫生獨立操作。
開始獨立開展LPN時,最重要的是選擇合適的病例。我們入組的病例均為單側的局限性腎腫瘤,沒有臨近組織的侵犯和轉移,并在術前運用RENAL評分系統選擇評分≤9分的患者[12]。RENAL評分主要從以下5 個方面進行評估:腫瘤的最大直徑(R);是否外生性(E);腫瘤與腎竇和集合系統的距離(N);是否位于腎臟腹側(A);距離腎臟縱軸位置(L)。總得分4~6分為低分組,7~9分為中分組,10~12分為高分組。
對于選擇腹膜后入路還是經腹入路行LPN,應視腫瘤所在的部位而定,一般靠背側和外側的腫瘤無論上下極均首選腹膜后入路較易處理,該入路無需切開后腹膜,不受腹腔內器官干擾,但存在手術空間及視野相對狹小的缺點[13];而位于腹側上極或腎門部的腫瘤應首選經腹路徑手術,此路徑穿刺點選擇范圍大,解剖標志清晰,對腎門的暴露及處理比較容易,有利于縫合和重建,若出現副損傷容易處理[14],腎下極的腫瘤如體積較大也可選擇此路徑,更有利于暴露和縫合。本組171例患者中112例采取經腹膜后途徑,59例為經腹腔途徑,經腹膜后途徑組的手術時間為(153.7±25.5)min,相對經腹腔組的(193.0±32.2)min,差異有統計學意義,而術中出血量、腎功能的改變及并發癥發生率并無明顯差異,說明通過經腹膜后途徑和經腹腔途徑行LPN治療局限性腎腫瘤均安全有效,這與腎癌根治術的相關研究結果相一致[15-16]。
在LPN術中,術中失血量過多或腎動脈阻斷時間過長均是影響術后腎功能的主要危險因素[17-18],如何既縮短熱缺血時間又減少術中失血是泌尿外科醫生的目標。對于較大體積的腫瘤,為了提高部分切除的成功率,可先行介入栓塞阻斷腫瘤血管,減少術中出血,術中視出血情況決定是否行主干動脈阻斷,從而最大限度保障剩余腎組織的功能[19],本組病例中有8例患者腫瘤體積>7 cm,在術前行腎動脈CTA檢查,并行選擇性腎動脈栓塞術,手術達到了良好的預期效果。在縫合腎臟創面時,除非術中損傷集合系統需單獨修補縫合外,一般只需用可吸收線單層縫合腎實質切緣就可達到確切止血的目的,這是因為腎動脈是終端動脈均無交通支存在[20]。單層縫合可明顯縮短縫合的時間,而連續縫合減少了置針和調整的時間可進一步縮短熱缺血的時間。
目前對腎腫瘤是行部分切除還是剜除存在爭議。我們認為,為了確保術中腫瘤的完整性,可先在距腫瘤一定的距離處切開腎實質,當分離到達腫瘤的最大徑時可結合鈍性剝離來剜除腫瘤的根部,這樣既可以避免分破腫瘤包膜,又可以減少集合系統的損傷。
為響應國家醫改“大病不出縣”的政策號召,縣級醫院需要不斷發展自身的臨床技術。本單位從嘗試到熟練開展LNP手術,證實了該手術在縣級醫院開展的安全性和可行性,為同級單位提供經驗參考。